Лечение сахарного диабета 2 типа – новое понимание проблемы (консенсус ADA/EASD, 2008)
- Аннотация
- Статья
- Ссылки
Клинические последствия СД 2 хорошо известны – это поздние сосудистые осложнения диабета, ведущие к ранней инвалидности и высокой смертности пациентов, уменьшению продолжительности жизни и ухудшению соматического здоровья. СД 2 приводит к четырехкратному увеличению смертности от сердечно-сосудистых заболеваний (ССЗ), является ведущей причиной развития терминальной почечной недостаточности, потери зрения у людей работоспособного возраста и нетравматической ампутации нижних конечностей. Кроме того, смертность от СД 2 в три раза превышает средние показатели ВОЗ. Расходы, связанные с лечением хронических осложнений диабета, намного превосходят те, что необходимы для гликемического контроля, и, несомненно, тяжкое бремя для любой системы здравоохранения в мире.
Несмотря на сложные патогенетические механизмы поздних осложнений СД 2, установлено, что основной их причиной является хроническая гипергликемия (12). Однако серьезность этой медико-социальной проблемы усугубляется не только ростом распространенности заболевания, но и ухудшением гликемического контроля: большинство пациентов в разных странах мира, в том числе и в России, не достигают рекомендованных терапевтических целей. Следовательно, повсеместно существуют серьезные проблемы в отношении управления СД 2, в том числе в выжидательной врачебной тактике и не использовании активных методов лечения, способных эффективно повлиять на конечный результат.
Поскольку патогенез СД 2 становится более понятен, терапия может быть приближена к функциональным возможностям β-клеток и направлена на основные патофизиологические механизмы повышения гликемии. Ясно, что ранняя и эффективная профилактика диабетических осложнений также требует оптимального лечения СД 2 с достижением целевых метаболических показателей с момента дебюта заболевания: к моменту постановки диагноза СД 2 у 50% больных выявляются два и более осложнения, что, к сожалению, сегодня не реализуется в полной мере (10).
Область исследований СД 2 постоянно расширяется; появление новых доказательств и более обширных клинических данных для оценки обоснованности выбора того или иного варианта фармакотерапии, а также новых сахароснижающих препаратов побудило в октябре 2008 г. Американскую диабетическую ассоциацию (ADA) совместно с Европейской ассоциацией по изучению диабета (EASD) опубликовать обновленный консенсус − практический алгоритм для инициации и подбора фармакотерапии СД 2 (8). Новое консенсусное заявление вносит важные дополнения и уточнения в алгоритм фармакотерапии СД 2, опубликованный этими организациями в 2006 году (7).
Терапевтической целью, согласно обновленному руководству ADA/EASD, является достижение и поддержание уровня HbA1c насколько можно ближе к физиологическому (<7,0%): на любом этапе лечения СД 2 показатель HbA1c ≥ 7,0% следует рассматривать как сигнал к активному действию − изменению фармакотерапии. Однако, как подчеркивают авторы руководства, указанная цель терапии заболевания может быть неприемлема для некоторых пациентов, у которых требуется оценка возможного соотношения пользы/рисков ее достижения (ожидаемая продолжительность жизни, риск гипогликемий, наличие факторов риска ССЗ). Также подчеркивается, что управление гликемией исторически занимает центральное место в лечении СД 2, однако другие сопутствующие этому заболеванию патологические состояния – дислипидемия, гипертензия, гиперкоагуляция, ожирение и инсулинорезистентность – являются важными объектами исследований и лечебного воздействия.
В материалах обновленного консенсуса содержатся четкие принципы выбора антигипергликемического вмешательства, согласно которым необходимо оценивать не только эффективность сахароснижающего действия, но и другие фармакологические характеристики препарата (профиль безопасности, переносимость); важны и дополнительные метаболические эффекты, которые могут замедлить прогрессирование хронических осложнений, и эффекты, влияющие на сердечно-сосудистые факторы риска, ИМТ, инсулинорезистентность/инсулиносекреторную активность.
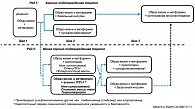
Данный практический алгоритм предусматривает последовательную пошаговую стратегию фармакотерапии, начиная с момента диагностики СД 2 лечение метоформином вместе с модификацией образа жизни (шаг 1) (рисунок 1). Изменение образа жизни проводится с целью улучшения гликемии, артериального давления, липидного профиля; а также с целью снижения массы тела или, по меньшей мере, отсутствия ее прибавки. Отмечено, что даже небольшое похудение порядка 4 кг положительно сказывается на гликемии. Метформин, при условии, что противопоказания к его применению отсутствуют, является препаратом первого выбора ввиду его эффективности, отсутствия прибавки в весе и гипогликемий, низкой стоимости. При хорошей переносимости метформин титруют до максимально эффективной дозы в течение 1-2 месяцев.
По мере утраты эффективности терапии на этом этапе следует рассмотреть вопрос о необходимости ее незамедлительного изменения (шаг 2). Для большинства пациентов с СД 2 предлагается основной вариант алгоритма («хорошо подтвержденная базовая терапия»), с назначением вмешательств, имеющих высокий уровень доказательности в отношении эффективности и экономической целесообразности.
Инсулинотерапия относится к одному из наиболее востребованных в диабетологии подходов. Однако еще до недавнего времени отсутствовала четкая единая концепция о назначении инсулинотерапии больным СД 2.
Теперь она появилась − согласно обновленному консенсусу ADA/EASD по лечению СД 2 (2008), необходимо раннее назначение базального инсулина. Этому способствовали следующие обстоятельства: высокая клиническая эффективность инсулина в снижении HbA1c, доказанная в ряде контролируемых исследований, а также внедрение в практику новых препаратов инсулина с улучшенными фармакологическими характеристиками. Современные инсулины – это наиболее эффективные гипогликемизирующие препараты, показанные в самых разных клинических ситуациях, от неотложных вмешательств до длительной терапии, при которой достигается выраженное снижение HbA1c до 3,5%, причем эффект по сравнению с ПССП достигается скорее (9, 14). Эффект инсулинотерапии проявляется не только в достижении и длительном поддержании гликемического контроля, но и в улучшении липидного профиля антиатерогенной направленности. Важно отметить, что для начала инсулинотерапии не требуется госпитализация больных.
Эксперты выделили два варианта терапии: «хорошо подтвержденная базовая терапия» и «менее подтвержденная базовая терапия». При основном варианте алгоритма («хорошо подтвержденная базовая терапия») шаг 2 – это добавление к метформину другого препарата, которым могут быть инсулин или препараты сульфонилмочевины (ПСМ). При добавлении второго препарата должны учитываться синергизм конкретной комбинации и другие лекарственные взаимодействия: инсулин в сочетании с метформином представляет особенно эффективную комбинацию для снижения гликемии, ограничивая в то же время прибавку массы тела больных. Решение о добавлении второго препарата необходимо принять в течение двух-трех месяцев от начала терапии или в любое время при не достижении целевого уровня HbA1c, а также в случае плохой переносимости метформина или противопоказаний к его назначению. Для больных СД 2 с HbA1c более 8,5%, а также для пациентов с клиническими симптомами гипергликемии, предпочтительно назначение базального инсулина. В отличие от первоначального алгоритма (2006 г.) в обновленном варианте тиазолидиндионы из этой категории лекарственных препаратов удаляются.
Практически все имеющиеся на сегодня базальные инсулины (инсулины среднего и длительного действия) обладают таким серьезным недостатком, как выраженные пики активности. Это повышает риск развития гипогликемии и затрудняет подбор эффективной дозы при титрации и соответственно достижение терапевтических целей. В настоящее время инсулин гларгин (Лантус) является единственным беспиковым аналогом человеческого инсулина для 24-часового контроля уровня гликемии (12, 14). Начало терапии пациента с СД 2 с применением базального инсулина может быть осуществлено посредством всего одной инъекции в день инсулина гларгина (Лантус), что вместе с простым и надежным алгоритмом титрации максимально упрощает старт инсулинотерапии. Введение гларгина, оправданное с патофизиологической точки зрения, эффективно подавляет избыточную продукцию глюкозы печенью, позволяет снизить глюкозотоксичность и уменьшить инсулинорезитентность. Однократная инъекция Лантуса обеспечивает максимально эффективный контроль гликемии независимо от времени введения в течение суток, значительно снижает риск гипогликемии и вариабельность концентрации глюкозы (3, 9, 11). Простота применения Лантуса, его высокая эффективность дает возможность сделать более гибким режим жизни пациентов с СД 2, способствует лучшей мотивации и повышению приверженности пациентов к инсулинотерапии. Длительная эффективная терапия Лантусом больных СД 2, 85-90% из которых имеют ожирение, не сопровождается отрицательным влиянием на массу тела (11, 13, 14).
Раннее и обоснованное назначение инсулинотерапии является основным фактором в длительном поддержании целевых уровней гликемии.
Международная группа по консенсусу рекомендует назначать базальный инсулин на ночь или утром, начиная с дозы 10 МЕ в день или 0,2 МЕ/кг. Далее дозу базального инсулина необходимо титровать, повышая на 2 МЕ каждые 3 дня на основе мониторинга ежедневных показателей глюкозы капиллярной крови натощак (ГКН) до тех пор, пока ГКН не достигнет указанного интервала (3,9 – 7,2 ммоль/л). При уровне ГКН более 10 ммоль/л нужно увеличить дозу на 4 МЕ каждые 3 дня. В случае гипогликемии или неадекватного уровня гликемии дозу следует снизить на ≥ 4 МЕ или на 10%, если доза составляет более 60 ед. Указанный режим лечения надо соблюдать, определяя в дальнейшем значения HbA1c каждые 2-3 мес. В целом потребность в инсулине индивидуальна и зависит от инсулинсекреторной способности β-клеток, сниженной на фоне глюкозотоксичности, и степени ИР. Тучным пациентам с СД 2, имеющим ИР различной степени выраженности, для достижения метаболического контроля может потребоваться 1 и более МЕ инсулина на 1кг массы тела в сутки. Следует подчеркнуть, что главным критерием адекватности дозы инсулина является уровень гликемии. Интересна ремарка авторов алгоритма относительно применения ПСМ на данном этапе лечения СД 2 – «ПСМ иные, чем глибенкламид (глибурид) или хлорпропамид». В практическом плане данная позиция, прежде всего, обусловлена существенными различия между представителями этой группы ПССП: при общем механизме действия каждый из ПСМ имеет особенности фармококинетики и фармокодинамики, которые могут реализоваться в ряде нежелательных эффектах, в том числе гипогликемии, тяжелые эпизоды которой наиболее часто наблюдаются у пожилых пациентов.
Гипогликемия выступает в качестве существенного лимитирующего фактора при назначении больным СД 2 любой сахароснижающей фармакотерапии. Согласно данным клинических исследований, наибольшее число случаев гипогликемии отмечается у принимавших глибенкламид и хлорпропамид, поэтому предпочтительнее другие ПСМ (2, 4). Несмотря на известные факторы риска гипогликемий, ПСМ длительного действия продолжают достаточно широко использоваться в основном из-за их высокой сахароснижающей активности, из-за невысокой стоимости. Следует заметить, что сопоставимое снижение гликемии на фоне ПСМ достигается с наименьшей стимуляцией секреции эндогенного инсулина при применении глимепирида: соотношение прироста инсулина/снижение гликемии в плазме крови у ПСМ различно и составляет в убывающем порядке: глибенкламид – 0,16, глипизид – 0,11, гликлазид – 0,07, глимепирид – 0,03 (6).
Следовательно, при минимальной секреции инсулина, стимулированной глимепиридом, достигается максимально эффективное снижение уровня гликемии. Глимепирид (Амарил) характеризуется 100% биодоступностью, быстрыми ассоциацией и диссоциацией с сульфонилмочевинным рецептором SURX (2, 15). Пролонгированное действие (24 ч) позволяет назначать его в режиме приема один раз в день, что не только удобно, но и безопасно для больных СД 2. Эти свойства глимепирида обеспечивают более низкую вероятность гипогликемических состояний. Еще одним преимуществом Амарила перед традиционными ПСМ является его высокая безопасность в отношении сердечно-сосудистой системы.
Как уже отмечалось, при выборе препарата нужно учитывать не только сахароснижающую эффективность, но и экстрагликемические эффекты: в инсулинрезистентных жировых и мышечных клетках стимуляция транслокации ГЛЮТ 4, вызываемая Амарилом, возрастает втрое и практически не отличается от таковой в нормальных клетках (2, 15). Препарат угнетает повышенную агрегационную активность тромбоцитов, снижая риск развития и прогрессирования сосудистых осложнений СД.
Шаг 3 включает дальнейшую коррекцию лечения: интенсификацию инсулинотерапии, которая может включать инсулин короткого или ультракороткого действия для контроля постпрандиальной гликемии. ПСМ на этом этапе лечения либо отменяются сразу, либо их доза постепенно уменьшается вплоть до полной отмены. Второй вариант управления гликемией («менее хорошо подтвержденная базовая терапия») содержит рекомендации по применению менее изученных препаратов, которые могут иметь преимущество в некоторых ситуациях, например, у пациентов, работающих на опасных работах, что делает у них крайне нежелательным возникновение гипогликемий. У таких пациентов в качестве второго шага может рассматриваться назначение либо пиоглитазона, либо агонистов глюкагоноподобного пептида-1 (ГПП-1); применять росиглитазон не рекомендуется. Пациентам, которым необходимо снизить вес и имеющим уровень HbA1c близкий к целевому (< 8.0%), может быть назначен экзенатид.
В дальнейшем, если эти вмешательства не позволяют достичь целевого уровня HbA1c либо плохо переносятся пациентом, эффект может иметь добавление ПСМ; либо второй терапевтический вариант алгоритма должен быть прекращен, а к лечению (модификация образа жизни и метформин) добавлен базальный инсулин.
Несмотря на то, что агонисты амилина, ингибиторы альфа-глюкозидазы, глиниды и ингибиторы дипептидилпептидазы 4 не включены в список предпочтительных агентов, эти классы препаратов могут иметь преимущество у отдельных пациентов. По сравнению с препаратами, рекомендованными в обоих вариантах алгоритма, их сахароснижающая эффективность эквивалентна или ниже, но они относительно дороги, а клинические данные по их применению еще ограничены. Приемлемость и корректность схемы терапии должны регулярно оцениваться для каждого пациента и при необходимости пересматриваться.
Таким образом, основополагающими принципами, предложенными ADA и EASD в обновленном консенсусном заявлении для управления гликемией (2007), являются следующие:
- терапевтической целью для больных СД 2 является достижение и поддержание значений гликемии, близких к нормальным (HbA1c < 7,0%);
- подход к лечению впервые выявленного СД 2 включает модификацию образа жизни и назначение метформина;
- если с помощью терапии первой линии не удается достичь или поддерживать целевые уровни гликемии, другие классы препаратов или режимы терапии должны быть добавлены без промедления;
- целесообразно раннее назначение инсулинотерапии пациентам, у которых вышеперечисленное не привело к достижению терапевтических целей.
В заключение следует подчеркнуть, что для российских врачей обновленный алгоритм с четкими практическими рекомендациями по лечению больных СД 2 является крайне своевременным и, что особенно важно, активное его претворение на практике – как основы лечения – позволит повысить эффективность медицинской помощи больным СД 2 и значительно улучшить прогноз для больных.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.