Глюкокортикостероидный остеопороз: современные подходы к терапии
- Аннотация
- Статья
- Ссылки
- English

Остеопороз (ОП) – одно из наиболее распространенных и социально значимых заболеваний [1]. Остеопороз характеризуется снижением минеральной плотности костной ткани (МПК), а также потерей структурных и биомеханических свойств, необходимых для поддержания гомеостаза кости.
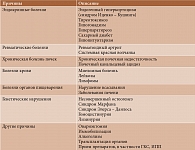
Различают первичный и вторичный ОП. Большинство случаев приходится на первичный ОП, развивающийся, как правило, на фоне постменопаузы. Причины развития вторичного ОП представлены в табл. 1 [2]. Значительная часть случаев развития вторичного ОП связана с ятрогенными факторами – приемом лекарственных препаратов.
Установлено, что применение ряда лекарственных средств приводит к снижению МПК и увеличению риска переломов [3]. К препаратам, способным вызывать ОП, в частности, относятся глюкокортикостероиды (ГКС), ингибиторы протонной помпы (ИПП), противосудорожные средства (табл. 2).
Глюкокортикостероидный остеопороз – наиболее частая и тяжелая форма вторичного остеопороза [4]. Это ятрогенное заболевание, развивающееся вследствие применения препаратов указанной группы для лечения различных патологий, в первую очередь иммуноопосредованных. К таковым относятся бронхиальная астма, ревматические болезни – ревматоидный артрит, системная красная волчанка, дерматомиозит, системные васкулиты и др.
Известно, что у 30–50% пациентов, получающих ГКС, развиваются переломы [5]. Даже низкие дозы ГКС – 3–10 мг/сут в пересчете на преднизолон способны индуцировать указанные события [6, 7].
Для глюкокортикостероидного ОП характерны быстрая потеря костной массы и увеличение риска переломов уже в начале проведения терапии. Это обусловливает необходимость первичной профилактики переломов у пациентов группы высокого риска [8].
У пациентов с глюкокортикостероидным ОП наиболее высок риск развития переломов позвонков, которые часто происходят бессимптомно [6]. Риск переломов возрастает в первые шесть месяцев терапии ГКС независимо от исходных показателей МПК [3, 9]. Кроме того, отмечается положительная корреляция с суточной дозой препарата – чем выше доза, тем больше риск развития переломов [10].
Кость – метаболически активная ткань, которая постоянно подвергается ремоделированию [11]. Способность кости выдерживать ежедневные нагрузки зависит от двух процессов: постоянной адаптации к нагрузкам (моделирование) и коррекции механических микроповреждений (ремоделирование). Оба процесса основаны на согласованной работе клеточных популяций, резорбирующих и формирующих кость. В результате старая костная ткань замещается новой, что поддерживает целостность скелета. При моделировании морфология костной ткани обычно изменяется, и этот процесс наиболее активен во время роста скелета. Ремоделирование не связано с процессом роста, оно затрагивает уже существующий скелет. Резорбция и образование костной ткани строго регулируются местными и системными факторами, что в норме обеспечивает баланс между этими процессами. Нарушение регуляции может привести как к ускоренной потере костной ткани (например, при остеопорозе), так и к избыточному ее накоплению (остеопетрозу). Последствия этих нарушений очень серьезны – повышается риск переломов и развития компрессионных синдромов.
Процесс ремоделирования кости обеспечивается за счет взаимодействия нескольких типов клеток: остеокластов, остеобластов и остеоцитов. Ремоделирование кости контролируется секретируемым остеоцитами склеростином. Остеокласты активируются макрофагальным колониестимулирующим фактором (М-КСФ) и рецепторным активатором лиганда ядерного фактора κB (RANKL). Остеопротегерин является регуляторной молекулой с противоположными RANKL биологическими эффектами. Зрелые остеобласты выделяют коллаген и формируют неминерализованную костную ткань, называемую остеоидом, которая минерализуется в течение нескольких месяцев. Минерализация остеоида требует адекватного уровня витамина D и кальция.
Таким образом, развитие ОП определяется дисбалансом между регуляторными факторами, влияющими на интенсивность процессов резорбции и образования кости.
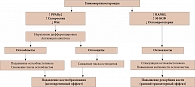
Для глюкокортикостероидного ОП характерно преобладание снижения костеобразования над увеличением резорбции кости. Указанные изменения отмечаются рано, однако являются временными (рисунок). Повышение костного метаболизма при отрицательном балансе ремоделирования приводит к быстрой потере костной массы [4].
ГКС вызывают повышенную экспрессию RANKL и М-КСФ остеобластами и подавление экспрессии остеопротегерина, что приводит к увеличению остеокластогенеза, продолжительности жизни и активности остеокластов. Как следствие, повышается резорбция кости, наблюдаемая в начале курса терапии ГКС [8]. Уменьшение костеобразования в дальнейшем обусловливает снижение костного обмена.
Непосредственные эффекты ГКС на формирование кости в значительной степени связаны со стимуляцией таких регуляторных механизмов, как повышение экспрессии белка-активатора пролиферации пероксисом γ2 (PPAR-γ2) и негативным воздействием на сигнальный путь «Wnt/β-катенин» (один из внутриклеточных сигнальных путей, регулирующий эмбриогенез, онкогенез и дифференцировку клеток) [4, 8]. Первый механизм способствует дифференцировке плюрипотентных клеток-предшественников на адипоциты (по сравнению с остеобластами). В результате этого количество остеобластов уменьшается. Повышенная экспрессия склеростина приводит к ингибированию сигнального пути «Wnt/β-катенин» и, как следствие, снижению дифференцировки предшественников остеобластов в зрелые остеобласты, а также увеличению апоптоза остеобластов и остеоцитов [4].
ГКС обладают широким спектром опосредованных эффектов на кость [12]. Так, снижение минерализации костной ткани обусловлено их влиянием на уменьшение всасывания кальция [5], подавление гормона роста [13], изменение выработки половых гормонов [5, 14], работу паращитовидных желез [5, 15].
Таким образом, ГКС уменьшают костеобразование и увеличивают резорбцию кости, что приводит к потере костной ткани и ухудшению ее микроархитектуры.
ГКС также ассоциируются с потерей мышечной массы и силы, в результате чего увеличивается частота падений. Комбинированные эффекты на кости и мышцы объясняют повышение риска переломов на фоне применения ГКС [16]. Необходимо отметить, что риск переломов при лечении ГКС повышается еще до того, как может быть зафиксировано снижение МПК [3].
Даже небольшие дозы ГКС увеличивают риск переломов, причем суточная доза в этом отношении важнее, чем кумулятивная [3]. Так, глюкокортикостероиды в дозе 2,5 мг/сут в пересчете на преднизолон связаны с повышенным риском переломов позвоночника, более 7,5 мг – с пятикратным риском переломов позвоночника и бедра [17, 18]. Прием преднизолона 10 мг/сут более 90 дней приводит к 17-кратному увеличению риска переломов позвонков и семикратному – переломов шейки бедра [19].
Хотя все пациенты подвержены риску потери костной ткани, вызванной приемом ГКС, у женщин в постменопаузе и пожилых мужчин он значительно выше, особенно при дозе более чем 20 мг/сут [20].
К дополнительным факторам, которые повышают риск ГКС-индуцированных переломов, относят низкую массу тела, курение, переломы у родителей, употребление более трех доз алкогольных напитков в день и проведение внутривенной пульс-терапии ГКС [21, 22].
После прекращения терапии ГКС риск переломов постепенно снижается до базового уровня в течение одного-двух лет [6, 18].
Как было отмечено ранее, риск переломов увеличивается до того, как будут обнаружены изменения МПК, поэтому денситометрия (Dual Energy X-ray Absorptiometry – DEXA) имеет ограниченную прогностическую ценность при данной патологии [3], так же как шкала оценки риска переломов (Fracture Risk Assessment Tool – FRAX). Последний инструмент может привести к недооценке риска ГКС-индуцированных переломов, поскольку учитывается средняя доза препарата, а не индивидуальные или кумулятивные дозы. Несмотря на эти ограничения, денситометрия и FRAX остаются основными методами диагностики глюкокортикостероидного ОП и мониторирования состояния костной ткани [8]. Измерение исходной МПК и/или анализ FRAX следует проводить до начала терапии ГКС. На исходном уровне и до принятия решения о предотвращении или лечении ГКС-индуцированной потери костной массы рекомендованы дополнительные исследования сывороточных уровней витамина D, кальция, биохимических показателей функции печени и почек [21, 23, 24].
ГКС-индуцированная потеря МПК может быть уменьшена с помощью минимизации дозы стероидов и назначения препаратов кальция и витамина D. Для лечения глюкокортикостероидного ОП, согласно национальным и международным рекомендациям, применяются бисфосфонаты или терипаратид [8, 21, 23–26].
В Российской Федерации для лечения глюкокортикостероидного ОП зарегистрированы антирезорбтивные и костноанаболические препараты. К первым относятся бисфосфонаты (алендронат, ризедронат и золедроновая кислота), ко вторым – терипаратид.
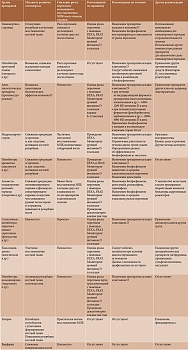
В настоящее время получены доказательства высокого уровня в отношении влияния бисфосфонатов и терипаратида на разные проявления глюкокортикостероидного ОП (табл. 3) [26].
Бисфосфонаты, пероральные или внутривенные, эффективны в предотвращении снижения МПК, вызванного использованием ГКС, поэтому входят в большинство рекомендаций по лечению [2, 23–26]. Тем не менее из-за особенностей патогенеза глюкокортикостероидного ОП возможность контроля патологии бисфосфонатами (подавляют резорбцию) может быть ограничена. В связи с этим особое внимание в последнее время направлено на антиостеопоротический препарат с анаболическим механизмом действия – терипаратид.
Терипаратид (Форстео®, регистрационное удостоверение П N015927/01, компания «Эли Лилли Восток С.А.») представляет собой рекомбинантный человеческий паратиреоидный гормон и является активным фрагментом эндогенного человеческого паратгормона (ПТГ). Физиологическое действие ПТГ заключается в стимуляции формирования костной ткани с помощью остеобластов. ПТГ опосредованно увеличивает кишечную абсорбцию и канальцевую реабсорбцию кальция, а также экскрецию фосфатов почками. Биологическое действие ПТГ реализуется за счет связывания со специфическими ПТГ-рецепторами на поверхности клеток. Терипаратид связывается с теми же рецепторами и оказывает такое же действие на кости и почки, как и ПТГ.
Введение терипаратида способствует образованию новой костной ткани на трабекулярной и кортикальной (периостальной и/или эндостальной) поверхностях костей с преимущественной стимуляцией активности остеобластов по отношению к активности остеокластов. На фоне лечения терипаратидом МПК увеличивается на 5–10% (в том числе в поясничном отделе позвоночника, шейке бедренной кости и бедренной кости). Минерализация происходит без признаков токсического воздействия на клетки костной ткани. Сформированная под влиянием терипаратида костная ткань имеет нормальное строение (без образования ретикулофиброзной ткани и фиброза костного мозга).
Применение терипаратида ассоциируется со снижением риска переломов, указанный эффект не зависит от возраста пациентов, исходного уровня костного метаболизма или величины МПК [27].
Комплексное влияние терипаратида на костную ткань обусловлено [28, 29]:
- повышением уровня инсулиноподобного фактора роста 1, что приводит к увеличению количества предшественников остеобластов и выживаемости остеобластов;
- активацией сигнального пути кальциевой киназы C, который стимулирует пролиферацию клеточной линии остеобластов;
- стимулированием сигнального пути Wnt, в результате чего повышается костеобразование;
- снижением синтеза склеростина, антагониста пути Wnt, что приводит к увеличению костеобразования;
- контролем репликации, дифференцировки и выживания предшественников остеобластов за счет влияния на экспрессию и высвобождение фактора роста фибробластов 2, интерлейкина 6, костного морфогенетического белка, трансформирующего фактора роста β;
- активацией покоящихся клеток костной ткани;
- снижением апоптоза остеобластов.
Как следствие, на фоне терипаратида увеличиваются объем трабекулярной кости и механическая прочность костей (в моделях на животных).
Эффективность и безопасность терипаратида были доказаны у пациентов с глюкокортикостероидным ОП [29].
Больным, принимающим ГКС перорально, антиостеопоротические препараты назначаются как с целью профилактики развития, так и с целью лечения остеопороза. У пациентов с высоким риском переломов такая терапия должна начинаться одновременно с назначением ГКС и быть длительной (три месяца и более) [30].
Необходимо отметить, что традиционно в качестве препаратов первой линии рассматриваются бисфосфонаты, терипаратид – только при невозможности их применения, особенно у женщин в пременопаузе, получающих ГКС более 7,5 мг/сут в пересчете на преднизолон [21, 25]. Однако получено достаточно доказательств превосходства терипаратида над бисфосфонатами у больных глюкокортикостероидным ОП. Так, в двойном слепом рандомизированном сравнительном контролируемом клиническом исследовании терипаратида 20 мкг/сут (подкожное введение) и алендроната 10 мг/сут (пероральный прием) у 428 пациентов с ОП, которые получали ГКС в дозе 5 мг/сут или более в течение как минимум трех месяцев [31], установлено, что через 18 месяцев МПК в поясничном отделе позвоночника значимо больше увеличилась у пациентов, получавших терипаратид, чем у пациентов, получавших алендронат, – 7,2 против 3,4% (p < 0,001). Наблюдалась также достоверная разница по частоте новых случаев переломов позвонков. Полученные данные свидетельствовали в пользу терипаратида – 0,6 против 6,1% (р = 0,004). Через 36 месяцев лечения в группе терипаратида зафиксировано увеличение МПК позвоночника и бедра, а также более низкая частота новых переломов позвонков по сравнению с группой алендроната – 1,7 против 7,7% (p = 0,007) [32, 33].
При сравнении эффективности терипаратида и ризедроната у мужчин, получавших ГКС перорально в течение трех месяцев, достоверное увеличение МПК в поясничном отделе позвоночника наблюдалось в группе терипаратида. Кроме того, терипаратид в большей степени улучшал прочность и жесткость костей [34].
Терипаратид продемонстрировал высокую эффективность не только при глюкокортикостероидном ОП. Согласно результатам рандомизированных клинических исследований по предотвращению переломов, у 1637 женщин при постменопаузальном ОП лечение терипаратидом по меньшей мере 18 месяцев ассоциировалось со значительным уменьшением риска переломов позвонков и внепозвоночных переломов. Так, на фоне такой терапии зафиксировано увеличение МПК позвоночника и бедра. Указанный эффект носил дозозависимый характер. Перелом позвонков отмечен у 4% пациентов группы терипаратида 20 мкг/сут, у 5% – группы терипаратида 40 мкг/сут и у 14% – группы плацебо. Таким образом, риск переломов снизился на 65 и 69% (по сравнению с плацебо). Внепозвоночные переломы имели место у 3% больных в группах терипаратида и у 6% – в группе плацебо. Их риск снизился на 53% в группе терипаратида 20 мкг/сут и на 54% в группе терипаратида 40 мкг/сут (по сравнению с плацебо) [35].
Полученные данные могут служить обоснованием использования терипаратида в качестве препарата первой линии у ряда пациентов, особенно при наличии высокого риска перелома позвонков [4].
Необходимо отметить, что анаболическая терапия ОП начинает занимать все большее место в клинической практике [36].
Так, согласно российскому консенсусу, терипаратид является препаратом первого выбора для лечения глюкокортикостероидного ОП у мужчин и женщин с высоким риском переломов (низкоэнергетические переломы в анамнезе или по FRAX). Терипаратид также может быть назначен при неэффективности предшествующей антиостеопоротической терапии (новые переломы, возникшие на фоне лечения, и/или продолжающееся снижение МПК), непереносимости других препаратов для лечения остеопороза или наличии противопоказаний для их назначения [30].
В Федеральных клинических рекомендациях по диагностике, лечению и профилактике остеопороза указано, что ввиду анаболического эффекта терипаратид следует использовать у пациентов с тяжелым остеопорозом, с уже имеющимися переломами тел позвонков в анамнезе, у лиц с крайне высоким риском низкотравматических переломов, с неэффективностью предшествующей терапии, а также непереносимостью альтернативного лечения. У пациентов с впервые диагностированным тяжелым остеопорозом лечение предпочтительно начинать с анаболических препаратов (терипаратида) с переходом в дальнейшем на антирезорбтивные препараты [37].
Еще один важный вопрос: возможно ли в случае тяжелого течения ОП комбинировать терипаратид с бисфосфонатами?
Результаты ряда исследований не продемонстрировали дополнительных преимуществ такой комбинации [38, 39]. Однако в одном из исследований однократное введение золедроновой кислоты с ежедневными инъекциями терипаратида способствовало достоверно более выраженному повышению МПК позвоночника и бедра по сравнению с монотерапией каждым из препаратов в отдельности [40]. Недавно опубликованный метаанализ десяти исследований с участием 1042 пациентов показал, что комбинированная терапия превосходит монотерапию в отношении увеличения МПК в поясничном отделе позвоночника и бедре, а также в отношении снижения риска переломов. В то же время ряд методических аспектов оценки качества данных свидетельствует о необходимости дальнейшего накопления информации для формулирования окончательных выводов [41].
В настоящее время изучается роль терипаратида в лечении пациентов с переломами. Установлено, что ПТГ усиливает заживление переломов [42–45]. Однако результаты немногочисленных рандомизированных клинических исследований противоречивы. Так, в рандомизированном контролируемом пилотном исследовании у 12 женщин в пременопаузе со стрессовыми переломами нижних конечностей терипаратид против плацебо в течение восьми недель продемонстрировал значительный анаболический эффект. Кроме того, терипаратид в отличие от плацебо ассоциировался с большей частотой случаев заживления переломов – 83,3 против 57,1%, однако разница не была статистически значимой [46]. Проспективное рандомизированное двойное слепое исследование с участием 102 женщин в постменопаузе, прошедших консервативное лечение по поводу дистальных переломов лучевой кости, показало, что введение терипаратида 20 мкг/сут по сравнению с применением плацебо сокращало срок заживления переломов – 7,4 и 9,1 недели соответственно. В то же время существенной разницы в отношении указанного показателя между терипаратидом в дозе 40 мкг/сут и плацебо не отмечено [47].
Таким образом, ГКС-индуцированный остеопороз представляет собой важную медицинскую проблему и требует специфических подходов к лечению.
На сегодняшний день имеется достаточно теоретических обоснований и клинических данных для того, чтобы рассматривать антиостеопоротический препарат анаболического действия терипаратид в качестве препарата первой линии при тяжелом глюкокортикостероидном ОП. У этой категории пациентов терипаратид превосходит по эффективности бисфосфонаты.
Предметом дальнейших исследований должна быть оценка возможности применения терипаратида в комбинации с бисфосфонатами, а также его способность заживлять состоявшиеся переломы.
D.E. Karateev, E.L. Luchikhina
Moscow Regional Research and Clinical Institute
Contact person: Dmitry Evgenyevich Karateev, dekar@inbox.ru
Glucocorticosteroid osteoporosis is the most common and severe form of secondary osteoporosis. It is an iatrogenic disease that develops as a result of receiving corticosteroids at various pathologies. The peculiarity of this osteoporosis is the predominance of bone resorption over bone formation. The increase in bone resorption is early and temporary. It was found that even small doses of glucocorticosteroids are associated with an increased risk of fractures.
Due to the peculiarities of the pathogenesis of glucocorticosteroid osteoporosis in recent years, more and more attention is drawn to the antiosteoporotic drug with an anabolic mechanism of action named teriparatide. The drug is a recombinant human parathyroid hormone. Teriparatide has the complex effect on bone tissue. Its advantages over biphosphonates (alendronate, risedronate) in this population were demonstrated in a number of studies. Therefore, teriparatide can be considered as a first-line drug in severe glucocorticosteroid osteoporosis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.