количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Гормональная коррекция диффузной дисгормональной дисплазии молочных желез
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, гематология и радиология." № 2 (37)
- Аннотация
- Статья
- Ссылки
- English
Мастопатия – самое распространенное доброкачественное заболевание молочных желез у женщин. Результаты гистологических исследований показывают, что рак молочной железы (РМЖ) сочетается с фиброзно-кистозной болезнью в 46% случаев. Учитывая отсутствие общепопуляционных методов первичной профилактики РМЖ, правильный подход к диагностике и лечению фиброзно-кистозной болезни имеет особое значение для снижения заболеваемости раком молочной железы. В статье представлены современные подходы к лекарственной терапии данного заболевания.
Мастопатия, или диффузная дисгормональная дисплазия, – самое распространенное доброкачественное заболевание молочных желез у женщин. Автором одного из первых классических определений заболевания является T. Velpean (1838). Для обозначения этого патологического процесса он использовал термин «хроническая индурация». Двумя годами позже R. Brodi предложил термин «серозно-кистозная опухоль» молочной железы. В 1892 г. C. Shimmelbuch ввел новый термин «кистозная аденомия» [1–7]. Современное определение мастопатии как дисгормональной дисплазии молочных желез было дано Всемирной организацией здравоохранения в 1984 г. Оно отражает многообразие изменений, происходящих в тканях молочной железы.
Интерес клиницистов к заболеванию обусловлен не только высокой распространенностью, но и возможными рисками, связанными с прогрессированием заболевания. Повышение пролиферативной активности, нарушение соотношения соединительнотканного и эпителиального компонентов могут инициировать развитие злокачественного заболевания – рака молочной железы [7–12]. Результаты гистологических исследований операционного материала показывают, что рак молочной железы (РМЖ) сочетается с фиброзно-кистозной болезнью (ФКБ) в 46% случаев. Учитывая отсутствие общепопуляционных методов первичной профилактики РМЖ, для снижения риска развития РМЖ чрезвычайно важной задачей является разработка эффективных методов лечения мастопатии.
Влияние половых гормонов на молочную железу
Молочная железа сохраняет высокую чувствительность к половым гормонам на всех этапах жизни женщины. Она практически никогда не находится в состоянии функционального покоя. Циклические изменения выработки половых гормонов в течение менструального цикла отражаются на состоянии молочных желез. Эстрогены влияют на рост железистого эпителия и развитие протоков. Прогестерон вызывает развитие железистой ткани, увеличение числа альвеол и долек молочных желез. Секреторные преобразования железистого компонента на фоне нарушенной продукции прогестерона обусловливают задержку жидкости и перерастяжение ткани молочных желез. Это приводит к возникновению болевого синдрома – масталгии [1, 3, 13–17].
Итак, нарушение соотношения эстрогенов и прогестерона – самая частая причина дисгормональных заболеваний молочных желез. Оно приводит к развитию относительной (позднее абсолютной) гиперэстрогении. В то же время причиной дисгормональных заболеваний молочных желез может стать изменение количества рецепторов половых гормонов и их сродства с эстрадиолом и прогестероном [4, 8, 18–20]. Генитальные и экстрагенитальные заболевания способствуют прогрессированию патологических процессов в железе [13, 18, 21].
Патологические изменения молочных желез как маркер гормональных нарушений
Среди органов репродуктивной системы, подверженных эстрогензависимым гиперпластическим процессам, молочные железы поражаются наиболее часто (60–95% случаев) [22, 23]. Это обусловлено особенностями их анатомо-физиологического строения: в структуре молочных желез преобладает железистый компонент [5, 10, 24, 25]. Следовательно, патологические изменения молочных желез можно рассматривать в качестве маркера гормональных нарушений в репродуктивной системе.
Так, у 45–52,3% больных гиперпролактинемией отмечается развитие гиперпластических процессов в молочных железах. Повышенный уровень пролактина в сыворотке крови свидетельствует о центральных, гипоталамо-гипофизарных нарушениях в репродуктивной системе. В то же время повышенный уровень пролактина способствует усилению выработки эстрогенов яичниками, что в свою очередь стимулирует пролиферативные процессы в периферических органах-мишенях. Отмечена также роль этого гормона в увеличении количества рецепторов эстрадиола в ткани молочной железы.
У пациенток с гипотиреозом, развившимся в детородном возрасте, нарушение менструальной функции происходит в 44–80% случаев. У трети пациенток с сохранным менструальным циклом тесты функциональной диагностики яичников показывают гормональную недостаточность – от недостаточности лютеиновой фазы до ановуляторного цикла [18, 19, 22].
Гормональная коррекция мастопатии
При выборе адекватной тактики лечения пациенток с мастопатией необходимо установить:
- узловой процесс или диффузный;
- причины, повлекшие развитие заболевания;
- вариант ФКБ [5, 7, 14, 19, 22, 26–28].
Учитывая, что мастопатия в большинстве случаев – это следствие гормональных расстройств, основной задачей консервативного лечения является нормализация гормонального статуса больных.
В терапии мастопатии чаще всего применяют гестагены. Механизм их действия основан на угнетении гипофизарно-яичниковых связей и снижении стимулирующего пролиферацию действия эстрогенов на ткань молочных желез. Эффективность гестагенов в терапии дисгормональной дисплазии молочных желез достигает 70%. Наиболее часто используют норэтистерон (препарат Примолют-Нор) в дозе 5 мг в сутки с 16-й по 25-й день менструального цикла, дидрогестерон (препарат Дюфастон) – 5–10 мг один раз в день в течение второй фазы цикла, прогестерон (препарат Утрожестан®) – 100 мг два-три раза в сутки с 17-го дня менструального цикла в течение 10–14 дней (курс лечения составляет три – шесть циклов).
В период менопаузы для лечения мастопатии необходимо титрование дозы гестагенов. Так, медроксипрогестерона ацетат принимают в дозе 10 мг в течение первых двух – четырех недель, в дозе 5 мг следующие две – четыре недели, а затем в дозе 5 мг два-три раза в неделю в течение нескольких месяцев.
В 2002 г. после публикации результатов исследования «Инициатива по охране женского здоровья» (Women’s Health Initiative – WHI) безопасность длительного назначения гестагенов, особенно в период менопаузы, была поставлена под сомнение. На фоне длительной заместительной гормональной терапии (ЗГТ), в состав которой помимо эстрогенов (конъюгированные конские эстрогены) входил медроксипрогестерона ацетат, отмечено повышение риска развития ишемической болезни сердца и РМЖ. Поэтому в июле 2002 г. схема ЗГТ в разных странах мира была изменена. При этом сократилось количество назначений пероральных препаратов.
Были внесены поправки и в международные клинические рекомендации по ЗГТ. В рекомендациях Международного общества по менопаузе (International Menopause Society – IMS) сказано, что препараты натурального прогестерона обладают специфическими положительными свойствами. В клинических руководствах таких международных обществ, как Североамериканское общество по менопаузе (North American Menopause Society – NAMS), Эндокринологическое общество (Endocrine Society) (2010), Европейское общество по менопаузе и андропаузе (European Menopause and Andropause Society – EMAS) и IMS (2011), отмечено, что риск развития РМЖ на фоне приема гестагенов зависит от типа прогестагена в составе ЗГТ.
Последние данные свидетельствуют о том, что натуральный микронизированный прогестерон отличается хорошим профилем безопасности. На фоне длительного (до пяти лет) применения препарата Утрожестан® не наблюдалось повышения риска развития РМЖ [29, 30].
Микронизированный прогестерон не оказывает негативного влияния на тонус сосудов. Его прием не влияет на показатели артериального давления. Согласно данным экспериментальных и клинических исследований, Утрожестан® может стать альтернативой синтетическим гестагенам, особенно у пациенток с высоким риском развития нежелательных явлений.
Чтобы минимизировать нежелательные системные действия микронизированного прогестерона, было предложено местное применение препарата.
Клинические исследования, проведенные P. Mauvis-Jarvts и соавт. [31], J. De Boevur и соавт. [32], показали: всасывание прогестерона при его трансдермальном применении составляет около 10%, что клинически значимо и позволяет обеспечить высокую концентрацию препарата в тканях молочной железы.
Примером такого препарата является Прожестожель® (применяется в России с 1999 г.). Прожестожель® содержит микронизированный прогестерон растительного происхождения. Строение молекулы, молекулярная масса и химический состав прогестерона в Прожестожеле идентичны таковым эндогенного прогестерона. В 100 г геля содержится 1 г прогестерона. Способ применения: 2,5 мг геля наносят на молочные железы ежедневно или с 16-го по 25-й день менструального цикла в течение трех месяцев [32–34].
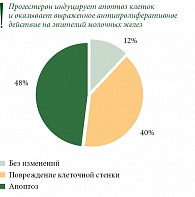
Поскольку большая часть прогестерона остается в тканях молочной железы, использование препарата не влияет на уровень прогестерона в сыворотке крови и не сопровождается увеличением риска развития побочных реакций, связанных с системным приемом прогестерона [33–36]. Действие препарата на клеточном уровне продемонстрированы на рисунке.
Эффективность препарата Прожестожель® доказана результатами многочисленных клинических исследований. Так, в исследовании C. Lafaye и соавт. после применения Прожестожеля (n = 500) у 75% пациенток при пальпации отмечено уменьшение плотности молочных желез и улучшение термографических показателей.
Исследование эффективности препарата проводилось и в России. В работе Р.А. Манушарова и соавт. (2011) клинический эффект был зарегистрирован у 82–97% пациенток с масталгией и 27% пациенток с мастопатией на фоне галактореи (n = 5500) [37].
В работе А.Л. Тихомирова показано, что терапия Прожестожелем оказывается эффективной в 73–78% случаев. Большинство пациенток отмечало улучшение состояния уже на первом месяце лечения. Согласно объективным данным, состояние больных улучшалось через три – пять месяцев проводимой терапии [35].
Прожестожель хорошо зарекомендовал себя при лечении масталгии и мастодинии у 318 пациенток, получавших заместительную терапию гормональными препаратами. Эффективность лечения через месяц терапии Прожестожелем составила 40%, через три месяца – 87% [36].
Исследование, проведенное Г.П. Корженковой (2001), показало наибольшую эффективность Прожестожеля в двух возрастных группах: 12–17 и 18–30 лет [35]. Это значимый результат, поскольку у таких пациенток при неэффективности базовой терапии лечение должно быть максимально щадящим.
В 2012 г. опубликованы результаты клинического исследования эффективности препарата в отношении клинических проявлений мастопатии, биометрических характеристик паренхимы и интенсивности кровообращения молочных желез. На фоне терапии показатели частоты и выраженности масталгии значительно снизились через три месяца. Наблюдалось улучшение биометрических показателей паренхимы и повышение интенсивности кровообращения в молочных железах [38].
Анализ работ показывает, что для достижения стойкого клинического эффекта препарат следует назначать не менее чем на три месяца.
С 1980 г. при дисгормональных заболеваниях молочных желез начали применять аналоги гонадотропин-рилизинг-гормонов (ГнРГ).
При применении ГнРГ развивается блокада гонадотропной функции гипофиза, подавление секреции лютеинизирующего и фолликулостимулирующего гормонов приводит к угнетению циклической активности яичников. Такая терапия вполне оправданна у больных с дисгормональными заболеваниями молочных желез в предменструальные дни, поскольку в это время наблюдается избыток эстрогенов и прогестерона [9, 24, 25, 37].
Применение бусерелина ацетата в дозе 100 мг в сутки приводит к значительному снижению раздражительности и выраженности масталгии перед менструацией, улучшает течение дисгормональных заболеваний молочных желез у 75% больных с фибромиомой матки и 80% больных эндометриозом.
Агонисты гонадотропинов у пациенток в пременопаузальном периоде целесообразно применять при наличии симптомов мастопатии и гиперпластических процессов в эндометрии.
При сохранном репродуктивном статусе эта группа препаратов является препаратами второй линии. Они назначаются, если другие виды терапии неэффективны и лечение будет непродолжительным.
Исследование Л.В. Адамян (1998), в котором участвовали пациентки с мастопатией и эндометриозом, клиническая стабилизация мастопатии наблюдалась у 47% пациенток, применявших аналоги ГнРГ для лечения эндометриоза [31]. Похожие результаты были получены и в работе М.С. Габуния и соавт. (2007).
Также при дисгормональной дисплазии молочных желез применяется ингибитор продукции гонадотропных гормонов даназол. Терапию начинают с нагрузочной дозы 200–300 мг в сутки. Через два месяца дозу снижают до 100 мг в сутки, а еще через два месяца препарат применяют с 14-го по 18-й день менструального цикла в дозе 100 мг. Продолжительность терапии – шесть месяцев.
Синтетический стероидный гормон гестринон (препарат Неместран), обладающий антипрогестагенными свойствами с некоторой андрогенной и антиэстрогенной активностью, и аналоги ГнРГ (гозерелин (препарат Золадекс), бусерелин) показали эффективность при различных дисгормональных заболеваниях молочных желез в сочетании с полипозом эндометрия и простой гиперплазией. У 14 пациенток с умеренно выраженной диффузной ФКБ наступило полное выздоровление, а у 13 больных с выраженной ФКБ наблюдалась положительная динамика или длительная ремиссия процесса. Такие же результаты получены при лечении бусерелином пациенток с кистозной болезнью и/или простыми небольшими кистами молочных желез. Исчезновение болевого синдрома, а также улучшение структуры молочных желез у большинства пациенток были отмечены через три месяца терапии [2].
Первые публикации, посвященные использованию антиэстрогенных препаратов для лечения фиброзно-кистозной мастопатии, появились в конце 70-х гг. прошлого века. Механизм действия препаратов этой группы обеспечивает конкурентное связывание с рецепторами эстрогенов в органах-мишенях и препятствует образованию эстроген-рецепторного комплекса с эндогенным лигандом 17-бета-эстрадиолом. В отличие от рецепторного комплекса эстрогена рецепторный комплекс антиэстрогена угнетает деление клетки [28, 39].
В работе М.С. Габуния и соавт. (2007) тамоксифен применялся у пациенток с выраженной гиперплазией железистого компонента молочных желез. Эффективность лечения составила 88,9%: уменьшились объем и плотность гиперплазированных железистых элементов. При этом непродолжительный (три – шесть месяцев) прием тамоксифена не вызвал рецидива гиперплазии эндометрия после проведенной аблации эндометрия [2, 40].
Использование тамоксифена в дозе 20 мг во время второй фазы цикла у пациенток репродуктивного возраста или 30–60 дней у больных в период менопаузы способствовало уменьшению масталгии в 97% случаев [40].
В.П. Летягин (2007), используя тамоксифен в дозе 10 мг в течение трех месяцев у десяти пациенток с рецидивирующими кистами молочных желез, рефрактерными к базовой терапии, получил полную редукцию кистозных изменений у семи больных. У трех пациенток размер образований уменьшился в два раза [41].
Работа С.В. Пушкарева и соавт. (2003) показала, что в 75% случаев удается достичь положительных результатов у пациенток в период пременопаузы с диффузной формой ФКБ, проявляющейся в виде масталгии, при ежедневном использовании тамоксифена в дозе 10 мг в сутки в течение двух-трех месяцев [42].
Результаты сравнительного исследования О.И. Балашовой (2006) терапии препаратом антиэстрогенного действия торемифен (Фарестон) в дозе 20 мг в сутки и фитотерапии у пациенток с пролиферативной фиброзно-кистозной мастопатией и фиброзирующим аденозом продемонстрировали, что субьективная и обьективная эффективность была достоверно выше в группе антиэстрогенного средства (79 против 50% по субъективной и 85 против 56% по объективной оценке). При этом динамика гормонального статуса не была отмечена ни в одной группе [35].
В США применение гормональных контрацептивов ежегодно предупреждает госпитализацию 20 000 пациенток с мастопатией. Эффективность препаратов по разным данным колеблется от 33,3 до 90%. Так, при длительном использовании оральных контрацептивов частота масталгии снижается до 50% [43–49].
Прием монофазных оральных контрацептивов хотя бы в течение года снижает риск развития мастопатии на 50–75%.
Основные требования, предъявляемые к этим препаратам, – низкая доза эстрогена (не более 0,035 мг этинилэстрадиола), высокая селективность гестагенов и наличие дополнительных профилактических эффектов. Не рекомендуется прием оральных контрацептивов пациенткам с мутацией генов BRСA1 или BRСA2.
Основные лечебные эффекты – антиэстрогенный, антиандрогенный, прогестагенный – связаны с подавлением работы гипоталамо-гипофизарно-яичниковой системы.
Иногда в первые месяцы приема препаратов симптомы масталгии и мастодинии могут усилиться. Если терапию продолжить, симптомы купируются самостоятельно.
При появлении симптомов галактореи на фоне применения комбинированных оральных контрацептивов после дополнительного обследования (определение уровня пролактина, хорионического гонадотропина, проведение ультразвукового и цитологического исследования) целесообразно включение в терапию Мастодинона или Циклодинона.
Ингибиторы секреции пролактина. В эту группу входят такие хорошо известные препараты, как бромокриптин (Парлодел) и каберголин (Достинекс). Механизм их действия заключается в подавлении секреции пролактина посредством стимуляции рецепторов дофамина, при этом не оказывается влияния на нормальные уровни других гипофизарных гормонов. Показаниями к применению являются масталгия и галакторея на фоне гиперпролактинемии (включая супрафизиологическую) [14, 15, 35, 37, 39, 50].
В заключение хочется отметить, что молочная железа является неотъемлемой частью репродуктивной системы женщины. Для выбора алгоритма лечения заболеваний молочных желез необходимы комплексное обследование пациенток с участием врачей разных специальностей и персонализированный подход в каждом клиническом случае.
Представленный выше обзор современных способов коррекции дисгормональных состояний репродуктивной системы в целом и тканей молочных желез в частности расширяет возможности выбора лечения заболеваний молочных желез.
1. Бурдина Л.М. Дисгормональные гиперплазии молочных желез – особенности развития, дифференциальная диагностика // Радиология – практика. 2007. № 3. С. 44–61.
2. Габуния М.С., Братин А.В., Олимпиева С.П. Факторы риска развития доброкачественных заболеваний молочной железы на фоне гинекологических заболеваний // Маммология. 1988. № 2. С. 21–26.
3. Зубкин В.И. Патогенез, диагностика, комплексное лечение и профилактика рецидивов доброкачественных дисплазий молочных желез: дис. … докт. мед. наук. М., 2004.
4. Ильин А.Б., Цвелев Ю.В., Абашин В.Г. Диагностика и лечение доброкачественных заболеваний молочных желез у женщин. Методические рекомендации. СПб.: Сфера, 2005.
5. Кац И.П., Павлова Е.А., Ордиянц И.М. Роль генетических факторов и иммунных нарушений в развитии доброкачественных заболеваний молочных желез // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презенс, 2012. С. 27–31.
6. Панов В.О., Волобуев А.И., Озерова О.Е. и др. Рентгено-, УЗ- и МР-маммография в диагностике и при динамическом контроле консервативного лечения диффузных форм фиброзно-кистозной болезни, сопровождающихся масталгией. Научно-организационные аспекты и современные лечебно-диагностические технологии в маммологии // Материалы II Всеросийской научно-практической конференции с международным участием. М., 2003. С. 104–105.
7. Breast cancer. A practical guide / O.E. Silva, S. Zurrida. 2005.
8. Ермилова В.Д. Морфологическая характеристика опухолей и опухолеподобных процессов молочной железы // Диагностика рака молочной железы / под ред. В.А. Хайленко, Д.В. Комова, В.Н. Богатырева. М.: МИА, 2005. С. 150–139.
9. Манухин И.Б., Высоцкий М.М., Харлова О.Г. Доброкачественные заболевания молочных желез // Избранные лекции по гинекологии / под ред. И.Б. Манухина. М.: Династия. 2003. С. 71–80.
10. Серов В.Н., Тагиева Т.Т. Доброкачественные заболевания молочных желез // Гинекологическая эндокринология. М., МЕДпресс. 2006. С. 335–432.
11. Хасанов Р.Ш., Гилязутдинов И.А. Мастопатия. Руководство для врачей. Казань: Новое знание. 2006.
12. Birdwell R.L. Молочная железа. 100 основных диагнозов. Карманный справочник рентгенолога / R.L. Birdwell, E.A. Morris, S. Wang, B.T. Parkinson / пер. В.В. Китаева, В.В. Уварова. М.: ИНТЕЛМЕД-ТЕХНИКА, 2008.
13. Иванова Т.Н. Нарушения репродуктивного здоровья женщин с доброкачественными заболеваниями молочных желез: автореф. дис. ... канд. мед. наук. М., 2001.
14. Мустафин Ч.К. Актуальные аспекты лечения диффузных мастопатий // Лечащий врач. 2008. № 10. С. 18–24.
15. Мустафин Ч.К. Вопросы диагностики и лечения диффузной мастопатии. Доктор.Ру. 2005. № 5–6.
16. Овсянникова Т.В. Дисгормональная патология молочных желез – взгляд гинеколога // Доброкачественные заболевания молочных желез. М.: Адамант Ъ. 2006.
17. Прилепская В.Н., Волобуев А.И., Швецова О.Б. Масталгия у женщин репродуктивного возраста: клиника, диагностика, лечение // Гинекология. 2003. Т. 5. № 4. С. 161–165.
18. Радзинский В.Е., Ордиянц И.М. Комплексный подход к диагностике и лечению гинекологических и маммологических заболеваний и нарушений // Маммология. 2005. № 1. С. 12–17.
19. Сидоренко Л.Н. Гормонотерапия предрака и рака молочной железы. СПб.: Медицина. 1996.
20. Fentiman I.S. The pathophysiology and therapy of benign breast disease // Reproductive Medicine: molecular, cellular and genetic fundamentals. 97. Fauser B.C.J.M. 2003. P. 487–494.
21. Аракелов С.Э., Масленникова М.Н., Павлова Е.А. и др. Дифференциальный подход к лечению женщин, страдающих болезнями молочных желез в сочетании с миомой матки // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презенс, 2012. С. 5.
22. Коновалова В.Н. Дискуссионные вопросы тактики ведения женщин с доброкачественными заболеваниями молочных желез // Эффективная фармакотерапия в акушерстве и гинекологии. 2009. № 6. С. 6–12.
23. Кравчук Л.А., Буртушкина Н.К., Холодова Л.В. Состояние молочных желез у женщин с климактерическим синдромом // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презенс, 2012. С. 36–37.
24. Мустафин Ч.К. Дисгормональные болезни молочной железы // Лечащий врач. 2009. № 11. С. 7–10.
25. Свистунова М.Н. Дифференцированный подход к лечению доброкачественных заболеваний молочных желез у гинекологических больных // Материалы VI Российского форума «Мать и дитя». М., 2004. С. 473–474.
26. Голубятникова Е.В., Драничникова О.С., Оккель Ю.В. Особенности состояния общего адаптационного синдрома при диффузной доброкачественной дисплазии молочных желез // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презенс, 2012. С. 13–14.
27. Даниленко Е.Г., Дубенко О.Д., Дубчак А.Е. Коррекция психоэмоционального состояния у женщин с бесплодием и дисгормональными заболеваниями молочных желез // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презен, 2012. С. 18–20.
28. Сердюков И.Е. Опыт лечения мастопатии у женщин в менопаузе // Онкология. 2008. Т. 10. № 4.
29. Cordina-Duverger E., Truong T., Anger A. et al. Risk of breast cancer by type of menopausal hormone therapy: a case-control study among post-menopausal women in France // PLoS One. 2013. Vol. 8. № 11.
30. Fournier A., Berrino F., Riboli E. et al. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort // Int. J. Cancer. 2005. Vol. 114. № 3. P. 448–454.
31. Адамян Л.В., Кулаков В.И. Эндометриозы. Руководство для врачей. М.: Медицина, 1998.
32. Агафонов А.В., Апетов С.С. Фиброзно-кистозная болезнь и методы ее коррекции с применением трансдермального геля с тестостероном // Материалы II Междисциплинарного форума «Медицина молочной железы». М.: Медиабюро Статус презенс, 2012. С. 2–4.
33. Тагиева Т.Т. Доброкачественные заболевания молочных желез у женщин позднего репродуктивного возраста: возможности трансдермальной гестагенной терапии // Гинекология. 2005. Т. 7. № 4. С. 196–199.
34. Швецова О.Б. Возможности применения Прожестожеля у больных с масталгией // Гинекология. 2000. № 5.
35. Высоцкая И.В. Современные возможности терапии фиброзно-кистозной болезни // Опухоли женской репродуктивной системы. 2009. № 1–2. С. 44–46.
36. Звычайный М.А., Воронцова А.В., Ханафиев Г.Х. и др. Перспективы использования Прожестожеля для повышения приемлемости заместительной гормональной терапии у женщин с дефицитом половых стероидов // Российский вестник акушерства и гинекологии. 2004. № 2. С. 58–61.
37. Манушарова Р.А., Черкезова Э.И. Фиброзно-кистозная мастопатия: клиника, диагностика и лечение // Лечащий врач. 2010. № 4.
38. Коган И.Ю., Мусина Е.В. Местное применение микронизированного прогестерона у больных репродуктивного возраста с мастопатией // Акушерство и гинекология. 2012. № 2. С. 102–106.
39. Сутурина Л.В., Попова П.Н. Влияние бромкриптина и циклодинона на клинические симптомы и уровень пролактина у женщин с гиперпролактинемией репродуктивного возраста // Вопросы гинекололии, акушерства и перинатологии. 2010. Т. 9. № 2. С. 41–49.
40. Горин В.С., Емельянова О.В., Резниченко Е.В., Портнова А.В. Принципы лечения мастопатии // Сибирский медицинский журнал (г. Иркутск). 2008. Т. 83. № 8. С. 9–14.
41. Летягин В.П. Лечение дисгормональных дисплазий молочных желез // Опухоли женской репродуктивной системы. 2008. № 3. С. 23–25.
42. Пушкарев С.В., Скуридина И.В., Ткачук О.А. Рак молочной железы. Новосибирск: Сибмедиздат, 2003.
43. Климачева Т.Б., Чурилова Л.А. Диффузная мастопатия и гормональная контрацепция // Материалы научно-практической конференции. Барнаул, 1996. С. 23–25.
44. Малыхина Т.В. Проблемы контрацепции и рак молочной железы. Научно-организационные аспекты и современные лечебно-диагностические технологии в маммологии // Материалы II Всероссийской научно-практической конеренции с международным участием. М., 2003.
45. Чигин А.А. Контрацепция при диффузных доброкачественных заболеваниях молочных желез // Маммология. 1997. № 1. С. 3–8.
46. Anderson F.D., Heit H. A multicenter, randomized study of an extended cycle oral contraceptive // Contraception. 2003. Vol. 68. № 2. P. 89–96.
47. Leonardi M. Hormonal contraception and benign breast disease. Evaluation of a treatment protocol for chronic mastopathy with mastalgia // Minerva Ginecol. 1997. Vol. 49. № 6. P. 271–276.
48. Olawaiye A., Withiam-Leitch M., Danakas G., Kahn K. Mastalgia: a review of management // J. Reprod. Med. 2005. Vol. 50. № 12. P. 933–939.
49. Sillem M., Schneidereit R., Heithecker R., Mueck A.O. Use of an oral contraceptive containing drospirenone in an extended regimen // Eur. J. Contracept. Reprod. Health Care. 2003. Vol. 8. № 3. P. 162–169.
50. Балтия Д., Сребрый А. Консервативное лечение фиброзно-кистозной болезни молочной железы (мастопатии). www.mastopatia.ru/profi.html.
Hormone treatment of diffuse dyshormonal mammary dysplasia
I.V. Vysotskaya1, V.P. Letyagin2, N.V. Lyovkina2
1 I.M. Sechenov First Moscow state medical university
2 N.N. Blokhin Russian cancer research center
Contact person: Irina Viktorovna Vysotskaya, vysotskaya.irina@mail.ru
Mastopathy is the most common benign breast disease in women. Pathological studies demonstrated association of breast cancer and fibrocystic breast disease in 46% of cases. Given effective methods of primary prevention of breast cancer in the general population are still under development, proper diagnosis and treatment of fibrocystic breast disease may be of particular importance for the prevention of breast cancer. The article addresses current approaches to medical treatment of dyshormonal mammary dysplasia.
Новости на тему
15.09.2023 07:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.