Рецептор эпидермального фактора роста HER2 (human epidermal growth factor receptor 2) является одним из четырех трансмембранных тирозинкиназных рецепторов семейства рецептора эпидермального фактора роста (EGFR – epidermal growth factor receptor), в которое входят также HER1 (ErbB1 или EGFR), HER3 (ErbB3) и HER4 (ErbB4). Все представители семейства EGFR (HER1, HER2, HER3, HER4) играют важную роль в нормальном развитии и дифференцировке клеток, поддерживая пролиферацию и препятствуя апоптозу. Однако чрезмерная активность этих рецепторов способна приводить к утрате контроля над процессами деления клеток, что, как известно, лежит в основе патогенетических механизмов опухолевого роста. Гиперэкспрессия рецепторов семейства EGFR обнаруживается при многих злокачественных новообразованиях эпителиального происхождения, включая рак головы и шеи, толстой кишки, легкого, молочной железы, яичников, простаты, почек, поджелудочной железы, мочевого пузыря, и в большинстве случаев ассоциируется с неблагоприятным прогнозом.
Все представители семейства EGFR имеют сходную структуру и состоят из внеклеточного лиганд-связывающего, трансмембранного и внутриклеточного доменов. Активация последнего считается инициальным событием сигнальной трансдукции, приводящей в конечном итоге к усилению пролиферации и угнетению апоптоза. Для активации рецепторов необходимо их взаимодействие с соответствующими лигандами. Известны по крайней мере шесть лигандов, образующих семейство эпидермального фактора роста: EGF (epidermal growth factor), TGF-альфа (transforming growth factor), амфирегулин, гепарин-связывающий EGF, бетацеллюлин и эпирегулин. Примечательно, что опухоли, характеризующиеся гиперэкспрессией тирозинкиназных рецепторов, как правило, продуцируют и соответствующие лиганды.
При раке молочной железы (РМЖ) наиболее хорошо изучен HER2, наличие которого ассоциируется с неблагоприятным прогнозом и служит показанием к назначению специфической терапии, направленной на его блокаду [1]. По данным разных авторов, от 10 до 34% случаев инвазивного РМЖ характеризуются положительным статусом HER2. Датой появления анти-HER2-терапии, видимо, следует считать 1984 г., когда был идентифицирован ген HER2, продуктом которого и является рецептор, носящий аналогичное название. Ген HER2 представляет собой протоонкоген и у человека располагается в длинном плече 17-й хромосомы (17q12) [2]. Сигнальные пути, активируемые HER2, включают MAPK (mitogen-activated protein kinase), PI3K/Akt (phosphoinositide 3-kinase), PLC-гамма (phospholipase C-гамма), PKC (protein kinase C) и STAT (signal transducer and activator of transcription) [3]. Интересно, что HER2 не имеет идентифицированного лиганда и является излюбленным партнером для взаимодействия с другими членами семейства HER. Гетеродимеры с участием HER2, особенно HER2-HER3, отличаются большей стабильностью и потенциалом влияния на сигнальные пути.
Назначение анти-HER2-препаратов показано только при гиперэкспрессии HER2 (3+) по данным иммуногистохимического исследования (ИГХ) и (или) амплификации гена HER2, выявленной с помощью реакции гибридизации in situ. В повседневной практике определение HER2-статуса считается частью рутинного морфологического исследования опухоли. ИГХ-анализ – наиболее часто выполняемое первичное исследование, на основании которого оценивают экспрессию рецепторного белка на мембране опухолевой клетки. При сомнительном результате ИГХ-анализа (2+) HER2-статус должен быть уточнен с помощью реакции FISH (fluorescent in situ hybridization), которая позволяет определить количество копий гена HER2. При аккуратном выполнении ИГХ-реакции и грамотной трактовке ее результатов данные хорошо коррелируют с результатами FISH. Алгоритм изучения HER2-статуса представлен в рекомендациях, разработанных ASCO (American Society of Clinical Oncology – Американское общество клинической онкологии) и CAP (College of American Pathologists – Американская коллегия патологов) [4].
В настоящее время при РМЖ используются несколько препаратов с анти-HER2-активностью:
- трастузумаб (моноклональное антитело, связывающееся с экстрацеллюлярным доменом HER2; точный механизм действия до конца не ясен);
- лапатиниб (малая молекула, обратимо блокирует внутриклеточную тирозинкиназную активность HER2 и EGFR (HER1), подавляя MAPK и PI3K/Akt сигнальные пути);
- пертузумаб (гуманизированное моноклональное антитело, связывается с экстрацеллюлярным доменом HER2, препятствуя его димеризации с EGFR и HER3);
- трастузумаб эмтанзин (T-DM1; представляет собой конъюгат антитела трастузумаба и цитотоксического антимикротрубочкового агента DM1; после интернализации препарата HER2-положительной опухолевой клеткой происходит высвобождение DM1 в цитоплазму и воздействие на микротрубочковый аппарат клетки, приводящее к ее гибели).
Адъювантная анти-HER2-терапия
Сегодня единственным препаратом, разрешенным к применению в качестве адъювантной терапии, является трастузумаб. Его эффективность изучена в ряде крупных международных рандомизированных исследований. Результаты шести исследований с участием в общей сложности свыше 13 000 больных доступны для анализа и убедительно доказывают положительное влияние трастузумаба на показатели безрецидивной и общей выживаемости больных HER2-положительным РМЖ (табл. 1) [5–10]. Метаанализ, опубликованный в 2012 г. и включавший результаты лечения 11 991 пациента, также показал, что терапия трастузумабом увеличивает безрецидивную (относительный риск (ОР) 0,60; 95% доверительный интервал (ДИ) 0,50–0,71) и общую выживаемость (ОР 0,66; 95% ДИ 0,57–0,77) у больных HER2-положительным РМЖ (табл. 1) [11].
Особое значение при лечении трастузумабом имеет временной параметр его назначения – последовательно или одновременно с химиотерапией. В ходе исследований NSABP B-31, BCIRG 006 и FinHER одновременно назначали трастузумаб и химиотерапию, а в исследованиях HERA и PACS-04 трастузумаб назначали последовательно, то есть по окончании адъювантной химиотерапии. И только одно исследование N9831 было посвящено непосредственно изучению данного вопроса. Результаты второго планового анализа (медиана времени наблюдения – шесть лет) показали, что последовательное назначение трастузумаба увеличивало показатели безрецидивной выживаемости в меньшей степени, чем совместное назначение трастузумаба и химиотерапии [7]. Данные метаанализа подтвердили, что статистически значимое преимущество показателей общей выживаемости наблюдается только при одновременном назначении трастузумаба и химиотерапии (ОР 0,64; 95% ДИ 0,53–0,76) (для сравнения: при последовательном назначении ОР 0,85; 95% ДИ 0,43–1,67) [11].
Дискутабельным остается вопрос об оптимальной длительности введения трастузумаба с адъювантной целью. Результаты метаанализа и двух исследований, озвученные на конгрессе ESMO в 2012 г., подтверждают целесообразность назначения препарата в течение одного года. В частности, данные исследования HERA, посвященного сравнению эффективности одно- и двухгодичного лечения трастузумабом, продемонстрировали, что дополнительный год введения трастузумаба (в общей сложности два года) не привел к увеличению восьмилетней безрецидивной (76,0 и 75,8%; ОР 0,99; p = 0,86) и общей выживаемости (87,6 и 86,4%; p = 0,63) по сравнению с одногодичным. Эта закономерность справедлива как для гормонозависимых, так и для гормононезависимых опухолей [5]. Данный вопрос изучали также в исследовании PHARE. 3383 больных HER2-положительным РМЖ были рандомизированы на две группы: в первой трастузумаб применяли шесть месяцев, во второй – один год. При медиане времени наблюдения 3,5 года полученные результаты не подтвердили статистическую гипотезу о том, что шестимесячный срок введения трастузумаба не менее эффективен, чем одногодичный. Формально двухлетняя безрецидивная выживаемость была сопоставимой: 93,8% (95% ДИ 92,6–94,9) во второй группе и 91,1% (89,7–92,4) – в первой. Однако допустимое согласно дизайну исследования пограничное значение ОР 1,15, соответствовавшее критерию не меньшей эффективности, находилось в пределах ДИ (ОР 1,28; 95% ДИ 1,05–1,56; p = 0,29). В группе более длительного введения трастузумаба было зафиксировано значительно больше случаев кардиотоксичности: 5,7 против 1,9% (p < 0,0001) [12]. Данные метаанализа также показали, что введение трастузумаба в течение года улучшает показатели общей выживаемости статистически значимо (ОР 0,67; 95% ДИ 0,57–0,80). В то же время при меньшей продолжительности (≤ 6 месяцев) имеется лишь тенденция к улучшению отдаленных результатов лечения без статистической значимости различий (ОР 0,55; 95% ДИ 0,27–1,11) [11].
Таким образом, в настоящее время стандартным для адъювантной терапии признано назначение трастузумаба в течение одного года, хотя изучение данного вопроса продолжается (исследования PERSEPHONE, HELLENIC, SHORT-HER, SOLD). К сожалению, маркеры, позволяющие выделить подгруппу больных, нуждающихся в более длительном назначении трастузумаба с адъювантной целью, отсутствуют.
В соответствующих клинических исследованиях, посвященных адъювантной терапии, изучаются другие анти-HER2-препараты: лапатиниб (ALTTO, TEACH), нератиниб (ExteNET), пертузумаб (APHINITY), T-DM1 (TDM4874g).
Неоадъювантная (предоперационная) анти-HER2-терапия
В последние годы особый интерес вызывает лекарственная терапия на дооперационном этапе (так называемая неоадъювантная, или предоперационная, терапия). В целом этот подход обеспечивает такой же выигрыш в выживаемости, как и адъювантная лекарственная терапия. Наряду с этим неоадъювантная лекарственная терапия в большинстве случаев позволяет превратить первично неоперабельную опухоль в операбельную, выполнить органосохраняющую операцию, когда исходно большой размер опухоли препятствует этому, а также изучить терапевтический эффект различных противоопухолевых препаратов, то есть оценить лекарственный патоморфоз. Последнее обстоятельство важно как с практической, так и с научной точки зрения.
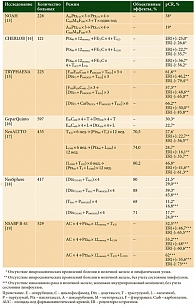
Как известно, при HER2-положительном и тройном негативном РМЖ достижение полного лекарственного патоморфоза (рСR) ассоциируется с улучшением прогноза по сравнению со случаями резидуальной опухоли. Основные итоги наиболее значимых исследований, посвященных неоадъювантной лекарственной терапии HER2-положительного РМЖ, представлены в табл. 2. Результаты исследований убедительно показывают, что добавление к химиотерапии анти-HER2-препаратов существенно повышает частоту pCR [13–19]. В частности, в исследовании NOAH назначение трастузумаба в дополнение к химиотерапии позволило вдвое увеличить частоту pCR в молочной железе и подмышечных лимфоузлах – 19 против 38% (р = 0,001), а также значительно улучшить отдаленные результаты лечения (табл. 3) [13, 20].
Сравнение трастузумаба и лапатиниба (в сочетании с химиотерапией) в исследованиях GeparQuinto и NeoALTTO показало более высокую активность трастузумаба [16, 17]. В исследовании GeparQuinto частота pCR составила 30,3 против 22,7% (ОР 0,68; 95% ДИ 0,47–0,97; p = 0,04). С учетом данных о меньшей эффективности лапатиниба его не рекомендуется использовать в неоадъювантной терапии в качестве единственного анти-HER2-препарата вне рамок клинических исследований.
В настоящее время показано, что одновременное использование двух анти-HER2-препаратов (так называемая двойная анти-HER2-блокада) эффективнее применения каждого в отдельности (CHER-LOB, NeoALTTO, NeoSphere, NSABP B-41) [14, 17–19].
Интересные и важные с практической точки зрения результаты получены в исследовании фазы II NeoSphere, посвященном изучению эффективности нового анти-HER2-препарата пертузумаба и сравнению четырех вариантов лечения:
1) трастузумаб + пертузумаб + доцетаксел;
2) трастузумаб + пертузумаб;
3) пертузумаб + доцетаксел;
4) трастузумаб + доцетаксел.
Частота pCR была максимальной в группе двойной анти-HER2-блокады (трастузумаб + пертузумаб) в сочетании с доцетакселом (р = 0,014) [18]. Эти данные совместно с результатами исследований при метастатическом РМЖ стали теоретическим обоснованием изучения двойных анти-HER2-комбинаций в адъювантной терапии (APHINITY, ALTTO), а режим «трастузумаб + пертузумаб + доцетаксел» был разрешен к применению, в том числе в качестве неоадъювантной терапии.
Несмотря на успехи в лечении HER2-положительного РМЖ, произошедшие за последние годы, на многие вопросы пока нет ответов. Например, каковы оптимальные анти-HER2-препараты для двойной блокады HER2? Каков оптимальный химиотерапевтический режим для совместного использования с двойной блокадой HER2? Возможен ли отказ от химиотерапии у отдельных больных, получающих двойную HER2-блокаду? Какова роль двойной блокады в сочетании с гормонотерапией? Когда лучше использовать анти-HER2-терапию – до или после операции (при первично операбельном РМЖ)? Можно ли идентифицировать маркеры, предсказывающие эффект каждого из анти-HER2-препаратов, а также их комбинаций?
Метаанализ GBG (German Breast Group – Немецкая группа по изучению заболеваний молочной железы) и AGO Breast Group, включавший индивидуальные данные 6402 больных, получавших в различных клинических исследованиях доксорубицин/эпирубицин и паклитаксел/доцетаксел в сочетании с трастузумабом или без него, позволил выделить маркеры, предсказывающие высокую вероятность полного морфологического эффекта:
- ER-отрицательный статус (ОР 3,2; 95% ДИ 2,7–3,8; p < 0,0001);
- HER2-положительный статус (ОР 2,2; 95% ДИ 1,8–2,5; p < 0,0001);
- высокая степень злокачественности (ОР 1,8; 95% ДИ 1,5–2,2; p < 0,0001);
- молодой возраст (ОР 1,3; 95% ДИ 1,2–1,6; p < 0,0001);
- нелобулярный гистологический вариант (ОР 1,7; 95% ДИ 1,2–2,3; p < 0,001);
- небольшой размер опухоли (ОР 1,5; 95% ДИ 1,2–1,9; p < 0,0006) [21].
Анти-HER2-терапия при метастатическом РМЖ
В настоящее время анти-HER2-терапия признана стандартным подходом к лечению метастатического HER2-положительного РМЖ и обычно дополняет химио- или гормонотерапию. Блокаду HER2 сигнального пути рекомендуется начинать как можно раньше и продолжать как можно дольше у всех больных с доказанным HER2-положительным статусом, за исключением тех случаев, когда имеются абсолютные противопоказания к назначению препаратов данной группы.
Жизнь любого препарата в онкологии начинается с изучения его эффективности и токсичности при метастатической болезни. Только наиболее эффективные лекарства с хорошей переносимостью продолжают изучать в адъювантной терапии. Так было и с анти-HER2-препаратами.
Трастузумаб
Первый анти-HER2-препарат трастузумаб сначала был разрешен к применению в первой линии терапии метастатического РМЖ в 1998 г. Этому решению предшествовала тщательная оценка препарата в соответствующих клинических исследованиях. В 2001 г. в исследовании фазы III D.J. Slamon и соавт. показали, что добавление трастузумаба к химиотерапии (антрациклинами и таксанами) увеличивает на пять месяцев медиану продолжительности жизни (25,1 против 20,3 месяца; р = 0,046), снижая на 20% риск смерти, медиану времени до прогрессирования (7,4 против 4,6 месяца; р < 0,001), частоту объективных эффектов (50 против 32%; р < 0,001) и медиану их продолжительности (9,1 против 6,1 месяца; р < 0,001) [22]. Противоопухолевая активность трастузумаба в монотерапии при HER2-положительном РМЖ невелика: частота объективных эффектов не превышает 19–26% в первой линии и 15% – во второй и последующих [23]. Результаты рандомизированных исследований свидетельствуют о пользе добавления трастузумаба практически ко всем используемым при лечении РМЖ химиопрепаратам: паклитакселу (в сочетании с карбоплатином и без него), доцетакселу, винорелбину. По данным исследований фазы II, эффективность комбинаций трастузумаба с паклитакселом достигает 36–81%, доцетакселом – 44–70%, капецитабином – 44–63%, винорелбином – 44–84%, гемцитабином – 27,5–36% [24].
Трастузумаб изучали также в составе эндокринотерапии при гормонозависимом HER2-положительном РМЖ. Препарат продемонстрировал способность улучшать результаты лечения этой категории больных (TanDEM, eLEcTRA) (табл. 4) [25, 26].
Лапатиниб
Этот препарат появился позже трастузумаба и в монотерапии оказался эффективным у 1,4–24% больных в зависимости от линии терапии. С лапатинибом, имевшим механизм действия, отличный от такового трастузумаба, связывали надежды на более высокую активность и возможность эффективной терапии при резистентности к трастузумабу. Однако прямое сравнение лапатиниба с трастузумабом в первой линии терапии в сочетании с таксанами показало меньшую эффективность лапатиниба: медиана времени до прогрессирования составила 8,8 месяца в группе лапатиниба и 11,4 месяца в группе трастузумаба (ОР 1,33; p = 0,01) при отсутствии различий в продолжительности жизни (ОР 1,1; p = 0,62). Лечение лапатинибом сопровождалось большей токсичностью за счет гастроинтестинальных осложнений (диареи) [27]. На основании данных исследования по неоадъювантной терапии GeparQuinto, а также исследования CEREBEL, показавшего меньшую эффективность комбинации с лапатинибом, этот препарат сегодня оценивается как менее эффективный и более токсичный по сравнению с трастузумабом и вне рамок клинических исследований занимает нишу в комбинации с капецитабином на поздних этапах лечения (после того, как возможности других анти-HER2-препаратов исчерпаны).
Лапатиниб в комбинации с летрозолом был изучен в исследовании EGF3008 при гормонозависимом HER2-положительном РМЖ: комбинированная терапия оказалась более эффективной по сравнению с монотерапией летрозолом как по показателю частоты объективных эффектов, так и времени до прогрессирования (табл. 4) [28].
Пертузумаб
Наиболее значимы результаты пилотного многоцентрового двойного слепого плацебоконтролируемого исследования фазы III CLEOPATRA, посвященного сравнению эффективности двойной блокады HER2 «пертузумаб + трастузумаб» и монотерапии трастузумабом (оба варианта анти-HER2-терапии назначались в сочетании с доцетакселом) при метастатическом РМЖ. Добавление пертузумаба позволило существенно (на 6,1 месяца) увеличить время до прогрессирования (18,5 против 12,4 месяца; р = 0,0001) и снизить риск смерти на 34% (ОР 0,66; р = 0,0008): на момент анализа результатов медиана продолжительности жизни в группе пертузумаба не была достигнута, в то время как в группе контроля она составила 37,6 месяца. Частота объективных эффектов в группе пертузумаба была также значительно выше (80,2 против 69,3%; р = 0,001) [29, 30]. На основании полученных данных двойная блокада HER2 пертузумабом и трастузумабом в сочетании с доцетакселом зарегистрирована в США, Европе и России как режим первой линии терапии метастатического HER2(+) РМЖ.
Трастузумаб эмтанзин (T-DM1)
Первые клинические исследования с участием многократно леченных больных (медиана количества линий терапии – 4) продемонстрировали значимую эффективность препарата с частотой объективных эффектов 44% [31]. В исследовании фазы III EMILIA при рандомизированном сравнении T-DM1 с комбинацией капецитабина и лапатиниба у больных, получавших ранее таксаны и трастузумаб, были выявлены различия во времени до прогрессирования в пользу T-DM1 (9,6 против 6,4 месяца; р < 0,0001). Снижение риска смерти в группе пациентов, получавших T-DM1, составило 32% (ОР 0,68; р = 0,0006), что в абсолютных цифрах соответствовало увеличению продолжительности жизни в среднем на 5,8 месяца (медиана продолжительности жизни – 30,9 против 25,1 месяца). В ходе исследования не отмечалось каких-либо проявлений токсичности, отличавшихся от описанных ранее. Частота побочных эффектов 3–4-й степени выраженности была выше в группе больных, получавших комбинацию лапатиниба и капецитабина (40,8 против 57,0%) [32, 33]. В настоящее время Т-DM1 одобрен для лечения метастатического HER2-положительного РМЖ у больных, получавших ранее трастузумаб и таксаны (доцетаксел или паклитаксел) по поводу метастатической болезни, а также у больных, у которых прогрессирование болезни произошло в течение ближайших шести месяцев после завершения адъювантной терапии.
Таким образом, перечень блокаторов HER2 сигнального пути пополнился двумя новыми лекарственными средствами – пертузумабом и T-DM1. Анализ результатов сравнительного изучения эффективности и токсичности препаратов этой группы позволил экспертам ASCO сформулировать первые рекомендации по лечению HER2-положительного метастатического и местнораспространенного РМЖ. Предлагается следующая последовательность назначения препаратов:
1) первая линия: трастузумаб + пертузумаб + таксаны;
2) вторая линия: трастузумаб эмтанзин (T-DM1);
3) третья линия:
- T-DM1 (для больных, не получавших ранее T-DM1);
- пертузумаб (для больных, не получавших ранее пертузумаб);
- лапатиниб + капецитабин, различные режимы химиотерапии + трастузумаб, лапатиниб + трастузумаб (для больных, получавших ранее пертузумаб и T-DM1) [34].
Положительный HER2-статус не является противопоказанием к гормонотерапии, хотя в целом свидетельствует о ее меньшей потенциальной эффективности по сравнению с HER2-отрицательными опухолями. Для больных с гормонозависимыми HER2-положительными опухолями рекомендуется либо стандартная терапия первой линии (химиотерапия + анти-HER2-терапия), либо (в отдельных случаях) гормонотерапия в сочетании с анти-HER2-терапией или без таковой [34].
Заключение
Клинические достижения, связанные с появлением анти-HER2-препаратов, можно считать серьезным прорывом в противоопухолевой терапии РМЖ. Эти препараты позволяют влиять на естественное течение болезни и менять судьбу большой категории больных. Появление подобных средств доказывает не только теоретическую, но и практическую возможность целенаправленного и эффективного воздействия на ключевые патогенетические механизмы канцерогенеза. Однако, как и в случае гормонотерапии (которая считается первым видом таргетного лечения), даже при наличии известной мишени эффективность поражающего ее препарата не достигает 100%. Это объясняется разными механизмами устойчивости, большинство которых пока не расшифрованы. Поиск маркеров чувствительности, которые помогли бы выделить для каждого препарата целевую популяцию больных, является основным стратегическим направлением дальнейших научных исследований.