количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
«Инкретины» в терапии больных сахарным диабетом 2 типа: фокус на сердечно- сосудистую безопасность
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" Спецвыпуск
- Аннотация
- Статья
- Ссылки
В статье обсуждаются современные представления о кардиопротекторных свойствах инкретинонаправленной терапии: фокус на ингибитор ДПП-4 - вилдаглиптин.
Последние годы большое внимание уделяется сердечно-сосудистой безопасности сахароснижающей терапии больных сахарным диабетом 2 типа.
В статье обсуждаются современные представления о кардиопротекторных свойствах инкретинонаправленной терапии: фокус на ингибитор ДПП-4 - вилдаглиптин.
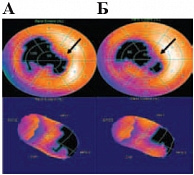
Рис. 1. Данные ОФЭКТ миокарда пациента Д.
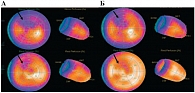
Рис. 2. Улучшение перфузии миокарда левого желудочка пациента Г. по данным ОФЭКТ после лечени
С поиском оптимальных средств контроля диабета связана активная разработка нового направления терапии СД 2 типа, основанного на гормонах желудочно-кишечного тракта – инкретинах, к которым относятся агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) и ингибиторы дипептидилпептидазы-4 (ДПП-4). Обладая рядом преимуществ (улучшение функции бета-клеток, физиологический механизм секреции инсулина «по потребности» с низким риском гипогликемии, подавление повышенной секреции глюкагона, способность контролировать массу тела), они заняли достойное место в сахароснижающей терапии СД 2 типа [4]. В настоящее время установлены гликемические и негликемические эффекты ГПП-1. Механизм действия ГПП-1 опосредован через рецепторы, экспрессируемые не только в бета-клетках поджелудочной железы и желудочно-кишечного тракта, но и в нервной системе, сердце, гладкомышечных клетках сосудов, эндотелиальных клетках и макрофагах [5, 6, 7]. В этой связи большой интерес представляют данные о влиянии инкретинов на сердечно-сосудистую систему. Помимо косвенного влияния ГПП-1 на течение сердечно-сосудистых заболеваний за счет снижения уровня гликемии, накапливаются данные фундаментальных и клинических исследований о глюкозонезависимом влиянии ГПП-1 на сердечно-сосудистую систему [8].
По данным экспериментальных исследований, дефицит инкретина сопровождается увеличением объема левого желудочка и толщины его стенок, развитием диастолической дисфункции [5, 9]. И наоборот, применение ГПП-1 или агонистов ГПП-1 способствует улучшению сократительной функции миокарда [10, 11]. На моделях животных с ишемией миокарда была продемонстрирована способность ГПП-1 уменьшать зону инфаркта до 40–50% [14, 15]. У крыс и собак с хронической сердечной недостаточностью (ХСН) (в том числе в сочетании с ожирением, инсулинорезистентностью, артериальной гипертонией и дилатационной кардиомиопатией) введение ГПП-1 значительно улучшало систолическую и диастолическую функцию миокарда, повышало чувствительность к инсулину и утилизацию глюкозы [14, 15]. Назначение мышам с эндотелиальной дисфункцией и атеросклерозом как нативного ГПП-1, так и его миметика сопровождалось улучшением функции эндотелия [16]. А у крыс с сердечной недостаточностью применение ГПП-1 приводило к значительному увеличению сердечного выброса за счет периферической вазодилатации [15]. Помимо влияния на миокард и эндотелиальные клетки, ГПП-1 может также оказывать влияние на атеросклероз путем прямого воздействия на моноциты или макрофаги. По данным ряда авторов, было показано, что введение эндогенного ГПП-1 подавляет продукцию моноцитов и их адгезию к сосудистым эндотелиальным клеткам, проникновение моноцитов/макрофагов через сосудистую стенку, трансформацию макрофагов и пролиферацию сосудистых гладкомышечных клеток, уменьшает гиперплазию интимы поврежденных сосудов [17, 18].
Важно отметить, что аналогичные результаты наблюдались и в клинической практике. В небольшом исследовании у пациентов преимущественно без СД 2 типа с острым инфарктом миокарда, перенесших баллонную ангиопластику коронарных артерий со стентированием, сравнивали краткосрочное в/в введение ГПП-1 в течение 72 часов (n = 11) со стандартной терапией у аналогичных пациентов (n = 10). Исследователи продемонстрировали, что введение ГПП-1 способствовало значительному улучшению фракции выброса левого желудочка (ФВ ЛЖ) (на 11%) и снижению индекса локальной сократимости (на 21%) по сравнению с группой контроля [10]. А применение аналога ГПП-1 эксенатида у пациентов с острым инфарктом миокарда (с СД 2 типа и без него) в условиях реперфузии способствовало уменьшению окончательного размера зоны инфаркта через 3 месяца наблюдения, при этом не было отмечено изменения гемодинамических параметров [19]. По данным других исследователей, при проведении нагрузочной пробы (проба с добутамином) экзогенное введение ГПП-1 (1,2 пмоль/кг/мин) (n = 14) [20] сопровождалось улучшением сократимости левого желудочка за счет влияния на метаболизм «оглушенного миокарда», а у пациентов, перенесших плановое чрескожное коронарное вмешательство (n = 20), инфузия ГПП-1 (1,2 пмоль/кг/мин) улучшала восстановление диастолической и систолической функции левого желудочка после окклюзии коронарной артерии баллоном [21]. Наоборот, в другом исследовании, включавшем аналогичное количество пациентов с сохранной сократительной функцией левого желудочка, перенесших аортокоронарное шунтирование, было продемонстрировано, что инфузия ГПП-1 в течение 12 часов до и 36 часов после операции сопровождалась только улучшением гликемического контроля, снижая потребность в высоких дозах инсулина [22].
В проспективном рандомизированном исследовании 172 пациентам с острым инфарктом миокарда с подъемом сегмента ST было выполнено чрескожное коронарное вмешательство; этих пациентов рандомизировали в две группы в зависимости от терапии: плацебо или в/в введение эксенатида в течение 15 минут до и 6 часов после манипуляции. Через 3 месяца в группе эксенатида, в отличие от контрольной группы, отмечалось уменьшение площади поврежденного миокарда, при этом ФВ ЛЖ достоверно не изменилась [19].
У пациентов с СД 2 типа в сочетании с ХСН при краткосрочном введении ГПП-1 в течение 3 дней наметилась тенденция к улучшению как систолической, так и диастолической функции миокарда, хотя эти изменения не достигли статистической значимости [23]. А длительное применение (5 недель) ГПП-1 у больных ХСН III и IV ФК (по NYHA) как с СД 2 типа, так и без него способствовало значимому повышению ФВ ЛЖ, потребности миокарда в кислороде и функциональному состоянию миокарда, а также сопровождалось улучшением качества жизни пациентов по данным Миннесотского опросника для больных хронической сердечной недостаточностью (Minnesota Living with Heart Failure Quality of Life, MNQOL), причем данные эффекты не наблюдались у пациентов с сохранной сократительной функцией миокарда [11]. Авторы пришли к выводу о том, что постоянная инфузия ГПП-1 значительно улучшает функцию левого желудочка, функциональный статус и качество жизни пациентов с тяжелой сердечной недостаточностью. ГПП-1, вероятно, оказывает кардиальные физиологические эффекты, механизм действия которых еще предстоит изучить.
Точные механизмы, лежащие в основе влияния ГПП-1 на сердечную мышцу в условиях ишемии, до сих пор не установлены. Тем не менее ряд экспериментальных исследований показал, что эти механизмы не зависят от метаболизма глюкозы и могут быть опосредованы через активацию цГМФ/цАМФ (циклический гуанозинмонофосфат / циклический аденозинмонофосфат)-зависимых путей и различных прокиназ [5, 13, 24, 25]. Также предполагается, что ГПП-1 может положительно влиять на апоптоз кардиомиоцитов, окислительный стресс и эндогенные антиоксидантные защитные механизмы, при этом оказывая благоприятное воздействие в отношении ишемизированного миокарда [5, 33, 24, 25]. В недавних работах было продемонстрировано, что «неактивный» метаболит ГПП-1 (9–36) может оказывать такой же эффект, как и нативный ГПП-1 [26], дополнительно подтверждая предположение о том, что метаболически неактивные формы ГПП-1 могут играть активную роль в защите сердечно-сосудистой системы.
Известно, что эндотелиальная дисфункция с последующим воспалением и выработкой цитокинов лежит в основе развития атеросклероза, главного субстрата сердечно-сосудистых заболеваний. Именно поэтому возможность тормозить процесс атеросклероза на начальных стадиях с помощью ГПП-1 представляется интересным направлением. Рецепторы к ГПП-1 присутствуют в сосудистой стенке, и в экспериментальных работах было продемонстрировано, что ГПП-1 обладает прямым дозозависимым сосудорасширяющим эффектом у крыс в легочной, бедренной артериях и мезентериальных сосудах. Обсуждая возможные механизмы влияния ГПП-1 на сосудистую стенку, исследователи продемонстрировали, что ГПП-1 способствует фосфорилированию эндотелиальной синтазы оксида азота и потенцированию его действия, сопровождающемуся увеличением продукции оксида азота [15].
Данный аспект изучался в нескольких работах в условиях клинической практики. В рандомизированном исследовании J. Koska и соавт., оценивая функцию эндотелия у пациентов с нарушенной толерантностью к глюкозе (НТГ) и с впервые выявленным СД 2 типа [27], показали, что использование даже одной дозы эксенатида приводило к значительному улучшению функции эндотелия в постпрандиальном периоде по сравнению с плацебо. По данным другой работы, во время проведения глюкозотолерантного теста инфузия ГПП-1 в низких дозах (0,4 ммоль/кг/мин) способствовала вазодилатации сосудов у пациентов как с СД 2 типа (n = 16), так и без него (n = 12) за счет уменьшения уровня маркеров окислительного стресса [28]. Аналогичные результаты были получены в других наблюдениях, в которых болюсное введение ГПП-1 приводило к эндотелийзависимой дилатации артерий предплечья у здоровых добровольцев [29] и у пациентов с СД 2 типа в сочетании с ишемической болезнью сердца (ИБС).
Обсуждая возможные механизмы влияния ГПП-1 на сосудистую стенку, одни исследователи считают, что сосудорасширяющее действие ГПП-1 опосредовано активацией рецепторов ГПП-1 [30] и выработкой оксида азота [5, 4, 31, 32], тогда как другие указывают, что эти эффекты могут проявляться через другие пути, такие как активация каналов KАТФ и цАМФ [33, 30]. Тем не менее недавно сообщалось о том, что и активный ГПП-1 (9–39), и метаболически неактивный ГПП-1 (9–36) сами по себе способны вызывать расширение сосудов [5, 33].
Кроме этого, при применении инкретинонаправленной терапии в клинической практике имеются убедительные данные об их влиянии в большей степени на уровень систолического артериального давления (САД), чем на диастолическое артериальное давление (ДАД) [34, 35]. В ретроспективном метаанализе шести исследований эксенатид вызывал снижение САД на 2–4 мм рт. ст. по сравнению с плацебо или инсулинотерапией [36, 35]. В данном метаанализе снижение САД было наиболее выраженным по амплитуде у пациентов с исходно высокими показателями артериального давления (АД), а у пациентов с исходно нормальным уровнем АД не отмечалось достоверных изменений. Аналогичные результаты были получены при применении лираглутида: САД снижалось на 2–3 мм рт. ст. по сравнению с глимепиридом [37, 34]. В подгруппе эксенатида также отмечалась слабая корреляционная взаимосвязь между уровнем САД и потерей веса [35]. Таким образом, дальнейшее изучение данного аспекта поможет выявить точные механизмы, лежащие в основе влияния ГПП-1 на артериальное давление. В настоящее время предполагается, что эффективное снижение АД у больных СД 2 типа может быть обусловлено сосудорасширяющим [5] и натрийуретическим действием ГПП-1 [38]. Тем не менее влияние ГПП-1 и/или агонистов ГПП-1 на уровень АД еще предстоит тщательно изучить, так как до сих пор появляются противоречивые данные [36, 35].
Ингибиторы дипептидилпептидазы-4 являются еще одним вариантом инкретинонаправленной терапии СД 2 типа, их основное действие направлено на увеличение длительности действия эндогенных инкретинов (ГПП-1), то есть на мобилизацию собственных резервов организма для борьбы с гипергликемией. Одним из наиболее часто назначаемых ингибиторов ДПП-4 является вилдаглиптин (препарат Галвус, «Новартис», Швейцария) и его фиксированная комбинация с метформином – ГалвусМет. Зная о кардиопротекторных свойствах ГПП-1 у больных СД 2 типа, в настоящее время мы гораздо меньше знаем о возможных сердечно-сосудистых эффектах ингибиторов ДПП-4, поэтому возникает вопрос: может ли фармакологическое ингибирование фермента ДПП-4 способствовать реализации положительного влияния ГПП-1 на сердечно-сосудистую систему? Необходимо отметить, что в доклинических исследованиях по выявлению плейотропных свойств, как правило, используются супрафизиологические дозы ГПП-1, а ингибиторы ДПП-4 только способствуют повышению уровня эндогенного инкретина, который может и не оказывать соответствующего воздействия.
Однако при изучении влияния на факторы сердечно-сосудистого риска, такие как артериальная гипертония и дислипидемия, данные экспериментальных и клинических исследований продемонстрировали косвенные признаки положительных эффектов ингибиторов ДПП-4 [39]. В небольшой пилотной работе исследователи показали, что 4-недельное применение вилдаглиптина способствует улучшению эндотелийзависимой вазодилатации плечевой артерии у больных с СД 2 типа опосредованно через действие эндогенного ГПП-1; этот эффект не коррелировал с уровнем гликемии и инсулина [40]. Кроме того, в работе наблюдалось незначительное снижение САД и ДАД при повышении частоты сердечных сокращений (ЧСС), однако эти изменения не достигали статистической значимости и были объяснены сосудорасширяющим эффектом и изменениями в активности симпатической нервной системы. В одном 24-недельном исследовании, в котором оценивали влияние вилдаглиптина в комбинации с метформином на АД, было выявлено незначительное снижение САД на 2 мм рт. ст. (против 0,2 мм рт. ст. в группе плацебо) [41].
К важным эффектам ингибиторов ДПП-4 также можно отнести благоприятное влияние на липидный обмен, в частности, на постпрандиальный уровень триглицеридов (ТГ), липопротеинов низкой (ЛПНП) и высокой плотности [42, 43, 44, 45]. Однако эти изменения нельзя рассматривать изолированно от общего действия ингибиторов ДПП-4, и очевидно, что должны быть проведены дополнительные работы по подтверждению влияния инкретиномиметиков на основные факторы риска ССЗ. Несмотря на данные многочисленных мировых исследований и большой клинический опыт применения нового класса препаратов, перед клиницистами встает вопрос о целесообразности применения ингибиторов ДПП-4 у пациентов с ИБС и, особенно, у больных, перенесших инфаркт миокарда. В настоящее время данный аспект терапии находится под пристальным вниманием и активно изучается, но имеющиеся данные противоречивы. Так, при экспериментально вызванном инфаркте миокарда у крыс применение вилдаглиптина в течение 3 недель не приводило к улучшению сократительной функции миокарда и не влияло на размер кардиомиоцита и плотность капилляров после перенесенного инфаркта миокарда [46].
Представим данные работы, выполненной на кафедре эндокринологии и диабетологии Российской медицинской академии последипломного образования. Основной целью исследования явилось изучение влияния 24-недельной терапии вилдаглиптином на сократительную функцию миокарда и его перфузию у больных СД 2 типа в сочетании с ИБС [47]. В исследование вошли 60 пациентов, которые были рандомизированы в 3 группы в зависимости от выбранной сахароснижающей терапии: пациенты группы 1 получали вилдаглиптин (n = 20), группы 2 – комбинацию «вилдаглиптин + метформин» (n = 20), группы 3 – только метформин (n = 20). Было показано, что на фоне достижения гликемического контроля назначение вилдаглиптина в качестве монотерапии и в комбинации с метформином способствовало уменьшению продолжительности эпизодов болевой и безболевой ишемии миокарда, повышению толерантности к физической нагрузке и ее пороговой мощности за счет улучшения энергометаболизма кардиомиоцитов. По данным однофотонной эмиссионной компьютерной томографии миокарда с изотопом технеция, вилдаглиптин не приводил к ухудшению перфузии миокарда, и в отсутствие трансмуральных рубцовых изменений отмечалась тенденция к уменьшению площади поражения и выраженности перфузионных нарушений. В качестве иллюстрации приведем несколько клинических примеров.
Клинический пример 1. Больная Д., 70 лет. Страдает СД 2 типа с 2009 г., по поводу чего принимала метформин в среднесуточной дозе 2,0 г/сут. При очередном обследовании выявлена гипергликемия натощак 8,3 ммоль/л, постпрандиальная гликемия 8,9 ммоль/л, уровень HbА1с составил 8,1%. Самоконтроль гликемии проводит редко, придерживается основных принципов рационального питания при СД 2 типа. В 2006 г. перенесла Q-инфаркт миокарда передне-перегородочной области левого желудочка. Постинфарктный период осложнился развитием аневризмы перегородочно-верхушечной области. Повышение АД отмечается в течение более 20 лет, по поводу чего гипотензивные и антиангинальные препараты принимала нерегулярно. В настоящее время получает Беталок Зок 50 мг/сут, Нолипрел форте 1 таб/сут, Тромбо АСС 100 мг/сут, в качестве гиполипидемической терапии – Вазилип 10 мг/сут.
Для детальной оценки функционального состояния миокарда было проведено инструментальное обследование. На ЭКГ (исходно) – синусовый ритм, рубцовые изменения миокарда в передне-перегородочной области. ЭКГ-картина аневризмы ЛЖ. Эхокардиография (ЭхоКГ) исходно показала постинфарктную аневризму перегородочно-верхушечной области левого желудочка. Сократительная способность миокарда левого желудочка умеренно снижена, фракция выброса (ФВ) – 50% (по Simpson). Левые камеры сердца дилатированы. Конечный диастолический размер левого желудочка (КДР) – 53 мм, конечный систолический размер (КСР) – 34 мм, конечный диастолический объем левого желудочка (КДО) – 153 мл, конечный систолический объем (КСО) – 76 мл. Недостаточность митрального клапана (МК) 1,5 ст. Проба с физической нагрузкой или медикаментозная проба не проводилась (по настоянию пациента). По результатам суточного мониторирования ЭКГ ишемической депрессии и жизнеугрожающих аритмий не выявлено.
После полного лабораторного и инструментального обследования с целью достижения компенсации углеводного обмена был назначен ГалвусМет 50/1000 мг 2 таб/сут (вилдаглиптин + метформин). Сопутствующая терапия не корректировалась в течение периода наблюдения (6 месяцев). Через 24 недели сахароснижающей терапии гликемия натощак составила 7,1 ммоль/л, постпрандиальная гликемия – 6,9 ммоль/л, уровень HbА1с составил 7,4%. При контрольной ЭхоКГ сохранялась картина постинфарктной аневризмы перегородочно-верхушечной области левого желудочка. Отмечалось незначительное повышение сократительной способности миокарда левого желудочка, ФВ 52% (по Simpson). Размеры камер сердца существенно не изменились: КДР – 50 мм, КСР – 30 мм, КДО – 146 мл, КСО – 69 мл. Суточное мониторирование ЭКГ показало отсутствие ишемической депрессии и жизнеугрожающих аритмий. Для выявления зон жизнеспособного миокарда на фоне проводимой сахароснижающей терапии пациентке проводилась однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ) в покое.
Исходно на сцинтиграфических срезах определялись признаки глубоких рубцовых изменений в области верхушечных сегментов передней стенки и передней межжелудочковой перегородки (МЖП) с распространением рубцовых изменений с жизнеспособным миокардом в области верхушки. Общая площадь рубцовой зоны составила 21–23%. ФВ ЛЖ в покое – 43%. Через 24 недели терапии также наблюдались сцинтиграфические признаки глубоких рубцовых изменений в области передней МЖП (верхушечные сегменты) с частичным захватом прилегающих отделов верхушки миокарда левого желудочка. При сравнении с исходными данными отмечается уменьшение выраженности перфузионных нарушений и площади рубцового поражения с 21–23% до 15–17% за счет зон жизнеспособного миокарда, повышение ФВ с 43% до 48% (рис. 1). Таким образом, данный клинический пример демонстрирует, что назначение вилдаглиптина пациенту с аневризмой левого желудочка, сниженной фракцией выброса способствует улучшению перфузионных нарушений миокарда и уменьшению площади дефекта перфузии за счет зон жизнеспособного миокарда, что, несомненно, положительно влияет на качество жизни больного.
Клинический пример 2. Пациентка Г., 63 года. Страдает сахарным диабетом 2 типа с 2008 г. С момента верификации СД 2 типа принимала метформин в дозе 2,0 г/сут. В 2001 г. перенесла инфаркт миокарда задней стенки левого желудочка. Тогда же выполнена чрескожная транслюминальная коронарная ангиопластика (ТЛБАП) со стентированием 3 коронарных сосудов. Страдает гипертонической болезнью более 17 лет с повышением АД до 180/100 мм рт. ст., по поводу чего наблюдалась кардиологом и принимала гипотензивные препараты. Пароксизмальная форма фибрилляций предсердий развилась после острого инфаркта миокарда. В настоящее время получает Энзикс дуо 1 таб/сут, Амлотоп 10 мг 1 таб/сут, Тромбо АСС 100 мг/сут, дигоксин 0,25 мг по 1 таб/день (5 дней/нед). При очередном визите выявлена гипергликемия натощак 7,1 ммоль/л, постпрандиальная гликемия 7,9 ммоль/л, уровень HbА1с составил 7,3%. При исходном анализе липидного профиля отмечалось повышение показателей общего холестерина (ОХ), ТГ и ЛПНП.
На этапе включения в исследование была проведена оценка функционального состояния миокарда. ЭхоКГ исходно: недостаточность МК 2 ст., трехстворчатого клапана (ТК) 1,5 ст. Признаки легочной гипертензии. Постинфарктные рубцовые изменения задней стенки левого желудочка (гипокинез задней стенки на базальном и среднем уровнях). Сократительная способность миокарда левого желудочка умеренно снижена, ФВ 52% (по Simpson). Суточное мониторирование ЭКГ ишемической депрессии не выявило. Учитывая субкомпенсацию углеводного обмена, пациентке был назначен ГалвусМет 50/1000 мг 2 р/сут. Сопутствующая терапия не корректировалась в течение периода наблюдения (6 месяцев). Через 24 недели сахароснижающей терапии гликемия натощак составила 5,4 ммоль/л, постпрандиальная гликемия – 6,1 ммоль/л, уровень HbА1с – 6,2%. Наблюдалось снижение уровня ЛПНП при относительно повышенном уровне ОХ и ТГ. При контрольной ЭхоКГ наметилась тенденция к уменьшению объемов левого желудочка (КДР уменьшился с 50 до 46 мм, КСР – с 30 до 27 мм, КДО – с 135 до 115 мл и КСО – с 62 до 48 мл). Отмечалось повышение ФВ – с 52 до 58% (по Simpson). В остальном без изменений. Суточное мониторирование ЭКГ: ишемической депрессии не выявлено.
С целью оценки степени перфузионных нарушений была проведена ОФЭКТ миокарда в покое и на пике физической нагрузки исходно и по окончании периода наблюдения (рис. 2). Исходно отмечались признаки сниженной перфузии миокарда передней и передне-перегородочной стенок как в покое, так и на пике нагрузки. Через 6 месяцев терапии комбинацией вилдаглиптина с метформином наблюдалась практически полная нормализация миокардиального кровотока в покое (площадь дефекта перфузии уменьшилась с 7 до 2%) и на фоне нагрузки произошло уменьшение площади перфузионных нарушений с 11 до 6% площади левого желудочка. Таким образом, назначение комбинации «вилдаглиптин + метформин» пациентке с исходно минимальными отклонениями от нормы по данным ОФЭКТ привело к практически полной нормализации миокардиального кровотока как в покое, так и на нагрузке.
В 2009 г. был проведен широкомасштабный метаанализ сердечно-сосудистых эффектов терапии вилдаглиптином у 11 тысяч пациентов. Результаты анализа показали, что терапия вилдаглиптином не связана с повышенным риском развития каких-либо сердечно-сосудистых и цереброваскулярных заболеваний у больных любого возраста и пола независимо от наличия исходных факторов сердечно-сосудистого риска [48]. Более того, сердечно-сосудистая смертность, скорректированная по количеству исходов, составила 0,88 случая на 100 пациенто-лет для вилдаглиптина в дозе 50 мг 1 р/день и 0,84 случая на 100 пациенто-лет для вилдаглиптина в дозе 100 мг/сут. Аналогичные результаты были получены в исследованиях длительностью не менее 52 недель; было показано, что терапия вилдаглиптином не повышает риск развития ССЗ [5]. Позже данные M. Monami и соавт. также подтвердили, что применение ингибиторов ДПП-4 не приводит к увеличению частоты сердечно-сосудистых событий и не увеличивает смертность от всех других причин [49]. Тем не менее в настоящее время инициировано крупное рандомизированное плацебоконтролируемое исследование (n = 490) с целью оценки эффективности и безопасности применения вилдаглиптина у больных СД 2 типа в сочетании с ХСН.
В заключение подчеркнем: наше понимание роли инкретинонаправленной терапии при сахарном диабете 2 типа стремительно расширяется, продемонстрированные результаты применения ингибиторов ДПП-4 (вилдаглиптина) могут иметь большое значение в контексте профилактики развития сердечно-сосудистых осложнений у данной категории пациентов и обеспечить основу для дальнейших исследований.
1. Becker A., Bos G., de Vegt F. et al. Cardiovascular events in type 2 diabetes: comparison with nondiabetic individuals without and with prior cardiovascular disease. 10-year follow-up of the Hoorn Study // Eur. Heart J. 2003. Vol. 24. № 15. P. 1406–1413.
2. Lee C.D., Folsom A.R., Pankow J.S. et al. Cardiovascular events in diabetic and nondiabetic adults with or without history of myocardial infarction // Circulation. 2004. Vol. 109. № 7. P. 855–860.
3. Nathan D.M., Buse J.B., Davidson M.B. et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2009. Vol. 32. № 1. P. 193–203.
4. Drucker D.J. The biology of incretin hormones // Cell. Metab. 2006. Vol. 3. № 3. P. 153–165.
5. Cleland JGF, Swedberg K., Follath F. et al. The IMPROVEMENT of heart failure survey. International variations in the aetiology of heart failure managed in primary care. Eur J Heart Fait. 2001; 3: S72. [Abstract].
6. Ban K., Noyan-Ashraf M.H., Hoefer J. et al. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways // Circulation. 2008. Vol. 117. № 18. P. 2340–2350.
7. Tomas E., Habener J.F. Insulin-like actions of glucagon-like peptide-1: a dual receptor hypothesis // Trends Endocrinol. Metab. 2010. Vol. 21. № 2. P. 59–67.
8. Wei Y., Mojsov S. Tissue-specific expression of the human receptor for glucagon-like peptide-I: brain, heart and pancreatic forms have the same deduced amino acid sequences // FEBS Lett. 1995. Vol. 358. № 3. P. 219–224.
9. Gros R., You X., Baggio L.L. et al. Cardiac function in mice lacking the glucagon-like peptide-1 receptor // Endocrinology. 2003. Vol. 144. № 6. P. 2242–2252.
10. Nikolaidis L.A., Mankad S., Sokos G.G. et al. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion // Circulation. 2004. Vol. 109. № 8. P. 962–965.
11. Sokos G.G., Nikolaidis L.A., Mankad S. et al. Glucagon-like peptide-1 infusion improves left ventricular ejection fraction and functional status in patients with chronic heart failure // J. Card. Fail. 2006. Vol. 12. № 9. P. 694–699.
12. Nikolaidis L.A., Doverspike A., Hentosz T. et al. Glucagon-like peptide-1 limits myocardial stunning following brief coronary occlusion and reperfusion in conscious canines // J. Pharmacol. Exp. Ther. 2005. Vol. 312. № 1. P. 303–308.
13. Noyan-Ashraf M.H., Momen M.A., Ban K. et al. GLP-1R agonist liraglutide activates cytoprotective pathways and improves outcomes after experimental myocardial infarction in mice // Diabetes. 2009. Vol. 58. № 4. P. 975–983.
14. Nikolaidis L.A., Elahi D., Hentosz T. et al. Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy // Circulation. 2004. Vol. 110. № 8. P. 955–961.
15. Poornima I., Brown S.B., Bhashyam S. et al. Chronic glucagon-like peptide-1 infusion sustains left ventricular systolic function and prolongs survival in the spontaneously hypertensive, heart failure-prone rat // Circ. Heart Fail. 2008. Vol. 1. № 3. P. 153–160.
16. Gaspari T., Liu H., Welungoda I. et al. A GLP-1 receptor agonist liraglutide inhibits endothelial cell dysfunction and vascular adhesion molecule expression in an ApoE-/- mouse model // Diab. Vasc. Dis. Res. 2011. Vol. 8. № 2. P. 117–124.
17. Goto H., Nomiyama T., Mita T. et al. Exendin-4, a glucagon-like peptide-1 receptor agonist, reduces intimal thickening after vascular injury // Biochem. Biophys. Res. Commun. 2011. Vol. 405. № 1. P. 79–84.
18. Müssig K., Oncü A., Lindauer P. et al. Effects of intravenous glucagon-like peptide-1 on glucose control and hemodynamics after coronary artery bypass surgery in patients with type 2 diabetes // Am. J. Cardiol. 2008. Vol. 102. № 5. P. 646–647.
19. Müssig K., Oncü A., Lindauer P. et al. Effects of intravenous glucagon-like peptide-1 on glucose control and hemodynamics after coronary artery bypass surgery in patients with type 2 diabetes // Am. J. Cardiol. 2008. Vol. 102. № 5. P. 646–647.
20. Read P.A., Khan F.Z., Dutka D.P. Cardioprotection against ischaemia induced by dobutamine stress using glucagon-like peptide-1 in patients with coronary artery disease // Heart. 2012. Vol. 98. № 5. P. 408–413.
21. Read P.A., Hoole S.P., White P.A. et al. A pilot study to assess whether glucagon-like peptide-1 protects the heart from ischemic dysfunction and attenuates stunning after coronary balloon occlusion in humans // Circ. Cardiovasc. Interv. 2011. Vol. 4. № 3. P. 266–272.
22. Sokos G.G., Bolukoglu H., German J. et al. Effect of glucagon-like peptide-1 (GLP-1) on glycemic control and left ventricular function in patients undergoing coronary artery bypass grafting // Am. J. Cardiol. 2007. Vol. 100. № 5. P. 824–829.
23. Sokos G.G., Bolukoglu H., German J. et al. Effect of glucagon-like peptide-1 (GLP-1) on glycemic control and left ventricular function in patients undergoing coronary artery bypass grafting // Am. J. Cardiol. 2007. Vol. 100. № 5. P. 824–829.
24. Sokos G.G., Bolukoglu H., German J. et al. Effect of glucagon-like peptide-1 (GLP-1) on glycemic control and left ventricular function in patients undergoing coronary artery bypass grafting // Am. J. Cardiol. 2007. Vol. 100. № 5. P. 824–829.
25. Zhao T., Parikh P., Bhashyam S. et al. Direct effects of glucagon-like peptide-1 on myocardial contractility and glucose uptake in normal and postischemic isolated rat hearts // J. Pharmacol. Exp. Ther. 2006. Vol. 317. № 3. P. 1106–1113.
26. Nikolaidis L.A., Elahi D., Shen Y.T. et al. Active metabolite of GLP-1 mediates myocardial glucose uptake and improves left ventricular performance in conscious dogs with dilated cardiomyopathy // Am. J. Physiol. Heart Circ. Physiol. 2005. Vol. 289. № 6. P. H2401–H2408.
27. Koska J., Schwartz E.A., Mullin M.P. et al. Improvement of postprandial endothelial function after a single dose of exenatide in individuals with impaired glucose tolerance and recent-onset type 2 diabetes // Diabetes Care. 2010. Vol. 33. № 5. P. 1028–1030.
28. Ceriello A., Esposito K., Testa R. et al. The possible protective role of glucagon-like peptide 1 on endothelium during the meal and evidence for an “endothelial resistance” to glucagon-like peptide 1 in diabetes // Diabetes Care. 2011. Vol. 34. № 3. P. 697–702.
29. Basu A., Charkoudian N., Schrage W. et al. Beneficial effects of GLP-1 on endothelial function in humans: dampening by glyburide but not by glimepiride // Am. J. Physiol. Endocrinol. Metab. 2007. Vol. 293. № 5. P. E1289–E1295.
30. Nyström T., Gonon A.T., Sjöholm A. et al. Glucagon-like peptide-1 relaxes rat conduit arteries via an endothelium-independent mechanism // Regul. Pept. 2005. Vol. 125. № 1–3. P. 173–177.
31. Golpon H.A., Puechner A., Welte T. et al. Vasorelaxant effect of glucagon-like peptide-(7-36)amide and amylin on the pulmonary circulation of the rat // Regul. Pept. 2001. Vol. 102. № 2–3. P. 81–86.
32. Golpon H.A., Puechner A., Welte T. et al. Vasorelaxant effect of glucagon-like peptide-(7-36)amide and amylin on the pulmonary circulation of the rat // Regul. Pept. 2001. Vol. 102. № 2–3. P. 81–86.
33. Green B.D., Hand K.V., Dougan J.E. et al. GLP-1 and related peptides cause concentration-dependent relaxation of rat aorta through a pathway involving KATP and cAMP // Arch. Biochem. Biophys. 2008. Vol. 478. № 2. P. 136–142.
34. Nauck M., Frid A., Hermansen K. et al. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study // Diabetes Care. 2009. Vol. 32. № 1. P. 84–90.
35. Okerson T., Yan P., Stonehouse A. et al. Effects of exenatide on systolic blood pressure in subjects with type 2 diabetes // Am. J. Hypertens. 2010. Vol. 23. № 3. P. 334–339.
36. Gill A., Hoogwerf B.J., Burger J. et al. Effect of exenatide on heart rate and blood pressure in subjects with type 2 diabetes mellitus: a double-blind, placebo-controlled, randomized pilot study // Cardiovasc. Diabetol. 2010. Vol. 9. P. 6.
37. Garber A., Henry R., Ratner R. et al. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial // Lancet. 2009. Vol. 373. № 9662. P. 473–481.
38. Gutzwiller J.P., Tschopp S., Bock A. et al. Glucagon-like peptide 1 induces natriuresis in healthy subjects and in insulin-resistant obese men // J. Clin. Endocrinol. Metab. 2004. Vol. 89. № 6. P. 3055–3061.
39. Kuritzky L. Managing type 2 diabetes in the primary care setting: beyond glucocentricity // Am. J. Med. Sci. 2010. Vol. 340. № 2. P. 133–143.
40. Van Poppel P.C., Netea M.G., Smits P. et al. Vildagliptin improves endothelium-dependent vasodilatation in type 2 diabetes // Diabetes Care. 2011. Vol. 34. № 9. P. 2072–2077.
41. Bosi E., Camisasca R.P., Collober C. et al. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin // Diabetes Care. 2007. Vol. 30. № 4. P. 890–895.
42. Amori R.E., Lau J., Pittas A.G. Efficacy and safety of incretin therapy in type 2 diabetes: systematic review and meta-analysis // JAMA. 2007. Vol. 298. № 2. P. 194–206.
43. Campbell R.K., White J.R. Jr. More choices than ever before: emerging therapies for type 2 diabetes // Diabetes Educ. 2008. Vol. 34. № 3. P. 518–534.
44. Foley J.E., Jordan J. Weight neutrality with the DPP-4 inhibitor, vildagliptin: mechanistic basis and clinical experience // Vasc. Health Risk Manag. 2010. Vol. 6. P. 541–548.
45. Matikainen N., Mänttäri S., Schweizer A. et al. Vildagliptin therapy reduces postprandial intestinal triglyceride-rich lipoprotein particles in patients with type 2 diabetes // Diabetologia. 2006. Vol. 49. № 9. P. 2049–2057.
46. Yin M., Silljé H.H., Meissner M. et al. Early and late effects of the DPP-4 inhibitor vildagliptin in a rat model of post-myocardial infarction heart failure // Cardiovasc. Diabetol. 2011. Vol. 10. P. 85.
47. Schweizer A., Dejager S., Foley J.E. et al. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population // Diabetes Obes. Metab. 2010. Vol. 12. № 6. P. 485–494.
48. Аметов А.С., Кулиджанян Н.К., Шурупова И.В. и др. Влияние ингибиторов дипептидилпептидазы-4 на функциональное состояние миокарда у больных сахарным диабетом 2 типа // Фарматека. 2012. № 10. С. 79–86.
49. Monami M., Iacomelli I., Marchionni N. et al. Dipeptydil peptidase-4 inhibitors in type 2 diabetes: a meta-analysis of randomized clinical trials // Nutr. Metab. Cardiovasc. Dis. 2010. Vol. 20. № 4. P. 224–235.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.