XII Всероссийский научный форум «Мать и дитя»: Инновационные подходы к коррекции микронутриентного статуса беременных и кормящих женщин
- Аннотация
- Статья
- Ссылки
Оценка роли питания беременных в формировании здоровья ребенка в перинатальном периоде и младенчестве радикально изменилась в последние несколько десятилетий. Полноценное питание во время беременности имеет колоссальное значение, поскольку не только обеспечивает энергетические потребности организма матери, но и является субстратом для развития новых тканей плода, а также создает энергетический резерв для лактации. Важно помнить, что качество питания зависит от адекватной обеспеченности микронутриентами – витаминами, микроэлементами, полиненасыщенными жирными кислотами, поскольку плод может получить их только от матери. Именно дефицит микронутриентов является одной из причин дефектов развития в антенатальном периоде: от легкой степени гипотрофии до тяжелых соматических пороков плода. В настоящее время накоплены обширные и убедительные данные, демонстрирующие достоверное снижение частоты врожденных пороков развития нервной трубки, мочевой, сердечно-сосудистой системы у детей, матери которых получали витамины во время беременности в виде витаминно-минеральных комплексов.
- Организм матери в период беременности – единственный источник всех нутриентов для плода
- Полноценное питание беременных и женщин в период преконцепции – основной фактор, определяющий здоровье женщины и формирующий оптимальную программу развития плода
- Недостаток нутриентов во время внутриутробного развития может проявляться различными нарушениями: от легкой степени гипотрофии до аномалий развития и антенатальной гибели
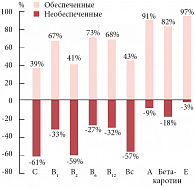
Обеспеченность витаминами беременных женщин в России
Вместе с тем дискуссии о том, нужно ли назначать витамины при беременности, продолжаются в течение многих лет. В то же время, согласно данным профессора В.Б. Спиричева (Институт питания РАМН), проблема неполноценного питания год от года в нашей стране усугубляется, гипоэлементоз и гиповитаминоз выявляются у 20–60% беременных. Наименьшим оказался дефицит витамина Е, он составляет всего 3,6% от суточной потребности, наибольшим – дефицит витаминов С, В2 и фолиевой кислоты – 61–59,5%*. Эти данные были подтверждены другими исследователями, показавшими зависимость обеспеченности организма женщин витаминами от курения (резко утяжеляет полигиповитаминоз), особенностей питания в зимнее время и других факторов. Важно отметить, что все авторы подчеркивают сочетанный характер дефицита витаминов у беременных.
Причины дефицита микронутриентов во время беременности
Причины дефицита микронутриентов во время беременности хорошо изучены. Основными, безусловно, являются нерациональное несбалансированное питание и низкое содержание микронутриентов в продуктах. Дополнительными факторами являются курение, хронические стресс, болезни, а также осложнения беременности, прежде всего ранний токсикоз.
- Увеличение объема внеклеточной жидкости, циркулирующей крови, почечного кровотока и клубочковой фильтрации
- Ранний токсикоз
- Нерациональное несбалансированное питание
- Низкое содержание микронутриентов в продуктах
Дефицит микронутриентов и врожденные пороки развития
Роль фолатов для нормального развития плода является абсолютно доказанной. В течение последних 10 лет проведены крупные двойные слепые плацебоконтролируемые исследования в различных странах Европы, которые показали, что использование фолиевой кислоты в составе витаминных комплексов или в виде монопрепарата снижает частоту развития пороков нервной трубки в 2–2,5 раза по сравнению с плацебо, а также частоту пороков других органов и систем – мочевой, сердечно-сосудистой, конечностей, желудочно-кишечного тракта. Эти данные подтверждены и российскими исследованиями.
Фолиевая кислота и фолаты. Физиологическая роль фолиевой кислоты
Значение фолиевой кислоты в организме переоценить невозможно, поскольку основная функция этого жизненно важного витамина – синтез ДНК и клеточная репликация. Фолаты участвуют в синтезе аминокислот, нуклеиновых кислот, эссенциальных фосфолипидов, нейротрансмиттеров (серотонин, мелатонин, дофамин). Именно с недостатком фолиевой кислоты связывают развитие депрессий у немолодых людей, прежде всего женщин в мено- и постменопаузе. Чрезвычайно важна роль фолатов в формировании новых кровеносных сосудов маточно-плацентарного ложа. Дефицит фолиевой кислоты является причиной различных осложнений беременности (помимо дефекта нервной трубки), таких как самопроизвольный аборт, преждевременные роды, преждевременная отслойка плаценты. Основой этой патологии является приобретенная гипергомоцистеинемия, сопровождающая дефицит витаминов группы В и фолиевой кислоты.
- Участвует в синтезе аминокислот (в том числе глицина, метионина, гистидина), нуклеиновых кислот, пуринов, в обмене холина, синтезе эссенциальных фосфолипидов и нейротрансмиттеров (серотонин, мелатонин, адреналин, дофамин)
- Участвует в процессах кроветворения
- Играет важную роль в формировании ткани плаценты и новых кровеносных сосудов в матке
- 500 г свежей петрушки
Последствия дефицита фолиевой кислоты
- Самопроизвольный выкидыш, преждевременные роды, преждевременная отслойка плаценты
- Врожденные внутриутробные пороки развития (ВПР) сердечно-сосудистой и нервной системы плода, а также пороки развития конечностей, органов зрения
- Риск гипотрофии и недоношенности
- Анемия, тромбоцитопения
Оказалось, что дополнительный прием фолиевой кислоты в количестве 400 мкг в день в течение
4 недель до зачатия и 12 недель беременности снижает риск развития врожденных пороков сердца на 26%, а дефектов сердечной перегородки – на 40%*.
Рекомендуемое потребление фолатов
- Для взрослых – 200 мкг/сут
- Для беременных женщин – 400 мкг в день (+ 100% от нормы)
- Для кормящих женщин – 300 мкг в день (+ 50% от нормы)
Основным источником фолатов являются зеленые листовые овощи, цельные злаковые зерна, сушеные бобы, фасоль, огурцы, помидоры и печень. Но даже хорошее питание не обеспечивает необходимого количества этого микронутриента – для этого необходимо съесть 800 г свежего салата, или 500 г свежей петрушки, или 500 г вареной печени.
Рекомендуемое количество фолатов для небеременных женщин составляет 200 мкг, беременных – 400 мкг, кормящих – 300 мкг.
В 1998 г. в США было проведено обогащение фолиевой кислотой различных зерновых. Это привело к снижению частоты дефектов нервной трубки среди новорожденных на 25%.
Избыток фолиевой кислоты
Вместе с тем избыток фолиевой кислоты так же опасен, как и дефицит. Описан «фолиевый парадокс» – избыток фолиевой кислоты приводит к снижению содержания эндогенных фолатов. Кроме того, чрезмерное потребление во время беременности фолиевой кислоты в дозе выше 1000 мкг в сутки способствует появлению избыточной массы тела у новорожденных, развитию ожирения у детей.
У взрослых установлена связь избытка фолиевой кислоты с онкологической патологией и когнитивными нарушениями.
- «Фолиевый парадокс»: избыток фолиевой кислоты приводит к вытеснению эндогенных фолатов
- Применение во время беременности фолиевой кислоты в дозе, превышающей 1000 мкг/сутки, создает риск рождения ребенка с избыточной массой тела
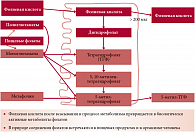
Всасывание различных форм фолатов в желудочно-кишечном тракте
Субстратом фолатного цикла являются поступающие с пищей фолаты, которые в печени восстанавливаются до тетрагидрофолата, производным которого является 5,10-метилтетрагидрофолат. Он участвует в биосинтезе нуклеотидов, необходимых для образования ДНК и РНК. Основным фолатным метаболитом является 5-метилтетрагидрофолат, который представляет собой источник метильных групп для превращения гомоцистеина в метионин. Благодаря 5-метилтетрагидрофолату происходит утилизация избыточного гомоцистеина и восстановление его в метионин. При дефиците фолатов или нарушении их обмена накопление гомоцистеина приводит к развитию эндотелиопатии, гиперкоагуляции, тромбозу и развитию тяжелых акушерских осложнений*.
Полиморфизм генов в процессе метаболизма фолатов
Для превращения фолатов в активные формы и утилизации гомоцистеина необходим фермент метилентетрагидрофолатредуктаза (MTHFR). Полноценная работа этого фермента зависит не только от достаточного количества кофакторов, но и от полноценности генов, кодирующих этот фермент. К настоящему времени обнаружено более 40 точечных мутаций генов, снижающих эффективность процессов метаболизма одноуглеродных соединений. Наиболее изученным является вариант мутации гена, кодирующего фермент метилентетрагидрофолатредуктазу, при котором нуклеотид цитозин (C) в позиции 677 заменен тимидином (T), что приводит к замене аминокислотного остатка аланина на остаток валина (позиция 223) в сайте связывания фолата. Такой полиморфизм обозначается как MTHFR-С677T. Если индивид является гомозиготным носителем описанной мутации и имеет генотип MTHFR-T677T, эффективность работы фермента MTHFR снижается до 35% от нормы. Известно, что 10–12% общей популяции являются носителями генотипа MTHFR-Т677T, а около 40% популяции являются гетерозиготными носителями мутантного аллеля, активность фермента у них снижается на 30%. Последствием гомозиготного носительства является дефицит фолатов и возможный риск ВПР плода.
- 10–12% – гомозиготный вариант mthfr-т677t:
- активность фермента снижена на 65–70%
- уровень 5-МТГФ значительно уменьшается
- уровень гомоцистеина увеличивается
- увеличивается количество осложнений в период беременности
- 40% – гетерозиготный вариант MTHFR-С677Т:
- активность ферментов снижена примерно на 30%
- уровень 5-МТГФ уменьшается
- уровень гомоцистеина увеличивается
- увеличивается количество осложнений в период беременности
Мутации гена MTHFR у женщин группы риска развития гестоза
Проведенные нами исследования у 60 женщин группы высокого риска развития преэклампсии (ожирение и гипертензивный синдром – 20 пациенток, хронический пиелонефрит – 40) показали, что гомозиготные мутации MTHFR-Т677Т при ожирении и гипертоническом синдроме наблюдаются у 50% женщин, полиморфизм гена MTHFR-С677T установлен у 35%. У больных с пиелонефритом выявлен полиморфизм гена MTHFR-С677T в 56% случаев. Эти изменения сочетались с 20-процентным дефицитом 5-метилтетрагидрофолата, несмотря на то что беременные принимали витаминно-минеральные комплексы, содержащие необходимую дозу фолиевой кислоты. При развитии гестоза умеренной степени тяжести дефицит фолата достигал 65%, при тяжелом гестозе – 80%. Дефицит фолатов коррелировал со степенью тяжести гестоза и генетическими дефектами.
- Ожирение и гипертонический синдром:
- мутация MTHFR-T677T – 50%
- полиморфный вариант MTHFR-С677T – 35%
- Пиелонефрит:
- полиморфизм MTHFR-С677T – 56%
Метафолин
Патология беременности в виде преэклампсии на фоне ожирения, гипертензивного синдрома или пиелонефрита непосредственно связана с дефицитом фолиевой кислоты. Возможное решение данной проблемы – еще на этапе прегравидарной подготовки таких женщин использовать препараты фолиевой кислоты (метафолин – соединение кальция и 5-метилтетрагидрофолата), которые метаболизируются без участия фермента метилентетрагидрофолатредуктазы. В 2006 г. на одном из акушерских форумов профессор Боннского университета Клаус Пьетржик (Klaus Pietrzik) подчеркнул, что для оптимального обеспечения организма беременной женщины фолатами рекомендуется частично заменить препараты фолиевой кислоты метафолином.
Докозагексаеновая кислота
Еще одним очень важным компонентом, необходимым для питания беременных и нормальной жизнедеятельности ребенка, является докозагексаеновая кислота (ДГК).
ДГК является длинноцепочечной полиненасыщенной жирной кислотой, принадлежащей к семейству омега-3 жирных кислот. ДГК, наряду с арахидоновой кислотой, является основным строительным материалом клеточных мембран головного мозга и зрительного анализатора плода и новорожденного.
Значение дгк для развития мозга
Установлено, что ДГК составляет 15–20% от общего содержания жирных кислот в фосфолипидах головного мозга. Это полиненасыщенная жирная кислота, которая играет важнейшую роль в проведении импульсов в ЦНС и формировании органа зрения. ДГК откладывается в тканях мозга плода начиная с III триместра беременности и в течение первых месяцев после рождения. ДГК накапливается в жировой ткани матери, мобилизуется и передается через плаценту плоду. Установлено, что в последний триместр беременности происходит усиленный избирательный захват и перенос арахидоновой и докозагексаеновой кислоты через плаценту к плоду.
Значение дгк для зрения
Были проведены специальные исследования, посвященные влиянию ДГК на нервно-психическое развитие и зрение детей раннего возраста. Значение ДГК для развития остроты зрения было показано в двойном слепом рандомизированном исследовании, проведенном Э. Бирч (Eileen Birch) и соавт. в Юго-Западной медицинской школе Университета Техаса (Даллас, США). Его результаты продемонстрировали значительное улучшение развития у младенцев, получавших дополнительно ДГК и арахидоновую кислоту (E.E. Birch, 2007). Аналогичные данные получены в Канаде: было установлено, что потребление младенцами ДГК с грудным молоком в течение 2 месяцев после рождения положительно коррелировало с развитием остроты зрения до достижения возраста 1 года (И.М. Шилин, 2010).
- Организм матери является единственным источником дгк для ребенка
- Количество дгк, поступающей к ребенку от матери, зависит не только от уровня потребления дгк с пищей, но и в значительной степени от запасов кислоты в организме матери, сформировавшихся во время беременности и даже до зачатия
- Для оптимального обеспечения организма ребенка дгк рекомендуется принимать дгк уже на ранней стадии беременности
На конгрессе issfal (Австралия, 2006) был достигнут международный консенсус в отношении дополнительного приема дгк, согласно которому для обеспечения нормального нервно-психического развития и остроты зрения у ребенка рекомендован прием дгк в период беременности и кормления грудью не менее 200 мг в день.
Источники ДГК для ребенка в период беременности и лактации
Совершенно очевидно, что единственным источником ДГК для ребенка является организм матери. Важно, что основное количество ДГК поступает в грудное молоко из запасов, сформировавшихся в организме матери во время беременности или даже до зачатия.
Таким образом, для адекватного обеспечения организма ребенка ДГК длительное наличие нутриента в рационе матери является обязательным.
Именно поэтому новые международные рекомендации по приему ДГК в период беременности и кормления грудью предусматривают потребление ее не менее 200 мг в день, что способствует нормальному умственному развитию и формированию хорошего зрения у ребенка. Отличным пищевым источником ДГК является жирная рыба (лосось, сельдь, скумбрия), но ее количество должно быть значительным, чтобы восполнить необходимые запасы этого важного нутриента. Более целесообразным является использование препаратов ДГК.
Фемибион – новое поколение витаминов для беременных и кормящих женщин
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.