Кабазитаксел в терапии метастатического кастрационно-резистентного рака предстательной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Рак предстательной железы (РПЖ) является одной из самых распространенных опухолей в мире [1]. В России в 2019 г. впервые выявлено 44 706 случаев РПЖ, из них 18,7% IV стадии [2]. Грубые показатели заболеваемости и смертности составляют 62,43 и 19,06 на 100 тыс. мужского населения соответственно, прирост заболеваемости за десять лет – 87,7%, средний возраст заболевших – 69,5 года [3]. Ежегодно в Иркутской области РПЖ диагностируют более чем у 850 мужчин. Из них около 20% имеют отдаленные метастазы на момент первичной диагностики [2, 4].
Несмотря на снижение количества пациентов с распространенным РПЖ благодаря широкому внедрению теста на определение простатспецифического антигена (ПСА) и программ скрининга, уровень смертности остается высоким. К сожалению, метастатический РПЖ – неизлечимое заболевание с уровнем пятилетней выживаемости около 31% [5]. Неудовлетворительные отдаленные результаты связаны и с развитием в процессе лечения кастрационно-резистентных форм заболевания, характеризующихся более агрессивным течением и высокой летальностью. Количество терапевтических опций в отношении метастатического кастрационно-резистентного рака предстательной железы ограниченно.
Исторически использовались эстрамустин и митоксантрон, но их эффективность невысока. В 2004 г. в практику вошел доцетаксел как первый агент с доказанным влиянием на общую выживаемость [6]. В последние годы арсенал расширился за счет антиандрогенов нового поколения, радиотерапии и кабазитаксела. В будущем возможна разработка персонализированного лечения на основании биомаркеров, но пока выбор определяется имеющимися методами [7]. Появление таксанов существенно повлияло на результаты лечения. Обладая уникальным механизмом при РПЖ, таксаны в дополнение к индукции апоптоза за счет разрушения микротрубочек уменьшают транслокацию рецептора андрогена в ядро в клетках рака простаты, а также снижают транскрипцию белка рецептора андрогена [8].
Кабазитаксел – препарат группы таксанов, который показал на доклинических моделях улучшение цитотоксичности по сравнению с доцетакселом и активность в отношении клеток, резистентных к другим таксанам [9].
Клинический случай
Пациент Д., 1949 года рождения, обратился в Иркутский областной онкологический диспансер в мае 2015 г. с жалобами на боль в костях без четкой локализации, снижение массы тела на 10 кг в течение шести месяцев. Пациент без вредных привычек с неотягощенным онкологическим анамнезом, сопутствующей патологией: ишемическая болезнь сердца, стенокардия напряжения, функциональный класс 1, артериальная гипертензия 3-й степени, ожирение 1-й степени (индекс массы тела – 30,5 кг/м2), сахарный диабет 2-го типа, компенсированный приемом сахароснижающих препаратов.
В ходе обследования установлен РПЖ, T4N1M1, стадия IV. При исследовании трукат-биоптатов первичной опухоли обнаружены: в правой доле рост мелкоацинарной аденокарциномы с градацией по шкале Глисона 8 баллов (4 + 4) с очагом периневрального роста опухоли; в левой доле рост мелкоацинарной аденокарциномы с градацией по шкале Глисона 7 баллов (3 + 4). Данные лабораторных анализов: общий кальций – 2,07 мм/л (2,1–2,6), общий белок – 50 г/л (64–83), лактатдегидрогеназа – 218 Ед/л (240–480), щелочная фосфатаза – 1714 Ед/л (40–130), глюкоза – 7,1 мм/л (3,9–5,8), гемоглобин – 108 г/л (130–160), гематокрит – 30,7 (40,48), ПСА общий (от 20 мая 2015 г.) – 4287 нг/мл, тестостерон общий – 7,8 нмоль/л.
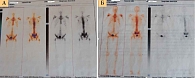
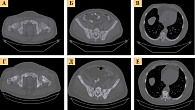
Данные остеогаммасцинтиграфии и компьютерной томографии: множественные метастазы в костной системе.
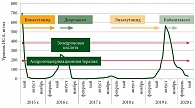
С мая 2015 г. назначена терапия в режиме максимальной андрогенной блокады в комбинации с бисфосфонатами: лейпрорелин 45 мг подкожно один раз в шесть месяцев, бикалутамид (таблетки) 50 мг ежедневно длительно, золедроновая кислота 4 мг внутривенно один раз в четыре недели. после 12 введений – один раз в три месяца, в том числе на протяжении всего периода наблюдения.
На фоне терапии отмечались купирование болевого синдрома, нормализация показателей гемоглобина, общего белка, снижение уровня ПСА с 4287 до 1,9 нг/мл за семь месяцев, тестостерона – до посткастрационного уровня.
В июне 2016 г. ПСА увеличился до 216 нг/мл. Назначили терапию доцетакселом 75 мг/м2 и преднизолоном 10 мг. После восьми курсов химиотерапии наблюдалось снижение ПСА до 1,57 нг/мл к декабрю 2016 г. Пациент был оставлен на андрогендепривационной терапии. В октябре 2017 г. показатель ПСА вновь начал увеличиваться. В феврале 2018 г. была начата терапия энзалутамидом, которая продолжалась до августа 2019 г. По достижении уровня ПСА 565 нг/мл пациента перевели на терапию кабазитакселом.
Кабазитаксел назначали в дозе 25 мг/м2 с поддержкой колониестимулирующими факторами. Проведено восемь курсов терапии с последующим применением только андрогендепривационной терапии. К моменту окончания терапии, в начале февраля 2020 г., уровень ПСА снизился с 565 до 100 нг/мл. В мае ПСА составил 31 нг/мл, в августе – 8 нг/мл. С сентября 2020 г. вновь зафиксирован рост показателя ПСА. Пациенту назначили абиратерон (рис. 1–3).
Обсуждение
В мае 2015 г. у пациента в возрасте 66 лет диагностирован первичный диссеминированный РПЖ с большим объемом поражения по критериям CHARTED, высокой суммой баллов по шкале Глисона и крайне высоким уровнем ПСА – 4287 нг/мл, а также другими лабораторными отклонениями (увеличение щелочной фосфатазы, снижение гемоглобина, гематокрита, общего кальция, общего белка), ассоциированными с неблагоприятным прогнозом. Пациенту назначили терапию в режиме максимальной андрогенной блокады. На сегодняшний день данный режим нельзя назвать оптимальным. В клинических рекомендациях NCCN-2020 в качестве предпочтительных режимов указаны андрогендепривационная терапия в комбинации с апалутамидом, или абиратероном, или доцетакселом, или энзалутамидом. В качестве возможной опции рассматривается также только андрогендепривационная терапия [10], которая оставалась мировым стандартом лечения на протяжении многих десятилетий.
В ряде анализов показано, что добавление антиандрогенов первого поколения к андрогендепривационной терапии не дает очевидных преимуществ, а ведет к увеличению токсичности [11]. Сегодня максимальная андрогенная блокада не входит в клинические рекомендации [12]. Но у данного пациента такой режим ожидаемо привел к улучшению состояния, лабораторных показателей и снижению показателя ПСА до 1,9 нг/мл.
По данным исследования SWOG9346, уровень ПСА в течение семи месяцев после кастрации является важнейшим прогностическим фактором, определяющим продолжительность жизни больного. При снижении уровня ПСА менее 0,2 нг/мл медиана продолжительности жизни составляет 75 месяцев, при снижении до 0,2–4 нг/мл – 44 месяца, при уровне ПСА более 4 нг/мл – всего 13 месяцев [13]. Через год терапии в режиме максимальной андрогенной блокады у пациента развилась гормонорезистентность, что согласуется с имеющимися данными [14]. Пациенту была назначена терапия доцетакселом с хорошим ответом в течение 17 месяцев со снижением ПСА до 0,4 нг/мл.
Доцетаксел – препарат, изменивший подход к лечению РПЖ, продемонстрировал достоверные преимущества перед митоксантроном и преднизолоном в сравнительном исследовании 2004 г. [6]. Применение доцетаксела после развития гормонорезистентности вполне оправданно.
Вопрос выбора оптимальной последовательности терапии остается открытым, но опции немногочисленны. В международном многоцентровом ретроспективном анализе CATS Database не зафиксировано отличий в отношении выживаемости без прогрессирования, общей выживаемости и ответа ПСА между группами с последовательностью терапии «доцетаксел → кабазитаксел → антиандроген» и «доцетаксел → антиандроген → кабазитаксел» [15].
Следующим этапом стало использование энзалутамида – препарата, относящегося к группе антиандрогенов нового поколения, наравне с апалутамидом и абиратероном. Появление антиандрогенов нового поколения абиратерона, энзалутамида, а впоследствии апалутамида значительно расширило возможности терапии. Выбор конкретного препарата данной группы может основываться на сопутствующей патологии, профиле токсичности и доступности, а также предпочтениях врача.
Назначение нашему пациенту в сентябре 2019 г. кабазитаксела способствовало клиническому улучшению, снижению ПСА с 565 до 8 нг/мл. Выживаемость без прогрессирования после начала применения кабазитаксела составила 11 месяцев. Это очень хороший результат для пациента, получившего в анамнезе несколько линий терапии, включая доцетаксел и антиандрогены нового поколения. В многоцентровом рандомизированном исследовании CARD сравнивали эффективность кабазитаксела, абиратерона/энзалутамида у пациентов с метастатическим кастрационно-резистентным раком, у которых заболевание прогрессировало в течение 12 месяцев на фоне предшествующего лечения антиандрогенами нового поколения до или после использования доцетаксела. Эффективность кабазитаксела превысила эффективность абиратерона/энзалутамида. Выживаемость без прогрессирования составила 4,4 и 2,7 месяца, а общая выживаемость – 13,6 и 11,0 месяца соответственно. Первичной конечной точкой была выживаемость без прогрессирования: преимущество также продемонстрировал кабазитаксел – 8,0 и 3,7 месяца соответственно. Преимущество было достигнуто во всех заранее спланированных группах независимо от возраста, характера метастазирования, предшествующей терапии и типа прогрессирования [16]. На основании результатов исследования кабазитаксел включен в Европейские рекомендации по лечению метастатического кастрационно-резистентного РПЖ после доцетаксела и первой линии нового антиандрогена [17].
Несмотря на значительную предлеченность нашего пациента, в целом переносимость кабазитаксела была удовлетворительной. Отмечались нейтропения до 2-й степени, анемия 1-й степени, слабость 1-й степени, постинъекционный тромбофлебит. Снижения доз или модификации режима введения не потребовалось.
Заключение
Несмотря на появление новых препаратов, возможности терапии метастатического кастрационно-резистентного рака предстательной железы остаются ограниченными. Кабазитаксел, будучи эффективным препаратом с удовлетворительной переносимостью, может быть рекомендован в первой и последующих линиях лечения метастатического кастрационно-резистентного рака после использования доцетаксела. В случае терапии с применением антиандрогенов нового поколения предпочтение отдают кабазитакселу.
D.M. Ponomarenko, D.Yu. Yukalchuk, Yu.A. Chapigina, Ye.V. Snetkov, A.M. Novopashin, G.N. Tepikina
Irkutsk Regional Oncological Dispensary
Irkutsk State Medical Academy of Postgraduate Education
Irkutsk Regional AIDS Center
Contact person: Dmitry M. Ponomarenko, ponomarenkodm@gmail.com
The article discusses the use of cabazitaxel in the significantly pretreated patient with castration-resistant prostate cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.