Хроническая сердечная недостаточность и функциональное состояние почек
- Аннотация
- Статья
- Ссылки




Высокая значимость этих ассоциаций подтверждается созданием национальным Институтом сердца, легких и крови (США) рабочей группы (Working Group on Cardio-Renal Connections in Heart Failure by the National Heart, Lung and Blood) по кардиоренальным взаимодействиям при сердечной недостаточности в августе 2004 года (1, 2).
По данным de Silva, только у 7% из 1216 больных со стабильной хронической сердечной недостаточностью (ХСН) расчетная скорость клубочковой фильтрации (СКФ) была в пределах нормальных значений, а у большинства пациентов (83%) была диагностирована 2 или 3 стадия хронической болезни почек (ХБП) (3).
Ранее считалось, что ведущим этиологическим фактором развития почечной дисфункции при ХСН является гипоперфузия почечной паренхимы, однако исследование ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Catheterization Effectiveness) не выявило связи между показателями центральной гемодинамики и уровнем сывороточного креатинина (4). Для состояния сердечной недостаточности характерны также нейрогормональные нарушения в виде повышения продукции вазоконстрикторов (адреналина, ангиотензина, эндотелина) и изменения чувствительности и/или высвобождения эндогенных вазодилататоров (натрийуретических пептидов, оксида азота). При этом несмотря на снижение почечного кровотока, повышается почечное перфузионное давление, повреждается базальная мембрана клубочка и развивается микроальбуминурия (МАУ), протеинурия и нефросклероз. Кроме того, функциональное состояние почек также может ухудшаться вследствие таких сопутствующих заболеваний, как артериальная гипертония (АГ) и сахарный диабет (СД) 2 типа, а также терапии ХСН – предполагается роль гиповолемии, связанной с увеличением диуреза, ранней блокады РААС, гипотонии, связанной с приемом препаратов (5-7).
По современным представлениям, сочетание хронической сердечной патологии (ХСН) и длительно существующего снижения функциональной способности почек и/или имеющихся признаков повреждения почек (ХБП) соответствует второму типу кардиоренального синдрома (КРС) и приводит к ускоренному снижению функциональной способности каждого из органов, ремоделированию миокарда, сосудистой стенки и почечной ткани, росту заболеваемости и смертности (8, 9).
В последнее время возрастает интерес к патогенетической роли относительного или абсолютного дефицита эритропоэтина, который приводит к развитию анемии у пациентов с ХСН и ХБП, при этом выраженность ее нельзя объяснить только снижением функции почек (10). По данным некоторых клинических исследований, назначение эритропоэз-стимулирующих препаратов пациентам с ХСН, ХБП и анемией приводит к улучшению качества жизни, функционального состояния сердца, уменьшению размеров ЛЖ и снижению уровня мозгового натрийуретического пептида. В то же время возможность применения их в этой популяции больных вызывает большие сомнения, поскольку связано с увеличением риска сердечно-сосудистых осложнений (11-15).
Учитывая, что до недавнего времени пациенты с ХСН и выраженным нарушением функции почек практически не включались в крупные рандомизированные исследования, а также рост этой популяции больных, необходимо проведение контролируемых научных исследований, которые позволят улучшить прогноз, снизить заболеваемость и смертность для такой часто встречающейся и тяжелой сочетанной патологии.
Материал и методы
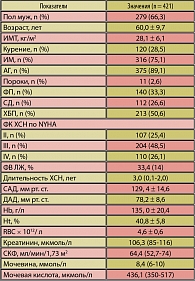
На базе терапевтических и кардиологических отделений ГКБ №64 г. Москвы был проведен ретроспективный анализ историй болезни 421 пациента с ХСН II-IV ФК и систолической дисфункцией в стадии компенсации, средний возраст которых составил 60,0 ± 9,7 года (таблица 1). Женщин было 142 (43,7%), мужчин – 279 (66,3%). Средняя длительность течения ХСН составила 3,0 (0,1-2,0) года. Наиболее частыми причинами развития ХСН были перенесенный инфаркт миокарда (75,1%) и ГБ (89,1%). У половины больных имелась ХБП (50,6%), которая диагностировалась по критериям K/DOQI. Более 26% страдали СД 2 типа, нарушение ритма сердца по типу фибрилляции предсердий имели 33,3% пациентов. Чаще всего встречался III ФК ХСН (48,5%), реже – II ФК (25,4%) и IV ФК – у 26,1% больных. Все пациенты получали стандартную терапию ХСН: ингибиторы ангиотензин-превращающего фермента (АПФ) 370 (87,9%), блокаторы рецепторов ангиотензина II (БРА) 18 (4,3%) пациентов, b-блокаторы – 363 (86,2%), a-, b-блокаторы – 58 (13,8%), тиазидовые диуретики – 212 (50,4%), антагонисты альдостерона – 226 (53,7%).
Всем пациентам выполнялось стандартное клинико-лабораторное обследование, СКФ рассчитывали по формуле МDRD, которая в среднем по группе составила 64,4 (52,7-74) мл/мин/1,73 м2.
Результаты обработаны статистически с использованием критерия t Стьюдента, проводился однофакторный корреляционный анализ. Использовали компьютерную программу Statistica for Windows 6,0. Показатели представлены как М ± SЕ. Различия достоверны при р < 0,05.
Результаты и обсуждение
Средний уровень СКФ у пациентов с ХСН составил 64,4 (52,7-74,0) мл/мин/1,73 м2. Стойкое снижение СКФ менее 60 мл/мин/1,73 м2 (III стадия ХБП) зафиксировано у 41% (174) пациентов.
Для оценки изучаемых показателей в зависимости от уровня СКФ больные делились на две группы: I группа – уровень СКФ < 60 мл/мин/1,73 м2 (n = 183), II группа – СКФ > 60 мл/мин/1,73 м2 (n = 228). Клинико-демографическая характеристика пациентов в зависимости от уровня СКФ представлена в таблице 2.
Группы были сопоставимы по частоте ИМ в анамнезе и частоте выявления ФП. В группе пациентов со СКФ ниже 60 мл/мин/1,73 м2 преобладали больные более старшего возраста, чаще встречались АГ и СД, преимущественно у женщин, в этой же группе достоверно чаще выявлялась анемия.
Показатели СКФ обратно коррелировали с частотой выявления анемии (R = -0,2; р = 0,04), прямо коррелировали со значениями гемоглобина (R = 0,4; р < 0,001) и гематокрита (R = 0,5; р = 0,002).
При проведении множественного регрессионного анализа было выявлено, что частота выявления анемии зависит от уровня СКФ (beta = 0,178, р < 0,0001).
Таким образом, при снижении СКФ частота анемии увеличивалась, достигая 65% при СКФ < 30 мл/мин/1,73 м2 (таблица 3).
Достоверно различались группы по II и IV ФК ХСН по NYHA, как видно из таблицы 4. При СКФ менее 60 мл/мин/1,73 м2 чаще встречался IV ФК ХСН (р = 0,01), отмечалась тенденция к увеличению частоты III ФК ХСН (р = 0,06).
Таким образом, при повышении ФК по NYHA достоверно снижалась СКФ. Однако показатели СКФ не зависели от длительности ХСН (р = 0,4) и ФВ ЛЖ (р = 0,1). Это может быть обусловлено тем, что мы исследовали пациентов с ФВ ЛЖ менее 45% и средней СКФ 64,4 (52,7-74,0) мл/мин/1,73 м2, т.е. группы были достаточно однородны.
В группе со СКФ < 60 мл/мин/1,73 м2 значения гемоглобина (р < 0,001), гематокрита (р < 0,001) и количество эритроцитов (р < 0,001) были достоверно ниже (таблица 5).
Средние значения мочевины и мочевой кислоты были достоверно выше у больных с более выраженным снижением СКФ (р < 0,001). Анализ не выявил различий по уровню электролитов, холестерина крови, осмолярности плазмы.
При анализе показателей воспалительного профиля в группе СКФ < 60 мл/мин/1,73 м2 отмечались более высокие показатели СРБ (р = 0,01).
Таким образом, у пациентов со СКФ ниже 60 мл/мин/1,73 м2 чаще выявлялась анемия, а уровни гемоглобина, гематокрита и количество эритроцитов были достоверно ниже, чем в группе со СКФ выше 60 мл/мин/1,73 м2. Для группы со сниженной функциональной способностью почек был характерен более тяжелый ФК ХСН и достоверно более высокие значения СРБ.
Выводы
- В обследованной группе больных с систолической стабильной ХСН (II-IV ФК по NYHA) стойкое снижение СКФ менее 60 мл/мин/1,73 м2, соответствующее третьей стадии ХБП, зафиксировано у 41% (174) пациентов.
- В группе пациентов со СКФ ниже 60 мл/мин/1,73 м2 преобладали больные более старшего возраста и женщины с наличием АГ и СД. У этих больных достоверно чаще выявлялась анемия.
- При снижении СКФ достоверно увеличивался ФК по NYHA, однако связи между величиной СКФ и ФВ ЛЖ выявить не удалось.
- Пациенты со СКФ ниже 60 мл/мин/1,73 м2 отличались более низким уровнем гемоглобина, гематокрита, эритроцитов, более высокими значениями СРБ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


