Клинические рекомендации ACG-2020 по диагностике и лечению хронического панкреатита: обзор ключевых положений в практическом преломлении
- Аннотация
- Статья
- Ссылки
- English
Введение
Два минувших десятилетия с прорывом в генетике и иммунологии, совершенствованием диагностики заболеваний поджелудочной железы (ПЖ) и консолидацией усилий экспертов разных специальностей в создании клинических рекомендаций изменили представления о хроническом панкреатите (ХП). Результаты ряда экспериментальных исследований последних лет позволили переосмыслить патогенез болезни, что способствовало проведению новых рандомизированных клинических исследований (РКИ) при ХП [1].
Наиболее приемлемым вариантом адаптации инновационных научных данных к условиям реальной клинической практики считается создание согласительных документов (гайдлайнов и консенсусов). Следует отметить, что российская гастроэнтерологическая общественность не осталась в стороне и разработала серию важнейших документов [2–4]. Аналогичные клинические рекомендации опубликованы в разных регионах мира. Речь, в частности, идет о панъевропейском консенсусе (HaPanEU, 2017), обобщившем международный опыт [5], международном консенсусе по панкреатиту минимальных изменений [6] и предмете нашего аналитического интереса – недавно вышедших в свет клинических рекомендациях Американского колледжа гастроэнтерологов (American College of Gastroenterology – ACG) [7]. Обновление клинических рекомендаций, основанных на современных научно обоснованных данных, по ключевым аспектам консервативного и хирургического лечения ХП требует анализа и адаптации к российской клинической практике. Данная статья призвана помочь практикующим врачам в повседневной работе.
Этиология и классификация ХП
Ключевое положение: у пациентов с клинической симптоматикой ХП должны быть оценены все возможные факторы риска, что позволит понять механизмы патогенеза и значение изменяемых и неизменяемых факторов риска, определить потенциальные цели для лечения и прогноз заболевания.
РКИ, систематических обзоров и метаанализов очередности проведения исследований для определения этиологии ХП не проводилось [7]. Для классификации этиологических форм ХП целесообразно использовать систему TIGAR-O (T – токсические и метаболические факторы, I – идиопатический, G – генетический/наследственный, A – аутоиммунный, R – рецидивирующий острый или тяжелый панкреатит, O – обструктивный панкреатит) [8]. Эта система доказала свою состоятельность в многочисленных международных исследованиях, отражена в большинстве консенсусных документов, в том числе российских клинических рекомендациях [2], и после недавнего пересмотра дополнена данными, полученными за последние 20 лет [7]. Близкая система классификации M-ANNHEIM рассматривает ХП как заболевание, в большинстве случаев характеризующееся множественными (М – multiple risk factors) факторами риска – потреблением алкоголя (А) и никотина (N), воздействием пищевых (Nutrition) и наследственных (Hereditary) факторов, протоковых изменений с затруднением оттока (E – efferent duct factors), иммунологических (I) факторов, редких метаболических и других (M – miscellaneous) факторов. Кроме того, в данной системе содержится информация об активности и стадии заболевания, которая используется для оценки влияния и взаимодействия различных факторов риска на течение ХП [9]. В панъевропейском консенсусе предусмотрен более строгий подход к выбору этиологической классификации ХП. Эксперты отмечают, что имеющиеся системы классифицирования еще предстоит изучить в рамках РКИ с конечными точками заболеваемости и смертности [5].
Первоначальный подход к обследованию пациентов с подозрением на ХП и связанные с ним заболевания заключается в том, что наряду с лабораторными тестами проводятся тщательный сбор анамнеза и физикальное обследование. История заболевания должна включать предыдущие даты и количество эпизодов острого панкреатита (ОП), дату манифестации сахарного диабета (СД), если он был диагностирован, симптомы мальдигестии и нутритивной недостаточности, в том числе снижение веса, состояние костной системы (например, переломы). Сбор наследственного анамнеза должен распространяться по меньшей мере на родственников третьей степени и включать вопросы о панкреатите, муковисцидозе, СД и раке поджелудочной железы (РПЖ). Необходимо прояснять вопросы, касающиеся потребления алкоголя, курения, приема медицинских препаратов, анализировать потенциальное воздействие диеты и особенности питания, детализировать тип СД, оценивать доступные биомаркеры в сыворотке крови – уровень сывороточного кальция и триглицеридов, жирорастворимых витаминов. Данные методов визуализации также используются для выявления потенциальных причин обструкции протоков ПЖ, в частности анатомических особенностей развития, кальцинатов, опухолей и др. Обязательно рассматриваются дифференциальный диагноз для ХП, включая аутоиммунное воспаление, воспаление и фиброз клеток островков Лангерганса на фоне длительного СД, заболевания почек, вторично влияющие на ПЖ, прием препаратов, воздействующих на иммунную систему (например, циклоспорин), возрастная атрофия или фиброз ПЖ, внутрипротоковые папиллярно-муцинозные неоплазии, цистаденома ацинарных клеток, десмопластическая реакция на неоплазии ПЖ и др. [6, 7]. Следует отметить, что в разделе «Этиология» панъевропейского консенсуса также рекомендуется определять скрытую приверженность алкоголю (например, с помощью вопросника AUDIT) и уровень фосфатидилэтанола в крови [5], при идиопатическом ХП не забывать о возможности аутоиммунного панкреатита (АИП), когда определяются повышенный уровень сывороточного иммуноглобулина (Ig) G4, наличие аутоантител к лактоферрину и карбоангидразе, типичные признаки АИП при использовании методик визуализации [10, 11].
Рекомендация: пациентам, особенно молодого возраста, с клиническими признаками ХП или связанных с ним заболеваний, этиология которых неясна, рекомендуется проведение генетического тестирования (сильная рекомендация, низкий уровень доказательности).
Генетическое тестирование показано в случае неясной этиологии, отягощенного наследственного анамнеза в отношении заболеваний ПЖ, сохранения активности болезни после терапевтического вмешательства (например, рецидивирующий ОП после ревизии желчных протоков), а также в том случае, если возраст пациента менее 35 лет.
За последние 20 лет выявлено несколько генов, связанных с ХП. Однако РКИ, систематических обзоров и метаанализов целесообразности назначения пациентам с идиопатическим ХП генетического тестирования не существует [7]. Для практикующих врачей доступна серия публикаций на русском языке о наследственных факторах ХП [12, 13], что позволило нам подробно не останавливаться на генетических аспектах в данной статье. Наиболее важными генетическими факторами риска являются изменения генов катионного трипсиногена (PRSS1), панкреатического секреторного ингибитора трипсина (SPINK1) и карбоксипептидазы A1 (CPA1). На генетическую предрасположенность указывают также муковисцидозный трансмембранный регулятор проводимости (CFTR), химотрипсиноген C (CTRC) и карбоксиэстролипаза (CEL) [1, 5, 12].
Генетическое тестирование не только позволяет врачу понять патофизиологию болезни, но также дает пациенту возможность планирования семьи и/или проведения генетического обследования его кровных родственников. Кроме того, такое тестирование несет в себе важную прогностическую информацию, например, о необходимости более радикального лечения персистирующего или тяжелого наследственного ХП (тотальная панкреатэктомия) из-за высокого риска развития рака ПЖ. Для пациентов с ХП на продвинутой стадии значение генетического тестирования не так велико, поскольку лежащие в основе ХП воспалительные процессы уже необратимо разрушили ПЖ [7].
Таким образом, пациенты с идиопатическим ХП должны проходить анализ по меньшей мере на мутации генов PRSS1, SPINK1, CFTR и CTRC, хотя существуют расширенные панели диагностики мутаций в более чем десяти генах восприимчивости и генах-модификаторах, генах гипертриглицеридемии, а также для оценки фармакогенетики [7].
Течение и клинические симптомы ХП
Ключевое положение: верификация механизмов, лежащих в основе воспаления ПЖ, необходима для прогноза прогрессирования ХП.
К основным клиническим проявлениям ХП относятся упорные абдоминальные боли, симптомы мальдигестии, нарушения нутритивного статуса с дефицитом жирорастворимых витаминов, остеопорозом, симптомы панкреатогенного СД. На этой стадии заболевание необратимо, профилактика или восстановительная терапия невозможны. РКИ, систематических обзоров и метаанализов, оценивающих особенности клинических проявлений и специфику течения ХП, не проводилось [7].
Накопленные к настоящему времени данные исследований подтверждают, что около 60% случаев ХП развиваются после ОП и рецидивирующих ОП. Вместе с тем только около 10% ОП и 30% рецидивирующих ОП прогрессируют до ХП. В рамках этих исследований основную роль играет этиология: прогрессирование от ОП до ХП при алкогольной этиологии происходит в два раза быстрее, чем при наследственном или идиопатическом ХП, и в пять раз быстрее, чем при билиарном ОП [14]. АИП может характеризоваться ярким воспалением с быстрой индукцией необратимого фиброза и панкреатической недостаточности [11].
Ранее предполагалось, что интенсивность абдоминальной боли при ХП, особенно у пациентов с алкогольным генезом заболевания, со временем снижается [15]. Тем не менее эта гипотеза в последующих наблюдательных когортных исследованиях не подтвердилась. Было установлено, что боль при ХП не исчезает и «не выгорает» с течением времени [16].
Дефицит жирорастворимых витаминов, обусловленный сокращением объема принимаемой пищи из-за постпрандиального усиления боли в животе и мальабсорбции вследствие сниженной выработки ферментов ПЖ, наблюдается у незначительной части пациентов с ХП. РКИ, систематических обзоров и метаанализов, оценивающих этиологию ХП и развитие дефицита жирорастворимых витаминов, не проводилось [7]. В нескольких крупных исследованиях показано, что распространенность внешнесекреторной недостаточности ПЖ (ВНПЖ) колеблется от 40 до 75% [17, 18]. Риск ВНПЖ наиболее высок у лиц с ХП, вызванным употреблением алкоголя и/или табакокурением, а также при фиброкалькулезном (тропическом) панкреатите [7].
Риск развития аденокарциномы ПЖ у пациентов с ХП выше, чем в общей популяции, но, вероятно, намного ниже, чем сообщалось ранее. Последние данные свидетельствуют о том, что у пациентов с адекватно оцененными вариантами полиморфизма генов, позволяющими отнести их к группе риска ХП, риск развития аденокарциномы ПЖ в течение жизни составляет от 5 до 10% [19].
Ключевое положение: развитие СД при ХП скорее всего связано с продолжительностью болезни, хотя другие этиологические факторы, такие как индекс массы тела и табакокурение, могут повышать данный риск.
Связь между риском развития эндокринной недостаточности ПЖ (СД типа 3c) и какой-либо этиологией ХП не установлена [20]. Наиболее важным фактором риска, вероятно, является длительность течения ХП. Табакокурение также способно вносить вклад в развитие СД [21, 22]. РКИ, систематических обзоров и метаанализов, оценивающих риск развития эндокринной недостаточности ПЖ у пациентов с ХП, не проводилось. Пациенты с ожирением чаще имеют СД 2-го типа, а у лиц с прогрессирующим ХП из-за уменьшения количества островковых клеток обычно наблюдаются низкий индекс массы тела и СД типа 3c. Впервые выявленный СД на фоне снижения массы тела является потенциальным симптомом протоковой аденокарциномы ПЖ [23].
Диагностика ХП
Рекомендация: в диагностике ХП рекомендуется использовать компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ) как метод первой линии. Эндоскопическая ультрасонография (ЭУС) ввиду инвазивности и низкой специфичности должна применяться только в том случае, если после проведения перекрестной визуализации диагноз остался неуточненным (сильная рекомендация, низкий уровень доказательности).
Верификация ХП остается сложной задачей, поскольку до сих пор не определен золотой стандарт установления диагноза. Нередко диагноз устанавливают на поздней стадии длительно существующего повреждения паренхимы и протоков ПЖ, которое приводит к необратимым морфологическим изменениям и становится причиной различных клинических проявлений. У пациентов с типичными клиническими симптомами воспалительных изменений ПЖ (например, перенесенный ранее эпизод ОП, наличие характерной боли и/или мальдигестии) с известными генетическими факторами и/или факторами риска окружающей среды при диагностике ХП в первую очередь должна использоваться именно КТ/МРТ в силу повсеместной доступности, воспроизводимости и более высокой информативности по сравнению с другими методами визуализации. Инвазивность и существенно меньшая доступность ЭУС, а также необходимость применения специфичных диагностических критериев позволяют рекомендовать ЭУС для диагностики ХП, только если диагноз не подтвержден после КТ/МРТ-диагностики [7].
РКИ, посвященных сравнению диагностической точности КТ/МРТ и ЭУС в целях верификации ХП, не проводилось. Это объясняется тем, что тестовые характеристики диагностических исследований обычно невыполнимы в рамках РКИ. Наиболее убедительные доказательные данные получены при проведении систематического обзора и метаанализа 43 исследований, включивших 3460 пациентов с предполагаемым ХП. Так, чувствительность ЭУС, МРТ и КТ достоверно не отличалась [24]: 81% (95%-й доверительный интервал (ДИ) 70–89), 78% (95% ДИ 69–85), 75% (95% ДИ 66–83) соответственно.
Специфичность для ЭУС (90%; 95% ДИ 82–95), ЭРХПГ (94%; 95% ДИ 87–98), КТ (91%; 95% ДИ 81–96), МРТ (96%; 95% ДИ 90–98) и трансабдоминального ультразвукового исследования (т-УЗИ) (98%; 95% ДИ 89–100) была также сопоставима [24]. Этот метаанализ имел некоторые ограничения, поскольку не во всех исследованиях проводился морфологический анализ в качестве золотого стандарта определения типа воспаления для сравнения результатов.
Следует также отметить, что ЭРХПГ сегодня не рассматривается в качестве диагностического исследования при ХП ввиду значимой инвазивности, локальной малодоступности, высокой стоимости [2, 5]. Результаты метаанализа согласуются с положениями ранее опубликованных немецких клинических рекомендаций S3 [25].
Критерии ХП подразделяют на паренхиматозные и протоковые. Для постановки диагноза ХП обычно используется пороговая сумма из трех-четырех критериев. Поскольку не все критерии одинаково важны, классификация Rosemont предлагает конкретные критерии ЭУС для верификации ХП с указанием их специфической достоверности [26]. По сравнению с гистологическим исследованием, используемым в качестве золотого стандарта, чувствительность ЭУС при диагностике ХП превышала 80%, а специфичность достигала 100% [27].
Для установления диагноза ХП применяются и другие методы визуализации и системы оценки, включая ЭУС с контрастным усилением, ЭРХПГ, т-УЗИ и эластографию ПЖ. Однако качественных РКИ, результаты которых позволили бы отнести перечисленные исследования к методам диагностики ХП первой линии вместо КТ/МРТ или ЭУС, не существует [7].
Как правило, т-УЗИ органов брюшной полости является первым методом визуализации, применяемым у пациентов с болями в животе и при подозрении на ХП. Эта методика доступна в большинстве учреждений, в том числе для повторных исследований. Риски, присущие другим методам визуализации (рентгеновское облучение и/или контрастные вещества), у данной методики отсутствуют. Чувствительность и специфичность УЗИ (67/98%) ниже таковых КТ (75/91%) и ЭУС (82/91%), что обусловлено зависимостью результатов т-УЗИ от опыта и знаний врача-диагноста, а также затрудненной визуализацией ПЖ при ожирении, метеоризме и др. [28]. Кроме того, т-УЗИ может эффективно использоваться для визуализации осложнений ХП, таких как скопление жидкости, псевдокисты, обострение ХП и псевдоаневризмы. РКИ, посвященные сравнению т-УЗИ и других методов визуализации, отсутствуют. Под контролем этого метода также можно проводить диагностические и терапевтические вмешательства на ПЖ (биопсия, дренирование) [29].
ЭУС с контрастированием способна повысить диагностическую точность у пациентов с ХП с кистозными и солидными очагами в ПЖ [5]. Стандартный В-режим не позволяет дифференцировать псевдотуморозный ХП от рака ПЖ. При контрастировании протоковая аденокарцинома обычно гипоэхогенна в артериальной фазе из-за ее слабой васкуляризации, тогда как очаговый ХП обычно демонстрирует контрастное усиление, аналогичное тому, которое наблюдается в окружающей паренхиме ПЖ [30]. При ХП с длительным анамнезом может иметь место гетерогенная гиповаскуляризация вследствие фиброза, что значительно затрудняет дифференциальную диагностику с раком ПЖ [31].
Таким образом, методы визуализации способны заменить морфологическое исследование. Типичные морфологические изменения в ПЖ – важный компонент диагностики ХП. В отсутствие общепринятого золотого стандарта диагностики ХП и при наличии сложностей с проведением высококачественного и репрезентативного морфологического исследования КТ/МРТ являются для большинства врачей привычным методом и должны использоваться в качестве первичного исследования для диагностики ХП. ЭУС целесообразно проводить, если после КТ/МРТ диагноз остается под вопросом или предполагается «ХП с минимальными изменениями» (ХП без признаков фиброза), который не может быть визуализирован при КТ/МРТ. Поэтому диагностика ХП продолжает базироваться на клинической оценке в сочетании с данными анамнеза заболевания, наличием факторов риска и исключением других заболеваний при дифференциально-диагностическом поиске.
Рекомендация: проводить секретин-стимулированную магнитно-резонансную холангиопанкреатографию (s-МРХПГ) рекомендуется, когда диагноз ХП после КТ/МРТ или ЭУС не подтвержден, но высоковероятен исходя из клинических данных (условная рекомендация, низкий уровень доказательности).
s-МРХПГ позволяет лучше визуализировать главный и боковые протоки ПЖ за счет стимулирования секреции бикарбонатов протоковым эпителием. Данное явление позволяет также количественно оценить степень заполнения двенадцатиперстной кишки секретом, которая в свою очередь может коррелировать с тяжестью ХП и степенью ВНПЖ [5]. Более качественная визуализация главного панкреатического протока и патологически измененных боковых ветвей по сравнению с МРХПГ без контрастирования увеличивает чувствительность диагностики ХП с 77 до 89% [32]. Однако с учетом высокой стоимости метода s-МРХПГ применяют только в том случае, если диагноз не подтвержден при использовании методов диагностики первой линии. РКИ, прицельно оценивающие роль s-МРХПГ в диагностике ХП, отсутствуют. Проведены один систематический обзор [33], исследование у детей с идиопатическим ХП [34], а также оценка экзокринной функции ПЖ при подозрении на ХП с минимальными изменениями [35]. К сожалению, в России пока секретин недоступен в клинической практике, что позволяет рассматривать данную технологию как перспективную.
Рекомендация: проведение гистологического исследования у пациентов с высоким риском развития ХП предлагается в качестве золотого стандарта диагностики, когда клинические данные и исследования функции ПЖ убедительны, но данные визуализирующих методов исследования не позволяют установить диагноз ХП (условная рекомендация, очень низкий уровень доказательности).
Когда ХП не может быть верифицирован на основании диагностических критериев КТ/МРТ или ЭУС, рассматривают возможность проведения гистологического исследования биоптата ПЖ. Более безопасное и технически менее сложное выполнение биопсии ПЖ для гистологического исследования стало возможным благодаря распространению тонкоигольной биопсии при ЭУС. Однако чувствительность гистологического исследования для диагностики ХП по сравнению с оценкой визуализирующих методов крайне низка. Верификация диагноза ХП по данным гистологического исследования может быть недостоверна из-за технических погрешностей и осложнений при заборе биопсийного образца, неоднородности воспалительных и фиброзных изменений в ПЖ и субъективной интерпретации результатов морфологом при оценке биоптата [7].
РКИ, систематических обзоров и метаанализов, оценивающих достоверность гистологического исследования в качестве золотого стандарта диагностики ХП, не проводилось. Тем не менее возможность гистологического исследования необходимо рассматривать только у пациентов с высоким риском ХП после того, как клинические, функциональные и визуализационные исследования не подтвердили диагноз и пациент после всестороннего обсуждения с лечащим врачом целей и рисков процедуры дал информированное согласие на проведение биопсии ПЖ [7]. Наиболее информативным и диагностически ценным при верификации АИП и РПЖ остается гистологическое исследование [11].
Ключевое положение: данных о том, что проведение скрининга пациентов с ХП для выявления злокачественных новообразований ПЖ обоснованно, недостаточно.
Качественных данных, подтверждающих обоснованное проведение скрининга злокачественных опухолей ПЖ у всех пациентов, даже с высоким риском развития РПЖ и доказанными генетическими факторами или факторами риска окружающей среды, крайне мало. Несмотря на то что общая распространенность злокачественных новообразований ПЖ у пациентов с ХП выше, РКИ, систематические обзоры и метаанализы обоснованности скрининга злокачественных новообразований ПЖ в этой популяции не проводились [7].
Диагностика ВНПЖ
Ключевое положение: определение функции ПЖ – важный элемент диагностики ВНПЖ, однако ее роль в установлении диагноза ХП является дополнительной.
Каждый пациент с впервые установленным диагнозом ХП должен быть обследован на ВНПЖ. Даже при убедительных морфологических признаках ХП клинические симптомы ВНПЖ не всегда проявляются в момент постановки диагноза, а отсутствие симптомов не позволяет достоверно исключить экзокринную недостаточность [4]. Низкая чувствительность функциональных тестов для верификации ХП частично связана с большим функциональным резервом ПЖ, когда только значительная потеря функции (обычно > 90%) приводит к клинически очевидным проявлениям, таким как стеаторея и потеря азота с калом, а также дефициту витаминов. Однако у ряда пациентов единственным клиническим проявлением поражения панкреатических экзокринных клеток может быть ВНПЖ, и, конечно, с прогрессированием заболевания степень ВНПЖ может увеличиваться [7]. При этом у пациентов с «компенсированной» ВНПЖ также повышен риск мальнутриции (в частности, жирорастворимых витаминов с соответствующими клиническими последствиями) [5]. Так, при сокращении жира в рационе стеаторея может не наблюдаться [36], поэтому снижение абсорбции жирорастворимых витаминов возможно и в отсутствие стеатореи при легкой и умеренной ВНПЖ [37].
РКИ, систематических обзоров и метаанализов, которые подробно описывали бы применение функциональных тестов ПЖ для диагностики ХП, не существует. Исходя из имеющихся данных, определение функции ПЖ при диагностике ХП должно использоваться только в качестве вспомогательного теста [7].
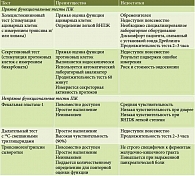
Тесты оценки функции ПЖ исторически подразделяются на прямые и непрямые. Тип используемого теста зависит от клинической доступности, опыта врачей, переносимости теста пациентом, затрат (таблица) [38, 39].
Оценка распространенности ВНПЖ затруднена, поскольку в исследованиях используются различные методы и стандарты ее диагностики. Коэффициент абсорбции жира (КАЖ) считается золотым стандартом для диагностики стеатореи при тяжелой ВНПЖ и единственным тестом, утвержденным Управлением США по контролю за пищевыми продуктами и лекарственными средствами (Food and Drug Administration, FDA) и Европейским медицинским агентством для диагностики и динамического контроля эффективности заместительной ферментной терапии в клинических исследованиях [5]. Тем не менее в большинстве исследований в качестве первичного диагностического теста ориентируются на наличие стеатореи либо снижение уровней фекальной эластазы. Ни один из методов не относится к высокоточным и, вероятно, не будет достаточно чувствителен к появлению клинически значимой мальдигестии. Чаще на практике определяют уровень фекальной эластазы. Однако необходимо учитывать несколько важных моментов. Точность диагностики ВНПЖ с помощью фекальной эластазы зависит от выбранной нижней границы нормы. В некоторых исследованиях как маркер ВНПЖ использовался уровень эластазы < 200 мкг/г, но этот уровень ассоциируется с высокой вероятностью ложноположительных результатов. Снижение уровня фекальной эластазы < 100 мкг/г имеет более высокую специфичность, но более низкую чувствительность [40, 41]. Тесты на сывороточный трипсин и/или трипсиноген применялись ранее, однако в настоящее время не применяются из-за плохой корреляции с результатами визуализирующих методов обследования [7].
Дыхательный тест с 13С-смешанными триглицеридами служит альтернативой тесту на КАЖ – как для диагностики ВНПЖ, так и для оценки эффективности терапии панкреатином в клинической практике, а новые модификации теста могут выявлять легкую и умеренную ВНПЖ. Однако и этот тест имеет ограничения, касающиеся специфичности (ложноположительные результаты при непанкреатической мальабсорбции жира) [42]. Кроме того, он недоступен повсеместно и коммерциализирован только в нескольких европейских странах. В России недоступен из-за отсутствия субстрата для теста (меченых триглицеридов).
Только прямые тесты, требующие забора дуоденального сока в ответ на гормональную стимуляцию (секретином и/или холецистокинином), позволяют количественно оценивать экзокринную секрецию ПЖ и надежно определять наличие ВНПЖ легкой или умеренной степени. На основании этого они и были приняты в качестве стандарта [25]. Ранее эти тесты выполнялись путем введения назодуоденального зонда, хотя уже разработаны и эндоскопические варианты процедуры, которым в настоящее время отдается предпочтение в США и некоторых европейских странах [43]. Однако независимо от того, какой конкретно метод используется для забора секрета двенадцатиперстной кишки, само обследование является инвазивным, трудоемким и дорогостоящим. Выполняется только в специализированных центрах.
Ключевое положение: пациентам с ХП следует периодически проводить оценку нутритивного статуса, в том числе исследования на остеопороз и дефицит жирорастворимых витаминов.
Пациенты с ХП подвержены риску дефицита жирорастворимых витаминов, а также цинка и магния независимо от того, диагностирована ли у них ВНПЖ [44, 45]. Степень отклонения уровней витаминов и микроэлементов от нормы, вероятно, коррелирует со степенью ВНПЖ. РКИ, систематических обзоров и метаанализов влияния диагностики этих состояний на важные клинические исходы у пациентов с ХП не существует. Не проводились и оригинальные исследования, которые позволили бы оценить роль изменения диеты исключительно при ХП [7]. Нутритивный статус при ХП оценивают часто. Однако РКИ, систематические обзоры и метаанализы, которые представили бы данные по указанной тактике, отсутствуют. Опубликовано несколько одноцентровых исследований, продемонстрировавших, что у пациентов с ХП повышен риск остеопороза и, как следствие, переломов [46–48]. В РКИ сравнивали эффективность внутримышечного и перорального применения витамина D для лечения его дефицита при ХП. Установлено, что внутримышечное введение более эффективно [49].
Рекомендации ACG поддерживают регламентированный панъевропейским консенсусом подход к проведению анализов на доказанные маркеры мальнутриции в качестве дополнительного метода выявления ВНПЖ: преальбумин, ретинол-связывающий белок, 25(ОН) холекальциферол (витамин D) и минералы/микроэлементы (включая сывороточное железо, цинк и магний) [5]. Это согласуется с позицией российских специалистов [1–4, 49–52]. Справедливости ради отметим, что мальнутриция (истощение), вызванная ВНПЖ, не отличается от нарушения питания вследствие других причин, что определяет отсутствие строго специфичных маркеров панкреатогенной мальнутриции [53].
Модификация образа жизни
Рекомендация: пациентам с ХП рекомендуется отказаться от употребления алкоголя (сильная рекомендация, очень низкий уровень доказательности).
РКИ, систематических обзоров и метаанализов, которые оценили бы, влияет ли прекращение употребления алкоголя на развитие и течение абдоминальной боли при ХП, не существует. Тем не менее в нескольких исследованиях «случай – контроль» высказывалось предположение, что прекращение употребления алкоголя уменьшает боль при ХП, но не обязательно замедляет развитие эндокринной или экзокринной недостаточности [54, 55]. Результаты одного РКИ показали, что психологическое консультирование в целях прекращения употребления алкоголя пациентов с приступом алкогольного ОП способно уменьшить количество последующих госпитализаций и приступов боли [56]. Таким образом, пациентам с ХП рекомендуется отказаться от употребления алкоголя, хотя степень, в которой подобный отказ изменяет развитие и течение ХП, неизвестна [7].
Рекомендация: пациентам с ХП рекомендуется отказаться от табакокурения (сильная рекомендация, очень низкий уровень доказательности).
Больным ХП отказаться от курения очень сложно [7]. Бытует мнение, что курение табака является фактором риска развития ХП [57]. Между тем в пользу этого свидетельствуют только результаты одноцентровых исследований [23]. Имеются данные, что клинический эффект долгосрочного отказа от курения низок [7]. РКИ, систематические обзоры и метаанализы, оценивающие, является ли прекращение курения фактором, замедляющим развитие и течение ХП, отсутствуют. Вместе с тем в нескольких исследованиях «случай – контроль» прогрессирование кальцифицирующего панкреатита замедлялось, когда пациенты отказывались от курения сразу после диагностики ХП [58]. Несмотря на то что доказательства эффекта отказа от табакокурения низкого уровня, строгий отказ от курения должен быть краеугольным камнем любой программы лечения пациентов с ХП.
Лечение боли при ХП
Ключевое положение: выполнение плановых интервенционных вмешательств у пациентов, которые продолжают злоупотреблять алкоголем, следует рассматривать с особой осторожностью. Неотложные или экстренные оперативные вмешательства при осложнениях ХП должны рассматриваться отдельно.
РКИ, систематических обзоров и метаанализов, которые могли бы дать четкие рекомендации по этому вопросу практикующим специалистам, не проводилось. Логично предположить, что пациентам, которые активно наносят себе вред и утяжеляют степень ХП, постоянно злоупотребляя алкоголем, проводить агрессивные эндоскопические или хирургические вмешательства, потенциально требующие повторных операций, опрометчиво. Однако с социальной точки зрения пациенты с ХП, которые продолжают употреблять алкоголь после соответствующего обучения, все еще должны получать медицинскую помощь. Им рекомендовано отказаться от употребления алкоголя с помощью психологического консультирования и/или других программ. Неотложные вмешательства у пациентов, продолжающих употреблять алкоголь, должны выполняться [7].
Рекомендация: хирургическое лечение пациентам с обструктивным (кальцифицирующим) ХП для долгосрочного купирования боли рекомендуется, если эндоскопические подходы к дренированию главного протока ПЖ были исчерпаны или не увенчались успехом (сильная рекомендация, умеренный уровень доказательности).
Пациентам с симптомами обструкции вирсунгова протока целесообразно выполнять его эндоскопическую декомпрессию посредством ЭРХПГ и/или под контролем ЭУС в качестве метода лечения первой линии. Хирургическое вмешательство проводят, если попытки эндоскопического лечения не увенчались успехом или пациенты возражают против многочисленных попыток эндоскопического лечения, если декомпрессия протоковой системы ПЖ считается только потенциально успешной. Решение об использовании того или иного метода декомпрессии, в том числе литотрипсии, должно приниматься врачом-эндоскопистом исходя из локального опыта [7].
Рекомендация: антиоксидантная терапия, назначаемая больным ХП с абдоминальной болью, малоэффективна (условная рекомендация, умеренный уровень доказательности).
Эффективность антиоксидантной терапии (комбинированные препараты, содержащие селен, аскорбиновую кислоту, бета-каротин и метионин и др.) при боли на фоне ХП оценивали в нескольких исследованиях. Точный механизм, с помощью которого эти препараты могут снижать интенсивность боли, не до конца изучен. Согласно существующим теориям, антиоксиданты уменьшают выраженность окислительного стресса и оказывают противовоспалительное действие. Тем не менее использование антиоксидантов при панкреатической боли не одобрено FDA, а оптимальная комбинация и доза антиоксидантов исходя из результатов предыдущих исследований не определены [7].
Ключевое положение: опиоидные анальгетики могут рассматриваться для лечения боли на фоне ХП только у пациентов, у которых другие возможные терапевтические опции исчерпаны.
С учетом риска развития зависимости, злоупотребления и толерантности назначения опиатов для купирования боли у пациентов с ХП следует избегать. Применение опиатов оправданно, только если другие способы купирования боли неэффективны [7].
Рекомендация: не рекомендуется использовать заместительную ферментную терапию (ЗФТ) для уменьшения боли при ХП (условная рекомендация, низкий уровень доказательности).
Больным ХП часто назначают ЗФТ, обычно для лечения ВНПЖ с клиническими проявлениями. Несмотря на то что эффективность лечения ВНПЖ с помощью ЗФТ описана, роль ферментных препаратов в лечении боли менее ясна. В 2009 г. в Кокрейновском обзоре было оценено десять РКИ, включавших 361 пациента. Помимо снижения интенсивности болевого синдрома в исследовании оценивали другие данные. Тем не менее анализ показал двусмысленный результат в отношении использования ферментов для лечения боли. Авторы пришли к заключению о недостаточном качестве исследований, вошедших в анализ [43].
В другой метаанализ потенциального анальгетического эффекта ферментов у пациентов с ХП вошло пять РКИ. Авторы не выявили значимого обезболивающего эффекта у пациентов, получавших ЗФТ.
Однако надо отметить, что в одном из исследований была продемонстрирована эффективность ферментов, не покрытых кишечнорастворимой оболочкой [59].
В целом с учетом стоимости и отсутствия клинического эффекта ЗФТ в целях обезболивания у пациентов с ХП не должна применяться. Однако пациенты с ВНПЖ на фоне приема ЗФТ обычно испытывают некоторый положительный эффект в виде облегчения дискомфорта, вызванного спазмами в животе вследствие мальабсорбции. Поэтому, если пациенты сообщают о снижении интенсивности абдоминальной боли на фоне ЗФТ, целесообразно продолжить прием этих препаратов в отсутствие других альтернативных анальгетиков с таким же низким риском использования.
Медикаментозное лечение экзокринной недостаточности ПЖ
Рекомендация: пациентам с ХП для лечения ВНПЖ и осложнений мальнутриции рекомендовано применение ЗФТ (условная рекомендация, низкий уровень доказательности).
На фоне применения ЗФТ уменьшается интенсивность проявления симптомов, увеличивается масса тела, улучшается всасывание жира, повышаются уровни жирорастворимых витаминов и микроэлементов, уменьшается степень осложнений мальнутриции (например, риска перелома костей вследствие остеопороза), улучшается качество жизни и снижается смертность [7]. В большинстве РКИ критерием эффективности ЗФТ является КАЖ, измеренный в течение 72 часов. В руководстве FDA для промышленных изготовителей ЗФТ указано, что КАЖ должен сокращаться как минимум на 10%, а в исследованиях должно участвовать как минимум 200 пациентов, наблюдаемых в течение шести месяцев (или 100 пациентов в течение одного года). Нормальный уровень КАЖ > 93% (допустимы потери только до 7% жира рациона со стулом).
В 17 РКИ (12 с перекрестным и пять с параллельным дизайном) оценивали эффективность ЗФТ у пациентов с ХП [46–48, 60–76]. В исследованиях использовались капсулы с кишечнорастворимой оболочкой, таблетки без кишечнорастворимой оболочки, микротаблетки и гранулы, а также некоторые недоступные в настоящее время препараты. Суточная доза (единицы липазы/день по Фармакопее США) варьировалась от < 50 000 до > 700 000. В одних исследованиях сравнивали разные препараты и дозы ЗФТ, в других – ЗФТ и плацебо. В некоторых исследованиях в дополнение к ЗФТ назначали блокатор H2-гистаминовых рецепторов или ингибиторы протонной помпы (ИПП). В Кокрейновском обзоре 2009 г. оценивали эффективность ЗФТ в уменьшении боли, купировании стеатореи и улучшении качества жизни [43]. На фоне ЗФТ значительно уменьшилось количество жира в кале и наблюдалась незначительная тенденция к набору веса и улучшению качества жизни. Авторы обзора пришли к выводу, что данные неоднозначны, необходимы дополнительные исследования.
Недавно был проведен метаанализ, в который вошли 17 исследований [77]. В 14 исследованиях сравнивали уровни КАЖ на фоне ЗФТ с исходными, ЗФТ с плацебо и другим ферментным препаратом. На фоне приема ЗФТ КАЖ значительно повышался по сравнению с исходным уровнем (83,7 ± 6,0 против 63,1 ± 15,0%; p < 0,00001). Экскреция азота с калом и масса стула снижались (p < 0,001). В ряде исследований при использовании ЗФТ также уменьшались проявления метеоризма и купировалась диарея.
В семи исследованиях сравнивали ЗФТ с плацебо. На фоне ЗФТ по сравнению с плацебо отмечалось увеличение КАЖ (83,26 ± 5,5 против 67,4 ± 7,0%; p = 0,0001; высокая гетерогенность I2 = 86%).
В четырех исследованиях был проведен сравнительный анализ эффективности высоких и низких доз ЗФТ. Уровень КАЖ при дозах липазы 60 000 ЕД/сут был несколько выше. Анализ показал, что на фоне ЗФТ улучшалась абсорбция жиров и белков по сравнению с исходным уровнем или плацебо. Во всех оригинальных исследованиях, включенных в данный метаанализ, максимальный период наблюдения составил всего два месяца.
В ряде долгосрочных исследований с более длительным периодом наблюдения отмечалось значительное улучшение параметров нутритивного статуса и качества жизни, увеличение массы тела и уменьшение интенсивности симптомов [78–81].
Данных о влиянии ЗФТ на предотвращение осложнений мальдигестии (переломы костей) нет [7]. Однако результаты небольших проспективных исследований свидетельствуют об улучшении сывороточного уровня витамина D на фоне терапии адекватными дозами Креона в течение шести месяцев [82].
В ретроспективных исследованиях показано, что ВНПЖ может увеличивать смертность. Но данных о том, способна ли ЗФТ иметь обратное действие, пока не получено [83].
Препаратами выбора при ВНПЖ являются капсулы, содержащие микросферы/минимикросферы панкреатина в кишечнорастворимой оболочке размером до 2 мм. Микро- или мини-таблетки размером 2,2–2,5 мм могут также быть эффективными, хотя научных данных на этот счет существенно меньше [5]. Эффективные препараты панкреатина представлены лекарственной формой в виде рН-зависимых микросфер/микротаблеток с кишечнорастворимой оболочкой, которая защищает ферменты от кислоты желудочного сока и позволяет им быстро высвобождать панкреатин при рН 5,5 в двенадцатиперстной кишке.
Препараты с кишечнорастворимой оболочкой продемонстрировали более высокую эффективность, чем обычные неэнтеросолюбильные препараты. Кокрейновский обзор, посвященный оценке эффективности панкреатина при муковисцидозе с ВПНЖ, продемонстрировал более высокую эффективность микросферических препаратов по сравнению с таблетками с кишечнорастворимой оболочкой [84].
Об эффективности ЗФТ можно объективно судить по облегчению симптомов, связанных с мальдигестией (стеаторея, потеря веса, метеоризм), и нормализации нутритивного статуса. У пациентов, недостаточно ответивших на лечение, может оказаться полезным использование функциональных исследований ПЖ (анализ на КАЖ или 13C-дыхательный тест с триглицеридами) на фоне ЗФТ [5]. Купирование клинических признаков мальабсорбции стандартно считается самым важным критерием эффективности ЗФТ, что связано с улучшением качества жизни. Тем не менее в более поздних исследованиях было показано, что облегчение симптомов не всегда связано с нормализацией нутритивного статуса. Сравнительно новый обзор данных подтвердил концепцию нормализации параметров нутритивного статуса (антропометрических и биохимических) как оптимального способа оценки эффективности ЗФТ [85]. Эффективность ЗФТ нельзя оценить по концентрации фекальной эластазы, поскольку в этом случае измеряется только концентрация натурального человеческого фермента, а не содержащегося в полученном извне панкреатине [41]. Отсутствие полноценного эффекта ЗФТ может быть обусловлено вторичными механизмами. Поэтому в случае неудовлетворительного клинического ответа ЗФТ следует увеличить дозу ферментов (удвоить или утроить) или добавить к терапии ИПП. Если эти терапевтические стратегии окажутся безуспешными, следует искать другую причину нарушения пищеварения [5]. Ингибирование секреции желудочного сока с помощью ИПП компенсирует недостаточный ответ на начальную дозу фермента [86]. Пока остается неясным, что эффективнее у этих пациентов – повышение дозы перорального фермента или добавление ИПП, хотя обе стратегии применимы [5]. У пациентов с ХП часто отмечается патологически избыточный бактериальный рост в тонкой кишке, что может рассматриваться как возможная причина рефрактерности симптомов [87, 88].
Таким образом, ВНПЖ следует предполагать у лиц с длительным течением ХП или снижением массы тела на фоне ХП, нарушением нутритивного статуса, диареей, стеатореей, остеопорозом или остеопенией. По мнению экспертов ACG, клинических данных достаточно для установления диагноза и последующего подбора дозы панкреатических ферментов даже без формального измерения содержания фекального жира. Наиболее доступным диагностическим маркером в рутинной практике считается снижение уровня фекальной эластазы. Лечение должно включать адекватную дозу ЗФТ (не менее 40 000–50 000 ЕД липазы с каждым приемом пищи), получаемую во время еды [7]. Пациенты с ХП должны полноценно питаться и не ограничивать себя в количестве потребляемых жиров. Такую возможность им предоставляет адекватная ЗФТ [89].
Креон® с размером частиц 1–1,2 мм – последнее поколение панкреатина, разработанное для максимально точного воссоздания естественного процесса пищеварения и отвечающее всем требованиям, предъявляемым к современным ферментным препаратам. Это делает препарат потенциально более эффективным по сравнению с препаратами предшествующих генераций с более крупными частицами 1,8–2,0 мм [5].
Таким образом, не все панкреатины в капсулах одинаково эффективны. Панкреатин в таблетках уходит в прошлое как наименее эффективная форма выпуска. Результаты фармакоэкономических исследований подтвердили преимущества более совершенных микросферических препаратов панкреатина перед более дешевыми, но устаревшими таблетированными формами [90, 91] .
В дополнение к сказанному процитируем HaPanEU [5]: показания к ЗФТ также имеются при патологических результатах функционального исследования ПЖ в сочетании с клиническими признаками мальабсорбции или антропометрическими и (или) биохимическими признаками мальнутриции (жирорастворимые витамины, преальбумин, ретинол-связывающий белок и магний) [51, 52]. Кроме того, в неопределенных ситуациях допускается назначение ЗФТ в качестве пробного экспериментального режима фармакотерапии в течение 4–6 недель [5].
Заключение
Итак, мы проанализировали ряд важнейших положений недавно опубликованных клинических рекомендаций ACG, дополнив их положениями панъевропейского консенсуса по диагностике и лечению ХП [5]. По большей части оба цитируемых документа соотносятся с отечественными согласительными документами.
Резюмируя сказанное, следует отметить, что у больных ХП в результате длительного воспалительного процесса в ткани ПЖ развиваются фиброз и атрофия ацинусов, что неизбежно приводит к уменьшению числа функционирующих панкреацитов с одновременным снижением объема секреции панкреатических ферментов и развитию первичной ВНПЖ. Высочайший физиологический функциональный потенциал ПЖ позволяет развиться клинически значимой мальабсорбции лишь при снижении объемной секреции ферментов в двенадцатиперстной кишке до 10%, что определяет необходимость использования в качестве ЗФТ адекватных доз (40 000–50 000 ЕД липазы на основной прием пищи) современных ферментных препаратов, характеризующихся своевременной эвакуацией частиц панкреатина из желудка вместе с пищей, что значительно повышает вероятность адекватного контакта фермента на большой площади с химусом и предохраняет панкреатин от разрушения желудочным соком (энтеросолюбильные микросферы/минимикросферы).
В большинстве случаев ХП с ВНПЖ ферментные препараты назначают пожизненно, когда на первый план выходят вопросы безопасности и стоимости лечения. Препараты «чистого» панкреатина – одни из наиболее безопасных среди применяемых в гастроэнтерологии. Результаты убедительных ретроспективных и проспективных фармакоэкономических исследований продемонстрировали преимущества более совершенных микросферических препаратов панкреатина. Подобный фармакоэкономический эффект обусловлен формой выпуска, обеспечивающей за счет минимикросфер панкреатина адекватный гастродуоденальный транспорт и эффективную сегрегацию частиц панкреатина с химусом в двенадцатиперстной кишке, а также адекватной дозой липазы в препарате.
Ярким примером подобной лекарственной формы панкреатина является препарат Креон®, отвечающий всем современным требованиям к препаратам панкреатина, сформулированным на основании экспериментальных, теоретических, биохимических и клинических работ, проанализированных выше.
Yu.A. Kucheryavy, MD, PhD, M.A. Kiryukova, MD, Ye.A. Dubtsova, MD, PhD, D.S. Bordin, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Research and Practical Center
Tver State Medical University
Contact person: Yury A. Kucheryavy, proped@mail.ru
In recent years, a number of international consensus documents and recommendations for the diagnosis and treatment of chronic pancreatitis have been published: United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU) in 2017, International Consensus Statements on Early Chronic Pancreatitis in 2018, American College of Gastroenterology Clinical Guideline on chronic pancreatitis in 2020. The article analyzes the main statements of these recommendations and the possibility of their adaptation to the Russian clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.