Клинико-метаболическая характеристика детей с разными фенотипами ожирения
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено одномоментное проспективное контролируемое исследование с участием 188 детей с ожирением и 23 детей без такового (контрольная группа). Проведены сбор анамнеза, расчет антропометрических показателей и обследование с целью диагностики метаболических осложнений ожирения и определения его фенотипа. В качестве дополнительного диагностического метода использовали биоимпедансометрию.
Результаты. У 20,74% детей выявлено метаболически здоровое ожирение, у 79,96% – метаболически нездоровое. У пациентов с осложнениями ожирения вес и рост оказались больше, чем у детей без осложнений ожирения и детей контрольной группы. Среди осложнений ожирения чаще встречались гиперурикемия (46,4%) и инсулинорезистентность (38,9%). Несколько реже выявлялись артериальная гипертензия, нарушение углеводного обмена, дислипидемия и метаболически ассоциированная жировая болезнь печени. У 44,1% обследованных имели место три и более осложнений ожирения.
Согласно оценке компонентного состава тела, у детей с метаболически нездоровым ожирением содержание висцерального жира, скорость базального метаболизма и процентное содержание жира в организме были выше.
Заключение. Результаты исследования демонстрируют высокую распространенность осложнений ожирения в детском возрасте, особенно при метаболически нездоровом фенотипе. Поэтому необходимо дальнейшее изучение клинико-метаболического профиля таких пациентов и способов его коррекции.
Материал и методы. Проведено одномоментное проспективное контролируемое исследование с участием 188 детей с ожирением и 23 детей без такового (контрольная группа). Проведены сбор анамнеза, расчет антропометрических показателей и обследование с целью диагностики метаболических осложнений ожирения и определения его фенотипа. В качестве дополнительного диагностического метода использовали биоимпедансометрию.
Результаты. У 20,74% детей выявлено метаболически здоровое ожирение, у 79,96% – метаболически нездоровое. У пациентов с осложнениями ожирения вес и рост оказались больше, чем у детей без осложнений ожирения и детей контрольной группы. Среди осложнений ожирения чаще встречались гиперурикемия (46,4%) и инсулинорезистентность (38,9%). Несколько реже выявлялись артериальная гипертензия, нарушение углеводного обмена, дислипидемия и метаболически ассоциированная жировая болезнь печени. У 44,1% обследованных имели место три и более осложнений ожирения.
Согласно оценке компонентного состава тела, у детей с метаболически нездоровым ожирением содержание висцерального жира, скорость базального метаболизма и процентное содержание жира в организме были выше.
Заключение. Результаты исследования демонстрируют высокую распространенность осложнений ожирения в детском возрасте, особенно при метаболически нездоровом фенотипе. Поэтому необходимо дальнейшее изучение клинико-метаболического профиля таких пациентов и способов его коррекции.

Введение
Ожирение признано неинфекционной пандемией XXI в. При этом детское ожирение – одна из важнейших ее составляющих. Именно поэтому среди обсуждаемых ведущими учеными и практикующими врачами вопросов лидируют вопросы, связанные с детским ожирением.
Согласно данным эпидемиологических исследований, в 2016 г. в США распространенность ожирения среди детей достигла 18,5%, в странах Европы и Китае – 16,0% [1–3]. В России ситуация складывалась аналогичным образом. Так, в 2019 г. в Свердловской области частота выявления ожирения у детей в возрасте до 14 лет составила 16,3% [4].
В период пандемии COVID-19 из-за резкого изменения образа жизни (дистанционное обучение школьников с последующим снижением физической активности, ограничением занятиями спортом, уменьшением времени пребывания на свежем воздухе и т.д.) в совокупности со следованием принципам нерационального питания был отмечен значительный прирост новых случаев детского ожирения. Согласно результатам масштабного многоцентрового американского исследования, в ходе которого были обследованы более 432 тыс. детей, в период пандемии COVID-19 количество детей с ожирением ежемесячно увеличивалось практически вдвое. В 2020 г. этим заболеванием страдали уже 22,4% из наблюдаемой группы [5]. Кроме того, некоторые исследователи сообщили, что у детей с ожирением в анамнезе значительно ускорились темпы прибавки веса, что повышало риск развития выраженных метаболических нарушений [6]. Чешские ученые установили, что частота встречаемости ожирения у детей в возрасте семи лет составила 17,1%, в 13 лет – 23,1%, что крайне неблагоприятно с точки зрения формирования множественных осложнений заболевания в молодом возрасте [7]. В России в постпандемийный период также наблюдалась неблагоприятная ситуация в отношении детского ожирения. Так, в 2021 г. в Самаре было выявлено 13,5% детей с ожирением [8]. Пик заболеваемости приходился на ранний школьный возраст – 32,5%. К подростковому возрасту частота встречаемости ожирения снижалась. Среди 14-летних детей она достигала 9,1%. Как следствие, среди детей повышается риск распространенности осложнений ожирения, способных привести к утрате трудоспособности и инвалидизации в молодом возрасте.
У таких пациентов развиваются инсулинорезистентность, нарушения углеводного обмена, а затем и сахарный диабет 2 типа, сердечно-сосудистая патология (артериальная гипертензия и дислипидемия), а также метаболически ассоциированная жировая болезнь печени. Так, согласно данным систематического обзора, среди более чем 180 тыс. детей артериальная гипертензия имела место у 15,27% с избыточным весом [9]. Частота выявления метаболически ассоциированной жировой болезни печени у детей с ожирением достигала 34,2% [10]. За последние три десятилетия число случаев развития сахарного диабета 2 типа в педиатрической популяции увеличилось на 7,1%. В настоящее время распространенность данной патологии варьируется от 31 до 94 случаев на 100 тыс. детского населения [11].
К сожалению, несмотря на значительные усилия со стороны медицинских сообществ и социальных служб, серьезных успехов в решении глобальной проблемы ожирения достичь пока не удается. В педиатрической практике это усугубляется еще более ограниченным перечнем возможных методов воздействия. На данный момент времени лишь небольшое количество препаратов может применяться у детей как для лечения и профилактики ожирения, так и для коррекции сформировавшихся осложнений. Большая их часть назначается off-label.
Ведутся также активные дискуссии в отношении целесообразности разделения ожирения на метаболически здоровое и нездоровое [12, 13]. Метаболически здоровое ожирение (МЗО) – это ожирение, при котором не выявляются клинико-метаболические осложнения. Метаболически нездоровое ожирение (МНЗО) ассоциировано с одним или несколькими метаболическими нарушениями.
Известно, что ожирение сопряжено с высоким риском развития осложнений, в частности сердечно-сосудистых, независимо от наличия или отсутствия метаболических нарушений [14]. В апреле 2023 г. были опубликованы данные крупномасштабного многоцентрового исследования, проведенного в рамках Проекта по борьбе с метаболическим синдромом и охватившего более 797 тыс. европейцев из шести когорт, в отношении риска развития любого вида рака в зависимости от фенотипа ожирения. Установлено, что МНЗО связано с более высоким риском развития любого вида рака, ассоциированного с ожирением (рака прямой или толстой кишки, печени, желчного пузыря, поджелудочной железы, эндометрия), а также с несколькими видами рака, не ассоциированными с ожирением [15].
Следовательно, МНЗО как фактор риска развития различных, в том числе неочевидных, осложнений требует раннего выявления. Кроме того, необходимо дальнейшее изучение клинико-метаболических аспектов заболевания.
Высокая распространенность ожирения и его осложнений, в том числе в детской популяции, противоречия в вопросах выделения фенотипов ожирения и недостаточное количество педиатрических исследований послужили поводом для проведения настоящего исследования.
Целью исследования стала оценка частоты возникновения метаболических осложнений ожирения у детей, а также их клинико-метаболического профиля при разных фенотипах ожирения.
Материал и методы
На базе ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России и ГБУЗ «Самарская областная детская клиническая больница им. Н.Н. Ивановой» с февраля по июль 2023 г. было проведено одномоментное проспективное контролируемое исследование, в которое были включены 188 детей с эгзогенно-конституциональным ожирением и 23 здоровых ребенка, составивших контрольную группу (КГ).
Исследование было одобрено локальным комитетом по биоэтике ФГБОУ ВО «Самарский государственный медицинский университет» Минздрава России (выписка из протокола № 253 от 14.09.2022).
Критерии включения в исследование:
- возраст пациентов от 7 до 17 лет включительно;
- наличие диагноза «экзогенно-конституциональное ожирение»;
- отсутствие синдромальных и моногенных форм ожирения;
- отсутствие соматических заболеваний, влияющих на рост и развитие ребенка;
- подписанное добровольное информированное согласие на участие в исследовании.
Критерии невключения:
- возраст менее 7 лет, а также 18 лет и более;
- перенесенные вирусные и инфекционные заболевания в течение последнего месяца;
- наличие патологии, влияющей на рост и развитие (детский церебральный паралич, преждевременное половое созревание, задержка физического развития и т.д.);
- наличие синдромальных или моногенных форм ожирения.
Критерий исключения – невозможность соблюдения протокола исследования пациентом.
Здоровые дети были сопоставимы по возрасту с детьми, страдающими ожирением. Отсутствие у детей КГ ожирения или избытка массы тела, хронических заболеваний и метаболических нарушений подтверждалось данными лабораторных и инструментальных методов исследования.
Изучена первичная медицинская документация на предмет выявления сопутствующей патологии. Собраны данные о росте и весе детей при рождении и длительности грудного вскармливания, наличии или отсутствии отягощенного семейного анамнеза в отношении ожирения.
Проведена антропометрия с определением степени ожирения по критериям Всемирной организации здравоохранения исходя из расчета стандартного сигмального отклонения (standard deviation score, SDS). С этой целью использовали программу AnthroPLUS.
Для диагностики артериальной гипертензии дважды в день контролировали артериальное давление с использованием автоматического тонометра. При ухудшении самочувствия проводили дополнительное измерение. Диагноз «артериальная гипертензия» устанавливали в соответствии с клиническими рекомендациями «Артериальная гипертензия у детей», утвержденными Минздравом России [16].
С целью оценки метаболического профиля проведено комплексное лабораторно-инструментальное обследование пациентов.
Для диагностики дислипидемии, синдрома цитолиза и гиперурикемии определяли уровень трансаминаз, холестерина и его производных, а также мочевой кислоты, нарушений углеводного обмена – уровень гликированного гемоглобина, С-пептида, инсулина натощак и инсулина после нагрузки глюкозой. Всем пациентам также был проведен глюкозотолерантный тест. В результате были выявлены такие осложнения, как инсулинорезистентность, нарушение углеводного обмена или сахарный диабет 2 типа. Критерии постановки диагноза соответствовали клиническим рекомендациям «Ожирение у детей» [17].
При ультразвуковом исследовании гепатобилиарной системы обнаружена метаболически ассоциированная жировая болезнь печени.
Кроме того, была проведена биоимпедансометрия с определением содержания висцерального жира (процент от общего содержания жира в организме), общего процентного содержания жира и скорости базального метаболизма. Для оценки композиционного состава использовали аппарат InBody-770.
Полученные данные легли в основу разработки дизайна исследования, создания и регистрации базы данных (свидетельство о государственной регистрации программы для ЭВМ № 2023624468 от 07.12.2023). Статистический анализ результатов проводили с использованием программы StatTech v. 3.1.10 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению по критерию Колмогорова – Смирнова, так как пациентов было больше 50. Значения, имеющие нормальное распределение, описывали с помощью средней арифметической величины (M) и стандартного отклонения (SD), а также 95%-ного доверительного интервала (ДИ). В отсутствие нормального распределения количественные данные представляли в виде медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывали с указанием абсолютных значений и процентных долей. В нашей работе распределение показателей отличалось от нормального, поэтому сравнение трех и более групп выполнялось с помощью критерия Краскела – Уоллиса. Сравнение процентных долей при анализе многопольных таблиц сопряженности осуществлялось с помощью хи-квадрата Пирсона. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна – Уитни.
Результаты
Исходя из результатов обследования все участники исследования были разделены на три группы. Первая группа включала 41 ребенка с ожирением, но без осложнений или метаболических нарушений, ассоциированных с заболеванием (ГМЗО), вторая группа – 147 детей с ожирением, а также с одним или несколькими осложнениями или лабораторными изменениями (гиперурикемия, синдром цитолиза), ассоциированными с данным заболеванием (ГМНЗО), третья группа – 23 здоровых ребенка (КГ).
Средний возраст участников исследования составил 14 (10–15) лет, рост – 1,59 (1,39–1,72) м, вес – 80 (61–96) кг, индекс массы тела (ИМТ) – 30 (27–35) кг/м², SDS ИМТ – 3,0 (2,0–3,0) ед.
Среди детей было 113 (53,55%) мальчиков и 98 (46,44%) девочек.
Средний вес детей при рождении составлял 3300 (3002–3600) г, продолжительность грудного вскармливания – 6 (1–12) месяцев. Ожирение в семье пробандов имело место у 56,4 (ДИ 49,4–63,2)%, отсутствовало – у 43,6 (ДИ 36,8–50,6)%.
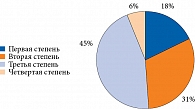
Из 188 детей у 11 (5,85%) диагностировано ожирение четвертой степени, у 84 (44,68%) – третьей степени, у 58 (30,85%) – второй степени, у 35 (18,61%) – первой степени (рис. 1). Таким образом, преобладали участники с третьей степенью ожирения.
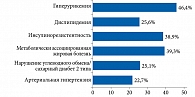
Среди метаболических осложнений ожирения выявлены артериальная гипертензия, инсулинорезистентность, нарушение углеводного обмена или сахарный диабет 2 типа, дислипидемия, метаболически ассоциированная жировая болезнь печени и гиперурикемия. Наиболее часто встречались гиперурикемия (98 (46,4%) случаев), инсулинорезистентность (82 (38,9%)), метаболически ассоциированная жировая болезнь печени (83 (39,3%)). Дислипидемия диагностирована у 54 (25,6%) детей, нарушение углеводного обмена или сахарный диабет 2 типа – у 53 (25,1%). Артериальная гипертензия была наиболее редким осложнением – 48 (22,7%) детей (рис. 2).
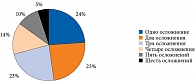
Одно осложнение было зарегистрировано у 36 (24,16%) детей, два осложнения – у 35 (23,48%), три осложнения также были зарегистрированы у 35 (23,48%) пациентов. Множественные осложнения встречались довольно редко: четыре – у 21 (14,09%) ребенка, пять – у 15 (10,06%) детей, шесть – у 7 (4,69%) (рис. 3).
Таким образом, МЗО обнаружено у 20,74%, МНЗО – у 79,96%.
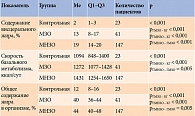
Согласно оценке компонентного состава тела, средний уровень висцерального жира у обследованных составил 16 (10–20)%, скорость базального метаболизма – 1393 (1183–1554) ккал/сут, содержание жира в организме – 42 (36–47)%.
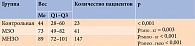
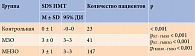
При сравнении исследуемых показателей статистически значимые различия по количеству детей обоего пола между группами с разными фенотипами ожирения отсутствовали. В отношении различий параметров веса, устанавливаемых с помощью критерия Краскела – Уоллиса и F-критерия Фишера для SDS ИМТ, выявлено, что вес и SDS ИМТ в ГМНЗО были значимо выше, чем в ГМЗО и КГ (табл. 1 и 2).
При оценке зависимости роста от наличия/отсутствия ожирения установлено, что дети с ожирением были значимо выше здоровых детей (p < 0,001), а дети с МНЗО – статистически значимо выше детей с МЗО (p = 0,003).
Анализ зависимости степени ожирения от его фенотипа, проведенный с помощью хи-квадрата Пирсона, продемонстрировал, что у пациентов с первой и второй степенями ожирения преимущественно определялось МЗО и меньшее количество осложнений, в то время как у пациентов с третьей и четвертой степенями преобладало МНЗО, однако эти данные оказались статистически незначимыми (табл. 3).
При оценке продолжительности грудного вскармливания с помощью критерия Краскела – Уоллиса оказалось, что у здоровых детей продолжительность грудного вскармливания была значимо больше и в среднем достигала 12 (6–18) месяцев по сравнению с детьми с ожирением (p = 0,008). У больных детей средняя продолжительность грудного вскармливания составляла 6 (1–12) месяцев. Достоверной разницы рассматриваемого показателя между группами с разными фенотипами ожирения выявлено не было.
С помощью хи-квадрата Пирсона был проведен анализ зависимости между семейным анамнезом в отношении ожирения и его фенотипом. У детей с МЗО и МНЗО в отношении семейного анамнеза статистически значимых различий не отмечено. Однако в данной когорте в отличие от здоровых детей ожирение у ближайших родственников (родителей и сибсов) встречалось значимо чаще (p < 0,001).
С помощью критерия Краскела – Уоллиса мы сравнили результаты биоимпедансометрии, а именно процент висцерального жира, скорость базального метаболизма и общее процентное содержание жира в организме у детей с ожирением и без. Все три показателя были больше в группе МНЗО по сравнению с группой МЗО (p < 0,001, p = 0,005 и p = 0,005 соответственно) (табл. 4).
Обсуждение
Результаты проведенного исследования продемонстрировали довольно высокую частоту встречаемости МНЗО (79,96%), что соответствует современным эпидемиологическим трендам. Так, в одном из крупнейших многоцентровых европейских исследований с участием более 163 тыс. человек на МЗО приходилось от 7 до 19%, на МНЗО – в среднем 78% [18].
Одним из ожидаемых результатов нашей работы стала положительная корреляция всех весовых параметров (вес, ИМТ, SDS ИМТ) с наличием осложнений ожирения. При более высоких значениях веса частота встречаемости МНЗО увеличивалась. Однако статистически значимых различий между частотой выявления метаболических осложнений и степенью ожирения нами обнаружено не было. Полученные нами данные важны в продолжение дискуссии о том, почему у некоторых пациентов даже при высокой степени ожирения может формироваться фенотип без метаболических осложнений.
В ходе нашего исследования также выявлено опережение линейного роста пациентов с ожирением. При этом у детей с МНЗО рост был выше, чем у детей с МЗО. Причиной такового может быть инсулинорезистентность, более выраженная при МНЗО. В условиях инсулинорезистентности наблюдается повышенная стимуляция инсулиноподобного фактора роста 1, основными функциями которого являются пролиферация клеток, дифференцировка тканей и влияние на линейный рост. В ряде исследований отмечен более высокий уровень инсулиноподобного фактора роста 1 у детей с ожирением по сравнению со здоровыми детьми [19] и ускоренный линейный рост на фоне ожирения [20].
Анализ анамнестических данных позволил обнаружить обратную корреляцию между продолжительностью грудного вскармливания и развитием ожирения. Это может свидетельствовать о влиянии характера вскармливания ребенка на формирование заболевания. Аналогичные результаты были получены во многих зарубежных исследованиях. В одном из них, включившем данные в отношении 4740 детей из 12 стран, убедительно продемонстрировано, что продолжительность грудного вскармливания ассоциирована с развитием ожирения у детей [21]. В другом подобном исследовании, которое было проведено на меньшей выборке, но с более точной и подробной оценкой возраста введения прикорма, показано, что грудное вскармливание менее трех месяцев увеличивало риск развития ожирения у детей двух-трех лет в четыре раза. Более того, его авторы отметили влияние на риск развития ожирения времени введения прикорма и длительности употребления молочной смеси [22]. Безусловно, представленные результаты могут быть полезны для разработки и внедрения эффективных профилактических вмешательств.
Предсказуемыми оказались данные, полученные при анализе связи семейного анамнеза в отношении ожирения и развития его осложнений. Отягощенный семейный анамнез у детей с ожирением имел место достоверно чаще, чем у здоровых детей. В то же время по частоте случаев ожирения в семьях группы МЗО и МНЗО значимо не различались. Несомненно, важную роль в развитии ожирения играют образ жизни и характер питания всей семьи, формирование пищевых привычек с раннего возраста и другие медицинские, психологические и социальные аспекты, на которые должны быть направлены профилактические мероприятия.
С учетом недостаточного количества данных о распространенности метаболических осложнений в детской популяции представляется важным обратить внимание на частоту их выявления в нашем исследовании. Так, у 22,7% детей с ожирением имела место артериальная гипертензия. В ранее упомянутом систематическом обзоре их насчитывалось 15,27% [9]. Столь значимую разницу можно объяснить разными подходами к диагностике. В нашем исследовании дети находились под пристальным наблюдением с постоянным и своевременным контролем артериального давления в течение всего периода наблюдения.
Довольно высокой оказалась и частота выявления дислипидемии (25,6%), гиперурикемии (46,4%) и нарушения углеводного обмена (25,1%), которые в совокупности с артериальной гипертензией являются компонентами метаболического синдрома.
Количество детей с МНЗО, у которых имели место три и более осложнений ожирения, также оказалось значительным – 41,44%. Осложнения ожирения способны значимо снижать качество жизни и увеличивать риск неблагоприятных прогнозов в молодом возрасте.
Согласно результатам биоимпедансометрии, у пациентов с МНЗО показатели общего процентного содержания жира в организме и процентного содержания висцерального жира были более высокими. Важно отметить, что до периода пубертата не следует делать вывод об абдоминальном типе ожирения, которое сопряжено с более высоким риском формирования осложнений и метаболического синдрома. Однако с учетом высокого уровня висцерального жира у многих наших пациентов можно прогнозировать именно такой тип отложения жировой ткани в будущем. У пациентов с МНЗО также была выше скорость базального метаболизма, что может объясняться более высокой массой тела. Данный показатель косвенно позволяет судить об этиологии ожирения, в частности о наличии экзогенно-конституциональной причины, так как у пациентов с генетическими формами ожирения (синдромы Прадера – Вилли и Барде – Бидля) он будет более низким вследствие замедления обменных процессов и мышечной гипотонии [23].
Заключение
Нами были изучены некоторые аспекты детского ожирения, касающиеся частоты выявления разных его фенотипов и особенностей клинико-метаболических показателей. Установлена высокая частота встречаемости у детей МНЗО, а также нескольких осложнений заболевания. Кроме того, выявлена связь метаболически нездорового фенотипа ожирения с весо-ростовыми показателями и данными биоимпедансометрии.
Некоторые результаты исследования остаются в области активно обсуждаемых вопросов, требующих решения, а следовательно, дальнейшего проведения исследований.
O.V. Skvortsova, N.B. Migachyova, MD, PhD, E.G. Mikhaylova, PhD
Samara State Medical University
Samara Regional Children's Clinical Hospital named after N.N. Ivanova
Contact person: Olga V. Skvortsova, skvorcova_a@bk.ru
The aim of the study was to determine the incidence of metabolic complications of obesity in children, as well as to evaluate their clinical and metabolic profile depending on the phenotype of the disease.
Material and methods. A single-stage prospective controlled study was conducted with the participation of 188 obese children and 23 non-obese children (control group).
Anamnesis collection, calculation of anthropometric indicators and examination were carried out in order to diagnose metabolic complications of obesity and determine its phenotype. Bioimpedance measurement was used as an additional diagnostic method.
Results. 20.74% of children had metabolically healthy obesity, 79.96% had metabolically unhealthy obesity. In patients with complications of obesity, weight and height were higher than in children without complications of obesity and children of the control group.
Among the complications of obesity, hyperuricemia (46.4%) and insulin resistance (38.9%) were more common. Arterial hypertension, impaired carbohydrate metabolism, dyslipidemia and metabolically associated fatty liver disease were detected somewhat less frequently. 44.1% of the surveyed had three or more complications of obesity. According to the assessment of body component composition, children with metabolically unhealthy obesity had higher visceral fat levels, basal metabolic rate and body fat percentage.
Conclusion. The results of the study demonstrate high prevalence of obesity complications in childhood, especially with a metabolically unhealthy phenotype. Therefore, it is necessary to further study the clinical and metabolic profile of such patients and ways to correct it.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.