Серия клинических случаев дилатационной кардиомиопатии, развившейся у пациентов с дистрофической формой врожденного буллезного эпидермолиза
- Аннотация
- Статья
- Ссылки
- English
Введение
Врожденный буллезный эпидермолиз (ВБЭ) – это группа генетически гетерогенных заболеваний, общей чертой которых является склонность к образованию пузырей и/или эрозий на коже и слизистых оболочках вследствие минимальной травматизации или спонтанно [1]. Эти проявления возникают вследствие нарушения структурной и функциональной целостности дермо-эпидермального соединения из-за генетического дефекта одного из белков кожи, принимающих участие в соединении базальных кератиноцитов с расположенной под ними базальной мембраной и дермой [2]. По последним данным, показатель распространенности ВБЭ у детей от 0 до 17 лет, в том числе в Российской Федерации, составляет 15,48 случая на 1 млн детского населения [3]. Врожденный буллезный эпидермолиз представлен четырьмя основными формами: простой буллезный эпидермолиз, пограничный буллезный эпидермолиз, дистрофический буллезный эпидермолиз и синдром Киндлер [1].
Клинические проявления всех форм ВБЭ характеризуются большим спектром симптомов и мультисистемностью поражения с вовлечением в патологический процесс различных органов и систем [4].
Одной из наиболее тяжелых форм ВБЭ является дистрофический буллезный эпидермолиз (ДБЭ), заболевание, обусловленное мутациями в гене COL7A1, приводящее к хрупкости кожи и слизистых оболочек и образованию пузырей. Помимо дерматологических проявлений и таких осложнений, как поражение органов желудочно-кишечного тракта, опорно-двигательного аппарата, мочеполовой системы, органа зрения [5, 6], у пациентов с ДБЭ может развиваться тяжелое жизнеугрожающее осложнение сердечно-сосудистой системы – кардиомиопатия.
Кардиомиопатии у детей представляют собой группу редких тяжелых заболеваний сердечной мышцы, которые сопряжены с высоким риском инвалидизации и наступления смерти [7, 8].
Потенциальными факторами риска развития кардиомиопатии являются нутритивная недостаточность, низкий уровень карнитина, дефицит селена, анемия и длительный прием железосодержащих препаратов, а также хроническая инфекция и системные осложнения, например почечная недостаточность [9–11].
Клиническими проявлениями кардиомиопатии у пациентов с ВБЭ могут быть усталость, одышка и усиленное сердцебиение, что часто связано с кожным патологическим процессом и затрудняет своевременную дифференциальную диагностику. У данной группы пациентов наблюдаются различные типы кардиомиопатий, включая дилатационную, гипертрофическую и рестриктивную [12].
Терапия кардиомиопатии при ВБЭ затруднена отсутствием таргетных методов и сложностью патогенеза болезни, усугубляющейся наличием нутритивной недостаточности. Поэтому на сегодняшний день лечение кардиомиопатии сводится к симптоматическому поддержанию функционирования сердечной деятельности.
В представленной статье показаны различные варианты течения кардиомиопатии у детей с дистрофической формой врожденного буллезного эпидермолиза.
Клинический случай 1
Девочка, 17 лет, наблюдается в отделении дерматологии Национального медицинского исследовательского центра (НМИЦ) здоровья детей с 2018 г. с диагнозом «рецессивный дистрофический буллезный эпидермолиз, тяжелое течение BEBS 61 (выявлен патогенный вариант в гене COL7A1 g.48621756dup в гомозиготном состоянии)». Из анамнеза известно, что у ребенка имеются множественные проявления ВБЭ с рождения, включая поражения кожи, слизистых оболочек полости рта, а также деформации кистей рук и ног. С 2019 г. появилась тахикардия, колющая боль в области сердца и снижение объема диуреза на протяжении последнего года, подергивания во сне в течение последнего месяца.
При проведении лабораторно-инструментальных исследований в 2018 г. патологии со стороны сердечно-сосудистой системы не выявлено, о чем свидетельствуют результаты проведенных электрокардиограммы (ЭКГ) и эхокардиографии (Эхо-КГ).
ЭКГ: ритм – 120; положение электрической оси сердца (ЭОС) нормальное; ритм синусовый; тахикардия резкая (когда ребенок волнуется); только стандартные отведения (в связи с кожным процессом).
Эхо-КГ: полости сердца не расширены, стенки не утолщены, перегородки интактны, клапаны и крупные сосуды не изменены. Глобальная и локальная систолические функции левого желудочка (ЛЖ) удовлетворительные. Насосная функция сердца достаточная. Тахикардия.
Во время очередной госпитализации в отделение дерматологии НМИЦ здоровья детей в 2022 г. были обнаружены следующие отклонения в лабораторно-инструментальных исследованиях: железодефицитная анемия средней степени тяжести, белково-энергетическая недостаточность крайне тяжелой степени, выраженный дефицит витамина D.
ЭКГ: ритм – 107–115; PQ – 0,13; P – 0,08; QRS – 0,09; QT – 320–330 мс; QTc – 441–444 мс; положение ЭОС горизонтальное (+15); ритм: миграция водителя ритма из синусового узла в миокард правого предсердия; тахикардия: резкая; только стандартные отведения (в связи с кожным процессом).
Эхо-КГ: ЛЖ увеличен. Систолическая функция ЛЖ снижена. Тахикардия. Стенки ЛЖ незначительно утолщены. Перегородки интактны, клапаны и крупные сосуды не изменены. Насосная функция сердца достаточная.
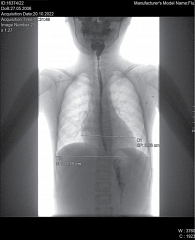
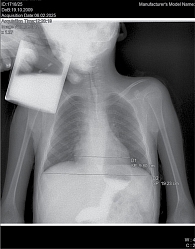
Рентген органов грудной клетки: отмечается повышенный горизонтальный размер тени сердца – 9,98 см. Сердечно-грудной индекс – 0,58 – повышен и характерен для начальной стадии дилатационной кардиомиопатии (рис. 1).
В связи с выявленными изменениями по данным инструментальных исследований пациентки и после консультации кардиолога был установлен диагноз: «Ремоделирование сердца по дилатационному типу со снижением сократительной способности миокарда ЛЖ. Хроническая сердечная недостаточность (ХСН) стадии 2А». Оценить функциональный класс (ФК) не представляется возможным ввиду ограничения физической активности. Были даны рекомендации применять терапию препаратом из группы антагонистов рецепторов ангиотензина II – лозартаном с титрацией дозы до 1 мг/кг/с под контролем артериального давления, а также с учетом тахикардии, в качестве селективного бета 1-адреноблокатора рекомендован бисопролол и в качестве диуретического калийсберегающего средства – спиронолактон.
Пациентка получала назначенную терапию два года, и во время очередной госпитализации в отделение дерматологии НМИЦ здоровья детей в 2024 г. были проведены контрольные исследования, которые показали положительную динамику со стороны сердечно-сосудистой системы.
ЭКГ: ритм – 85 (83–88); PQ – 0,12; P – 0,08; QRS – 0,09; QT – 0,34; QTc – 0,404; положение ЭОС нормальное; ритм синусовый; тахикардия умеренная; в связи с кожным процессом нет доступа к грудным отведениям.
Эхо-КГ: на момент осмотра незначительное расширение полости ЛЖ, утолщение стенок ЛЖ. Незначительное снижение сократительной функции ЛЖ. Перегородки интактны, клапаны и крупные сосуды не изменены. Насосная функция сердца достаточная.
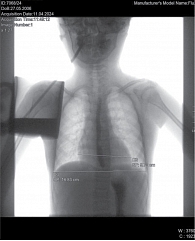
Рентген органов грудной клетки: отмечается повышенный горизонтальный размер тени сердца, однако в динамике отмечается снижение до 9,72 см. Сердечно-грудной индекс также снизился до 0,57 (рис. 2).
По результатам повторной консультации кардиолога было сделано заключение о сохраняющемся ремоделировании сердца по дилатационному типу с положительной динамикой на фоне проводимого лечения в виде уменьшения выраженности дилатации и улучшения сократительной способности ЛЖ. При пересчете измерений межжелудочковой перегородки (МЖП) и задней стенки ЛЖ данных за гипертрофию миокарда недостаточно, z-score МЖП – 1,4, задняя стенка ЛЖ до 1,9. Оценить ФК не представляется возможным ввиду ограничения физической активности. Диагноз: «Кардиомиопатия, дилатационный фенотип. Нарушение ритма сердца: хроническая суправентрикулярная тахикардия. ХСН стадии 2А».
Также дополнительно для терапии был рекомендован прием препаратов витамина D, дополнительное специализированное высококалорийное питание.
Динамика и исходы: на протяжении последних двух лет отрицательной динамики со стороны сердечно-сосудистой системы не отмечалось (со слов пациентки). Пациентка продолжает соблюдать все рекомендации, в том числе получает терапию препаратом лозартан.
Клинический случай 2
Мальчик, 15 лет, наблюдался в отделении дерматологии НМИЦ здоровья детей с 2016 г. Первые проявления врожденного буллезного эпидермолиза – на первые сутки жизни, когда были обнаружены пузыри на слизистой оболочке полости рта, на вторые сутки жизни – пузыри на коже в области стоп и на пятые сутки жизни – пузыри на коже туловища, в связи с чем был установлен диагноз «врожденный буллезный эпидермолиз».
В 2019 г. при проведении генетического исследования выявлена нуклеотидная замена g.48610171C>A в гомозиготном состоянии в гене COL7A1, в связи с чем был установлен окончательный диагноз «врожденный буллезный эпидермолиз, дистрофическая форма».
С 2016 г. у пациента отмечалась задержка росто-весовых показателей и умеренная белково-энергетическая недостаточность. В 2017 г. сформировалась тяжелая белково-энергетическая недостаточность. Железодефицитная анемия. Глубокий дефицит витамина D. При проведении обследования в условиях стационара отделения дерматологии НМИЦ здоровья детей в 2016, 2017, 2018 и 2019 гг. изменений со стороны сердечно-сосудистой системы отмечено не было, также пациент никогда не предъявлял жалоб.
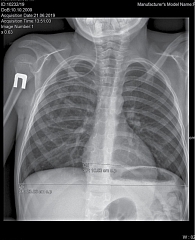
При проведении рентгенологического исследования сердечно-грудной индекс был в пределах нормы – 0,44 (горизонтальный размер тени сердца – в норме (10,52 см)) (рис. 3).
Однако во время очередной госпитализации в 2021 г. по результатам ЭКГ и Эхо-КГ была впервые отмечена сердечно-сосудистая патология.
ЭКГ: ритм – 133; 0,12; 0,08; 0,07; QT – 0,29; QTc – 432 мс; положение ЭОС горизонтальное; ритм синусовый; тахикардия резкая, выраженная; снижение вольтажа зубцов Т на фоне тахикардии. На ЭКГ только стандартные отведения (невозможность наложения из-за кожного процесса).
Эхо-КГ: аорта не расширена, восходящая часть и дуга не изменены, на перешейке градиент 18,2 мм рт. ст.; диаметр восходящей аорты – 16 мм; аортальный клапан трехстворчатый, створки и гемодинамика не изменены; PGrmax – 7,4 мм рт. ст.; Vmax – 1,36 м/с; при цветовом допплеровском кодировании (ЦДК) регургитация не выявлена; легочная артерия не расширена; ствол, правая и левая ветви не изменены; диаметр ствола – 17,5 мм; створки и гемодинамика клапана легочной артерии не изменены; PGrmax – 6,95 мм рт. ст.; Vmax – 1,32 м/с; при ЦДК физиологическая регургитация; створки и гемодинамика митрального клапана не изменены; PGr – 4,7; при ЦДК регургитация не выявлена; створки и гемодинамика трикуспидального клапана не изменены; PGr – 3,4; при ЦДК регургитация не выявлена; левое предсердие – 30 × 37 мм, незначительно расширено (z-score – 2,17); правое предсердие: 31 × 36 мм, незначительно расширено (z-score – 2,44); межпредсердная перегородка интактна; правый желудочек (ПЖ) не расширен – 14,4 мм, TAPSE – 22; ЛЖ умеренно расширен, конечно-диастолический размер (КДР) – 46,5 мм (z-score – 3,8 мм); конечный систолический размер (КСР) – 35 мм; фракция выброса (ФВ) – 49%; частота сердечных сокращений (ЧСС) – 127; конечный диастолический объем (КДО) – 100 мл; конечный систолический объем (КСО) – 51 мл; ударный объем (УО) – 49 мл; сердечный выброс (СВ) – 6,223 л/мин; сердечный индекс (СИ) – 7,48 л/мин/м2; диастолическая функция ЛЖ не нарушена; межжелудочковая перегородка – 6,2 мм, не утолщена, интактна; задняя стенка ЛЖ – 5,7 мм; не утолщена. Дополнительные особенности: дополнительная трабекула в полости ЛЖ. Заключение: умеренное расширение ЛЖ, незначительная атриомегалия. Стенки не утолщены, перегородки интактны, клапаны и крупные сосуды не изменены. Сократительная функция сердца снижена. Насосная функция сердца достаточная. Данных за врожденный порок сердца нет. Тахикардия.
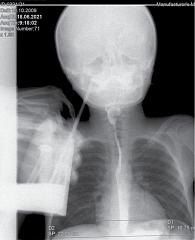
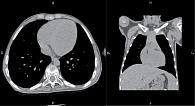
Рентген органов грудной клетки: отмечен повышенный горизонтальный размер тени сердца – 10,75 см. Сердечно-грудной индекс – 0,48 – повышен и характерен для начальной стадии дилатационной кардиомиопатии (рис. 4).
Компьютерная томография органов грудной полости: острых очаговых и инфильтративных изменений в органах грудной полости не выявлено. Размеры лимфоузлов средостения и корней легких в пределах нормальных величин. Отмечается увеличение ЛЖ (рис. 5).
В связи с выявленными по результатам инструментальных исследований изменениями пациент был консультирован кардиологом, установлен диагноз: «Синдром дилатационной кардиомиопатии. ХСН стадии 2А (ремоделирование сердца по дилатационному типу со снижением сократительной способности ЛЖ)». Назначена комбинированная терапия ХСН с целью снижения преднагрузки – диуретик; с целью нейрогуморальной разгрузки – антагонист рецепторов ангиотензина II (лозартан); бета-блокатор (карведилол); АМКР (спиронолактон), – которую пациент получал в течение трех лет. Во время очередной госпитализации в отделение дерматологии НМИЦ здоровья детей в 2025 г. были проведены контрольные исследования, которые не показали положительную динамику состояния сердечно-сосудистой системы.
ЭКГ: ритм – 73–86; PQ – 0,13; P – 0,08; QRS – 0,08; QT – 330–340 мс; QTc – 376–394 мс; положение ЭОС нормальное; ритм – миграция водителя ритма из синусового узла в миокард правого предсердия; ЧСС в пределах возрастной нормы; умеренная аритмия; нет доступа к грудным отведениям (в связи с наличием эрозий в области наложения электродров).
Эхо-КГ: аорта: не расширена, восходящая часть и дуга не изменены, на перешейке градиент 11 мм рт. ст.; диаметр восходящей аорты – 18 мм; аортальный клапан трехстворчатый, створки и гемодинамика не изменены; PGrmax – 4,5 мм рт. ст.; Vmax – 1,06 м/с; при ЦДК регургитации нет; легочная артерия не расширена, правая и левая ветви ствола не изменены, диаметр ствола – 17 мм; створки, гемодинамика клапана легочной артерии не изменены; PGrmax – 5,2 мм рт. ст.; Vmax – 1,14 м/с; при ЦДК физиологическая регургитация; створки, гемодинамика митрального клапана не изменены; PGr – 3,3; при ЦДК регургитация минимальная; створки, гемодинамика трикуспидального клапана не изменены; PGr – 1,8; при ЦДК физиологическая регургитация PGr 16 мм рт. ст.; левое предсердие не расширено, 26 × 37 мм; правое предсердие не расширено, 26 × 37 мм; межпредсердная перегородка интактна; ПЖ не расширен, 17 мм; ЛЖ: КДР – 44 мм (z-score – 2,02 мм, норма – от -2,0 до 2,0 мм); КСР – 30 мм; ФВ – 60%; ЧСС – 116; КДО – 90 мл; КСО – 36 мл; УО – 54 мл; СВ – 6,264 л/мин; сердечный индекс – 6,295 л/мин/м2; Межжелудочковая перегородка не утолщена, интактна, 7,2 мм; задняя стенка ЛЖ: участки коронарного русла не изменены, сепарация листков перикарда на верхушке до 5 мм (соответствует норме). Заключение: полости не расширены, стенки не утолщены, перегородки интактны, клапаны и крупные сосуды не изменены. Насосная функция сердца достаточная. Тахикардия.
Рентген органов грудной клетки: отмечается повышенный горизонтальный размер тени сердца – 9,8 см. Сердечно-грудной индекс – 0,50 (рис. 6).
По результатам повторной консультации кардиолога было сделано заключение: на фоне проводимого лечения не отмечено отрицательной динамики; выставлен диагноз: «Кардиомиопатия, дилатационный фенотип, вторичная. Нарушение ритма и проводимости сердца: хроническая суправентрикулярная тахикардия, неспецифическая внутрижелудочковая блокада. ХСН стадии 2А». Были даны рекомендации: продолжение длительной и непрерывной терапии лозартаном, а также прием β-адреноблокирующего средства (бисопролол), калийсберегающего диуретика (спиронолактон) и препаратов калия и магния аспаргината и колекальциферола. В дополнение были откорректированы назначения по изменению нутритивного статуса (назначено специализированное высококалорийное питание).
Динамика и исходы: в настоящее время пациент продолжает соблюдать все рекомендации.
Сравнение клинических случаев
Оба пациента имели подтвержденный дистрофический тип ВБЭ (патогенные варианты в гене COL7A1), однако мутации различались по характеру (гомозиготные нуклеотидные замены/дупликации) и могли влиять на выраженность клинической картины. У обоих отмечались множественные кожные поражения, поражения слизистых и хронический характер заболевания, сопровождающийся нутритивной недостаточностью различной степени тяжести. Во всех случаях диагноз ВБЭ сопровождался дефицитом массы тела, анемией (железодефицитной), а также гиповитаминозом D, что подтверждает высокую распространенность нутритивных проблем при тяжелом течении ВБЭ.
Развитие кардиомиопатии и ее фенотип
Пациентка (17 лет): зафиксировано появление тахикардии и признаков ремоделирования сердца по дилатационному типу (дилатационный фенотип кардиомиопатии, ХСН стадии 2А). После двух лет комбинированной терапии (антагонисты рецепторов ангиотензина II, β-адреноблокаторы, диуретики) отмечена положительная динамика: снижение расширения ЛЖ, улучшение сократительной способности миокарда.
Пациент (15 лет): в 2021 г. впервые диагностированы выраженные признаки дилатационного ремоделирования ЛЖ (ХСН стадии 2А) и умеренное расширение полостей сердца на фоне тяжелой белково-энергетической недостаточности. Несмотря на трехлетнюю комбинированную терапию (антагонисты рецепторов ангиотензина II, β-блокатор, диуретики), положительная динамика была незначительной; рентген и эхокардиография свидетельствовали об отсутствии прогрессирования, но и о четком улучшении функции ЛЖ не сообщалось.
Во всех случаях применяли схемы для лечения/профилактики ХСН, включающие антагонисты рецепторов ангиотензина II (лозартан), β-адреноблокаторы (бисопролол, карведилол), диуретики (спиронолактон), а также препараты, направленные на коррекцию нутритивного статуса (препараты железа, витамина D, кальция, высококалорийное энтеральное питание).
У обоих пациентов комбинированную кардиологическую терапию проводили длительно (2–3 года), при этом у пациентки Р. (клинический случай 1) отмечен заметный положительный эффект (снижение сердечно-грудного индекса, улучшение сократительной функции), тогда как у пациента М. (клинический случай 2) выраженной позитивной динамики не зарегистрировано, но признаков ухудшения состояния миокарда также не наблюдалось.
Таким образом, сопоставление клинических случаев свидетельствует о высокой значимости своевременной диагностики ранних стадий кардиального ремоделирования у пациентов с дистрофическим ВБЭ, а также о решающей роли коррекции нутритивного статуса в профилактике и лечении кардиомиопатии на фоне ВБЭ.
Заключение
Кардиомиопатия является жизнеугрожающим осложнением дистрофического ВБЭ, которое может значительно ухудшать качество жизни и прогноз заболевания. Представленные клинические случаи демонстрируют разнообразие клинических проявлений и тяжесть кардиомиопатии у детей с ДБЭ. Ранняя диагностика кардиомиопатии является важным аспектом ведения пациентов с данным заболеванием для своевременного начала терапии. С учетом данных о том, что дети с ХСН характеризуются более низким уровнем нутритивного статуса и повышенными метаболическими потребностями, а также у них могут присутствовать мальабсорбция и недостаточность питания, можно предположить, что у пациентов с ВБЭ наличие кардиомиопатии усиливает выраженность нутритивной недостаточности. В то же время сама нутритивная недостаточность, обусловленная дефицитом энергии и питательных веществ, может способствовать возникновению или прогрессированию кардиомиопатии, формируя таким образом порочный круг взаимообусловленности этих состояний. Для своевременной диагностики и коррекции ХСН у пациентов с ВБЭ необходим мультидисциплинарный подход, который включает регулярный мониторинг состояния сердечно-сосудистой системы и нутритивного статуса.
Авторы заявляют об отсутствии конфликта интересов.
R.V. Epishev, PhD, O.S. Orlova
National Medical Research Center for Children's Health, Moscow
Research Clinical Institute of Childhood, Moscow
Charity Foundation "BELA. Butterfly Children", Moscow
Contact person: Roman V. Epishev, drepishev@gmail.com
Epidermolysis bullosa (EB) is a group of rare genetic skin diseases that have in common a tendency to form blisters and/or erosions on the skin and mucous membranes due to minimal trauma. One of the most severe forms of EB is dystrophic epidermolysis bullosa (DEB), a disease caused by mutations in the COL7A1 gene, which also leads to skin fragility and blistering. In addition to dermatological manifestations, patients with DEB may develop cardiomyopathy, which significantly affects morbidity and mortality. This article presents variants of the course of cardiomyopathy in children with the dystrophic form of congenital epidermolysis bullosa.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.