Кожная и увеальная меланома: сходства и различия
- Аннотация
- Статья
- Ссылки
- English
В статье проанализировано 58 литературных и сетевых источников с использованием поисковых систем PubMed и Google Scholar, а также системы поддержки принятия врачебных решений UpToDate с ключевыми поисковыми запросами cutaneous melanoma и uveal melanoma.
В статье проанализировано 58 литературных и сетевых источников с использованием поисковых систем PubMed и Google Scholar, а также системы поддержки принятия врачебных решений UpToDate с ключевыми поисковыми запросами cutaneous melanoma и uveal melanoma.
Введение
Меланоциты являются нормальными представителями клеточного состава базального слоя эпидермиса, увеального тракта и конъюнктивы глаза, слизистых и мозговых оболочек, внутреннего уха и сердца [1]. Меланоциты относятся к производным нервного гребня – группе клеток, образующихся в ходе закрытия нервной трубки на одном из этапов эмбриогенеза [2]. Клетки нервного гребня дают начало меланобластам, которые активно мигрируют в разных направлениях, в том числе в направлении кожи и зачатков глазного яблока, где они генерируют популяцию стволовых клеток, обеспечивающих их самообновление. По мнению биологов из Medical Research Council Human Genetics Unit [2], агрессивная и метастатическая природа меланомы может объясняться, в частности, указанными свойствами.
Основная функция меланоцитов – продукция пигмента меланина, отвечающего за цвет кожи и глаз [2]. Меланоциты кожи и ее придатков, способствуя распределению меланосом в эпидермисе и волосяных фолликулах, формируют цвет кожи и волос, а также обеспечивают равномерную пигментацию и защиту от ультрафиолетового излучения (УФИ). Меланоциты радужки отвечают за цвет глаз. Роль меланоцитов цилиарного тела и хориоидеи окончательно не установлена. В экспериментах in vitro показано, что эти клетки продуцируют факторы роста эндотелия сосудов (VEGF) и некоторые ферменты (например, тканевой активатор плазминогена) [3].
Наличие меланоцитов в органах, не подверженных УФИ, позволяет предположить, что их роль обусловлена не только фотопротективными свойствами [4].
Меланоциты практически любой локализации способны к злокачественному росту. Но несмотря на общее эмбриологическое происхождение и схожие функции, биологическое поведение малигнизированных меланоцитов в разных органах и тканях неодинаково, а соответствующие злокачественные новообразования имеют различные клинические особенности.
Эпидемиология
В большинстве случаев (90%) меланома представлена кожными формами [5]. Это самый тяжелый вид рака кожи, являющийся ведущей причиной смерти в данной группе онкологических заболеваний. Меланома кожи (МК) – 19-й по распространенности вид рака, заболеваемость значительно варьируется в зависимости от региона проживания: самые высокие показатели отмечаются среди жителей Австралии (37 случаев на 100 000 населения), наиболее низкие – среди жителей Центральной и Южной Азии (0,2 случая на 100 000) [6]. В США 97,8% случаев МК приходится на белокожее население. Заболеваемость МК в России в целом ниже, чем в странах Евросоюза, США и Австралии, – 5,4 случая на 100 000 населения [7]. МК имеет самую быструю тенденцию роста заболеваемости среди других форм рака [6]. Средний возраст пациентов – 57–65 лет. Среди лиц обоего пола в возрасте до 50 лет заболевание чаще регистрируется у женщин. Вероятно, это связано с посещением соляриев и увеличенной нагрузкой солнечной радиации для получения загара [8, 9]. У лиц, достигших 55 лет, заболеваемость в зависимости от гендерной принадлежности становится примерно равной, а в более позднем возрасте чаще регистрируется у мужчин.
Меланоциты иной локализации также способны к злокачественному росту. Около 5% всех меланом представлено меланомой глаза. Из них 95% развиваются в увеальном тракте. Остальные случаи представлены меланомой конъюнктивы, которая по своей генетической природе больше схожа с МК, чем с увеальной меланомой (УМ) [6].
УМ может развиваться в хориоидее (90%), цилиарном теле (5%) и радужке (5%). В отличие от кожной формы заболеваемость УМ остается стабильной на протяжении последних 50 лет [10]. Средний возраст пациентов – 61 ± 15 лет (возрастной интервал – 3–100 лет). Мужчины этим заболеванием страдают чаще [10].
Закономерность развития УМ по этническому фактору схожа с таковой при МК: реже заболевание развивается у азиатов и лиц с темной кожей (менее одного случая на 1 млн населения). У европейского населения прослеживается прямая зависимость от широты проживания, то есть распространенность заболевания увеличивается от стран Средиземноморья (около двух случаев на 1 млн в Испании и Италии) к странам Скандинавского полуострова (более восьми случаев на 1 млн) [11].
Биология и генетика
Меланоциты кожи располагаются примерно через каждую десятую клетку базального слоя эпидермиса. По дендритным отросткам они передают меланосомы в соседние кератоциты или волосяные фолликулы [2]. Невоциты утрачивают эту способность и клонально пролиферируют, формируя скопления в виде невусов.
Формирование злокачественных меланомных новообразований начинается с небольших поверхностных опухолей, ограниченных эпидермисом. В фазе радиального (горизонтального) роста они могут вести себя либо по типу меланомы in situ, не выходя за пределы эпидермиса, либо по типу микроинвазивной меланомы с расширениями в область сосочкового слоя дермы [12]. Вертикальная фаза роста может быть следующим этапом канцерогенеза опухоли после радиальной фазы, а также первичным паттерном роста. Эта фаза подразумевает инвазивную природу опухоли: она прорастает в дерму и более глубокие ткани и уже имеет метастатический потенциал. УМ также способна к росту как в горизонтальном, так и в вертикальном направлении, что подтверждает классификация TNM.
УМ и МК характеризуются совершенно разными генетическими профилями и онкогенными мутациями. Около 10% МК имеют наследственное происхождение [4]. Основной генетический субстрат наследственных форм представлен мутациями, связанными с циклинзависимыми киназами (CDKN2A, CDK4), геном-онкосупрессором ретинобластомы RB1, генами, ответственными за восстановление ДНК (BAP1) и поддержание теломер (POT1, ACD, TERF2IP, TERT), а также генами MITF и MC1R [13, 14]. Частота наследственной формы УМ не превышает 2%. В данном аспекте важно открытие роли гена BAP1 в возникновении УМ. Мутация в этом гене вызывает развитие BAP1 (BRCA1-associated protein 1) наследственного ракового синдрома, обусловленного предрасположенностью к МК и УМ, злокачественной мезотелиоме, почечно-клеточному раку и другим злокачественным новообразованиям [15].
Основными драйверными мутациями в приобретенных МК являются гены BRAF, NRAS и NF1, в конечном итоге активирующие сигнальный путь ERK, ответственный за выживание, пролиферацию и подвижность клеток [16]. К драйверам канцерогенеза УМ прежде всего относятся мутации генов GNAQ и GNA11, ответственные за активацию множества различных сигнальных путей, в том числе ERK [4, 17].
Хромосомные нарушения в опухолевых клетках МК и УМ также различны. Клетки МК имеют очень сложные закономерности цитогенетических изменений, которые могут затрагивать более десяти различных хромосом [16]. В случае УМ большинство хромосомных нарушений представлено моносомией 3-й и/или аберрациями 8-й хромосомы [17].
Факторы риска
УФИ – ведущий фактор риска развития МК. Большинство меланом развивается на тех участках кожи, которые наиболее часто подвергаются воздействию солнечных лучей. Еще более уязвимы участки кожи, склонные к солнечным ожогам.
Метаанализ факторов риска развития МК [18] показал, что интермиттирующий характер пребывания на солнце вносит значительный вклад в развитие заболевания. Не менее важными источниками канцерогенного УФИ являются солярии и PUVA-терапия псориаза и других заболеваний кожи. У тех, кто пользуется услугами солярия более одного года, риск развития МК увеличивается на 61% [9].
Высокая интенсивность естественной пигментации кожи способствует более надежной защите тканей от УФИ. С этим связаны соответствующие фенотипические факторы риска: светлая кожа, светлый или рыжий цвет волос, голубые или зеленые глаза, склонность к веснушкам. Перечисленные факторы увеличивают риск развития МК в 2–4 раза [19].
Несмотря на то что некоторые невусы могут быть предшественниками МК, их наличие обычно рассматривается как фактор риска развития опухоли de novo. Количество невусов стойко ассоциируется с этим риском: наличие 50–100 невусов повышает риск на 5–17% [20].
Согласно теории divergent pathway, лицам с небольшим количеством невусов требуется большее количество солнечного излучения для развития МК, и наоборот [21].
Наличие в анамнезе базальноклеточного или плоскоклеточного рака кожи увеличивает не только риск развития МК, но и смертность от этого заболевания [22]. Предшествующая МК, также являющаяся фактором риска, повышает вероятность развития второй первичной опухоли в два-три раза [23]. У больных после трансплантации органов, пациентов с лимфомой, ВИЧ-инфекцией и другими иммуносупрессивными состояниями чаще развивается МК de novo, которая ассоциируется с более плохим прогнозом [24].
Многие факторы риска являются общими для УМ и МК: светлый фенотип кожи, волос и глаз, пребывание на солнечном свете, географическая широта места проживания, способность кожи к загару, наличие невусов и веснушек кожи и радужки [25]. Однако не все перечисленные факторы значимы. Наиболее существенный вклад в развитие заболевания вносят географическая широта места проживания, светлый цвет глаз, работа сварщиком, наличие атипичных кожных невусов, а также окулодермальный меланоцитоз, связанный с развитием УМ в одном из 400 случаев [26].
Вопрос воздействия УФИ как фактора риска остается дискутабельным. При выполнении крупного метаанализа [27] и секвенировании генома клеток УМ [17] установлено, что связь между заболеванием и воздействием УФИ малозначительна.
Клинические особенности
Согласно клинико-анатомической классификации, МК подразделяют на четыре основные формы – поверхностно-распространяющуюся, узловую, лентиго и акральную лентигинозную (в порядке убывания по распространенности) и более редкие формы (беспигментную, десмопластическую, меланому Шпитца, меланоцитому) [28].
Поверхностно-распространяющаяся меланома считается наиболее распространенной формой и характеризуется новообразованием темного цвета толщиной менее 1 мм. Почти в 2/3 всех случаев МК образуется de novo, без ассоциированных невусов. Между тем поверхностно-распространяющаяся форма все же чаще развивается из образовавшегося ранее невуса [29]. Узловая меланома представлена новообразованием темного цвета толщиной более 2 мм. Лентиго-меланома развивается в местах постоянного воздействия солнечного света (кожа лица и шеи), выглядит как пятно коричневого загара и медленно развивается, меняя цвет и размер. Для акральной лентигинозной меланомы характерна нетипичная локализация – ладонная и подошвенная, а также под ногтевой пластиной. Это наиболее распространенный тип меланомы среди темнокожего населения [28].
Исходя из клинической классификации, основанной на TNM, МК подразделяют на пять стадий [30]. В клинической практике также широко используются классификации по Clark Level и Breslow Depth.
Существует несколько правил клинического прогнозирования развития МК: симптом «гадкого утенка» (ugly duckling), критерии ABCDE и список Глазго. Симптом «гадкого утенка» определяется у пациентов с множественными невусами и представляет собой нетипичный вид невуса по сравнению с остальными, имеющими множество общих черт [31]. ABCDE-критерии позволяют оценить:
- A (asymmetry) – асимметрию;
- B (border irregularities) – нечеткие границы;
- C (color variegation) – многоцветность;
- D (diameter) – диаметр (> 6 мм);
- E (evolution) – изменения [32].
Британские критерии Глазго подразделяют признаки на большие (изменения в размере, форме или цвете) и малые (диаметр > 7 мм, воспаление, покрытие коркой или кровью, изменения чувствительности) [33]. При наличии одного большого или трех малых критериев пациента направляют к специалисту.
УМ классифицируется по принципу TNM, при этом ключевыми параметрами являются размер образования, вовлеченность в опухолевый процесс цилиарного тела и экстраокулярный рост. Симптомы УМ, в частности вспышки, плавающие помутнения и дефекты полей зрения, не носят патогномоничного характера.
Большинство хориоидальных и цилиарных меланом образуются de novo [34]. Существует ряд критериев оценки факторов риска озлокачествления невусов, укладывающихся в мнемоническое правило To Find Small Ocular Melanoma Using Helpful Hints Daily:
- T (thickness) – толщина (> 2 мм);
- F (fluid) – субретинальная жидкость;
- S (symptoms) – симптомы;
- O (orange pigment) – оранжевый пигмент липофусцин;
- M (margin) – в менее чем 3 мм от края диска зрительного нерва;
- UH (ultrasound hollowness) – пустоты при ультразвуковом исследовании;
- H (halo) – отсутствие ореола;
- D (drusen) – друзы и другие признаки хронических дегенеративных процессов в виде фиброза или атрофии [35].
Диагностика
Диагноз МК может быть установлен на основании физикального обследования и дополнительных диагностических методов, в частности дерматоскопии. Морфологическая верификация является окончательным этапом в постановке диагноза. Материал для гистологического исследования может быть получен путем эксцизионной или инцизионной биопсии.
Биопсия МК проводится вместе с полным удалением новообразования в пределах здоровых тканей (эксцизионная и панч-биопсия) или в качестве исключительно диагностической процедуры (инцизионная биопсия), если новообразование слишком большое для одномоментного удаления или оно имеет лицевую, акральную или слизистую локализацию. При этом инцизионная биопсия не ухудшает прогноза заболевания по показателям регионарных рецидивов и общей выживаемости [36]. Для исключения вовлеченности в патологический процесс лимфатических узлов требуется проведение биопсии сторожевого лимфатического узла [37].
Диагноз УМ основан на клинических данных, получаемых при проведении биомикроскопии с непрямой офтальмоскопией, и может быть подтвержден дополнительными методами, такими как ультразвуковое B-сканирование, ультразвуковая биомикроскопия, оптическая когерентная томография и флуоресцентная ангиография [35].
Биопсия УМ используется для получения материала для морфологического, цитогенетического и молекулярно-диагностического исследований [38, 39]. Данные методы позволяют детально проанализировать риск метастазирования УМ и прогноз заболевания с формированием соответствующих прогностических классов, а также отобрать пациентов для проведения клинических исследований эффективности лечения метастатической УМ. При этом пятилетний риск метастазирования УМ при выполнении брахитерапии с тонкоигольной аспирационной биопсией и без нее составляет 13 и 14% соответственно, что, по данным T.A. McCannel и соавт., не имеет статистически значимой разницы [40].
Для мониторинга регионарных метастазов МК необходимо проводить ультразвуковое исследование регионарных лимфатических узлов [41], для исключения метастатического поражения – лучевую диагностику в полном объеме.
Диагностические мероприятия по отслеживанию метастазов УМ представлены методами лучевой диагностики в виде магнитно-резонансной томографии брюшной полости с введением внутривенного контраста и компьютерной томографии органов грудной клетки. Частота и тип исследования зависят от вида меланомы и прогностического класса [42].
Лечение первичной опухоли
Первый шаг в лечении МК после установления диагноза – хирургическое удаление первичной опухоли. Объем удаляемой ткани, окружающей патологический очаг, зависит от толщины меланомы и наличия регионарных метастазов.
Концепция применяемого ранее сверхрадикального (> 5 см от края новообразования) иссечения МК со временем претерпела множество изменений в сторону уменьшения объемов эксцизии [43]. Удаление проводят по эллипсоидному контуру, замеры выполняют по короткой оси эллипсоида. На основании исследования Всемирной организации здравоохранения, при толщине КМ до 1 мм осуществляется эксцизия 1 см окружающей край опухоли ткани, при толщине от 1 до 2 мм – 2 см от края. При МК T3/T4 с толщиной более 2 мм данных, подтверждающих эффективность иссечения окружающих тканей на более чем 2 см, нет [44, 45].
Рецидив первичной опухоли в зоне оперативного вмешательства считается достаточно редким осложнением (менее чем 2% случаев) и ассоциирован с крайне плохим прогнозом, когда пятилетняя выживаемость составляет только 9% [45].
Известно множество различных методов лечения первичной УМ. Их применение связано с такими факторами, как размер и локализация опухоли, наличие экстраокулярного роста, влияние на зрительные функции, возраст и предпочтения пациента, наличие метастазов.
Несмотря на низкую радиочувствительность всех типов меланом [46], ведущий метод лечения УМ – лучевая терапия. При этом локальные лучевые нагрузки подразумевают сравнительно большие дозы радиации. Существуют два ведущих вида лучевой терапии – брахитерапия и протонная терапия. Они характеризуются примерно одинаковой эффективностью, но имеют свои особенности. Метод брахитерапии заключается в подшивании аппликатора с радиоактивными элементами к глазу в проекции опухоли. При этом могут использоваться различные изотопы: иод-125 (125I), иридий-192 (192Ir), палладий-103 (103Pd) и рутений-106/родий-106 (106Ru/106Rh). Наиболее распространены изотопы йода и рутений-родиевые изотопы [47]. При брахитерапии крайне важно правильно располагать радиоаппликатор и использовать методы, позволяющие контролировать соответствие локализации опухоли и радиоаппликатора. Это напрямую влияет на частоту локальных рецидивов заболевания [48, 49]. Протонотерапия позволяет оптимально распределять лучевую нагрузку на опухолевую ткань, но может наносить коллатеральный урон близлежащим структурам глаза. Использование обоих методов ассоциируется с осложнениями в виде синдрома сухого глаза, катаракты, неоваскулярной глаукомы, гемофтальма, отслойки сосудистой оболочки, увеитов, некроза склеры, лучевой ретинопатии и оптической нейропатии. Интравитреальное введение ингибиторов ангиогенеза, панретинальная лазеркоагуляция и витреоретинальная хирургия признаны эффективными методами в профилактике развития неоваскулярной глаукомы и ассоциированной с ней энуклеацией [49].
До 1970-х гг. энуклеация считалась стандартом оказания медицинской помощи больным УМ, но после сравнительных исследований выживаемости при использовании различных методов лечения роль органосохраняющих операций была пересмотрена.
Согласно результатам исследования COMS (Collaborative Ocular Melanoma Study) [47], пяти-, десяти- и 12-летняя смертность у пациентов с гистологически подтвержденными метастазами УМ составила 10, 18 и 21% соответственно в группе I-125-брахитерапии и 11, 17 и 17% соответственно в группе энуклеации. При этом общая смертность (с учетом других причин смерти) в обеих группах не имела статистически значимой разницы. В этом же исследовании преимуществ дополнительной лучевой терапии перед энуклеацией не зафиксировано. Энуклеация считается методом выбора при УМ больших размеров, экстраокулярном росте, плохом прогнозе зрительных функций (неоваскулярная глаукома, обширная отслойка сетчатки) или соответствующих предпочтениях пациента.
Локальное хирургическое лечение в виде транссклеральной или трансретинальной эндорезекции опухоли с применением методов витреоретинальной хирургии представляет собой технически сложную процедуру и используется в комбинации с лучевой терапией [50, 51]. Преимуществами такого комбинированного метода являются профилактика основных осложнений брахитерапии, увеличение шансов на сохранение глаза и уменьшение вероятности продолженного роста.
К другим методам лечения относят лазерную транспупиллярную термотерапию, фотодинамическую терапию и лазерную фотокоагуляцию. Транспупиллярная термотерапия в качестве первичного метода лечения применяется у пациентов c УМ центральной локализации и проминенцией не более 3 мм, что обеспечивает полную регрессию опухоли в 69% случаев [52]. Данный метод позволяет сохранить высокие зрительные функции и не увеличивает риск метастазирования опухоли (средний период наблюдения – 32,8 месяца). В остальных случаях отмечается неполная регрессия опухоли или отсутствие эффекта лечения. К осложнениям данного метода относятся окклюзия сосудов сетчатки, макулярный отек, эпиретинальная мембрана, гемофтальм и отслойка сетчатки. Фотодинамическая терапия используется только для беспигментных УМ малых размеров, обеспечивает контроль роста только в краткосрочной перспективе, но помогает избежать большинства осложнений, характерных для других методов [53].
Метастатическая болезнь: прогноз и лечение
Толщина опухоли – главный прогностический фактор МК. Десятилетняя выживаемость у пациентов с толщиной МК < 1 мм составляет 92%, с толщиной > 4 мм уменьшается до 50% [54]. К другим прогностическим факторам относят изъязвление поверхности опухоли и ее митотическую активность. Метастазирование МК носит лимфогенный характер, большинство метастазов находятся в коже, подкожной ткани и регионарных лимфатических узлах. Общая пятилетняя выживаемость при I стадии составляет 95–100%, II стадии – 65–92,8%, III стадии – 41–71%, IV стадии – 9–28% [55]. Отдаленные метастазы связаны с плохим прогнозом, когда показатели выживаемости измеряются не в годах, а в месяцах [54]. При метастазах в легких прогноз выживаемости несколько лучше, чем при отдаленных метастазах в других внутренних органах.
Методы лечения первичной УМ высокоэффективны и в 95% случаев предотвращают локальный рецидив заболевания. Однако метастатическая болезнь развивается примерно у половины пациентов [56]. УМ имеет гематогенный тип метастазирования. Чаще метастазы локализуются в печени (93%) и легких (24%), реже затрагиваются кожа, мягкие ткани и кости. Множественные метастазы определяются в 87% случаев [47]. К плохим прогностическим признакам, степень увеличения которых коррелирует с общей выживаемостью, относятся:
- возраст пациента;
- большие базальный размер и толщина опухоли;
- прорастание в цилиарное тело;
- экстраокулярный рост;
- эпителиоидный тип опухолевых клеток и васкулогенная мимикрия.
Вероятность развития метастатической болезни связана с толщиной опухоли: она увеличивается на 6% каждые десять лет при толщине опухоли до 1 мм, на 12–16% – при толщине 1,1–4,0 мм, на 27–29% – при толщине 4,1–7,0 мм и на 41–44% – при толщине опухоли 7,1–10,0 мм [57].
Благодаря успехам молекулярно-генетических исследований биологии меланомы в последнее десятилетие в терапии МК наметились два основных подхода: иммунологическое воздействие на опухоль и возможность направленной блокады основных сигнальных путей, специфичных для меланомы. При наличии регионарных лимфатических метастазов, подтвержденных результатами биопсии, выполняют диссекцию лимфатических узлов и назначают адъювантную иммунотерапию.
Прорыв в лечении диссеминированной меланомы кожи произошел в 2011 г., когда Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration) зарегистрировало в США два новых препарата для лечения метастатической МК – ипилимумаб и вемурафениб. По сравнению со стандартной химиотерапией на фоне применения этих препаратов увеличивается общая выживаемость пациентов с МК [58].
Сегодня активно проводятся исследования эффективности комбинаций химиотерапии, иммунотерапии и таргетной терапии. Использование лучевой терапии у пациентов с меланомой III или IV стадии имеет очень узкие показания. По мнению большинства авторов ранних исследований, меланома обладает низкой радиочувствительностью [46]. Проведение хирургической метастазэктомии возможно только при наличии единичных метастазов.
В настоящее время эффективные методы лечения метастатической УМ отсутствуют. У пациентов с метастазами, даже получающих лечение, медиана общей выживаемости не превышает 14 месяцев [56].
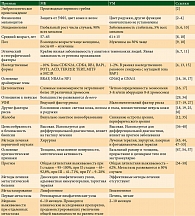
Общие и отличительные признаки МК и УМ представлены в таблице.
Авторы заявляют об отсутствии конфликта интересов. Исследование проведено без спонсорской поддержки.
A.A. Yarovoy, PhD, L.V. Demidov, PhD, Prof., I.A. Levashov, V.V. Nazarova, PhD, V.A. Yarovaya
S.N. Fyodorov Intersectoral Scientific and Technical Complex ῾Eye Microsurgery’
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Ilya A. Levashov, mesmerizz3d@gmail.com
Melanoma is a type of cancer that develops from melanocytes of various localization. Melanoma mostly occurs in the skin but the eye is nevertheless important region to consider since uveal melanoma (UM) is the most common intraocular malignancy. Some epidemiological features of cutaneous melanoma (CM) and UM are similar in nature. Melanocytes of skin and uvea have a common embryological origin, but malignant cells of these tissues behave differently in a biological manner. Apparently it is due to differences in genetic profiles and oncogenic mutations. CM and UM vary in risk factors. Diagnostic tendencies have a common focus on safety of the melanoma biopsy. Treatment methods for the primary tumor differ completely. For CM it is primarily a surgery. Among the various UM treatment modalities local radiation therapy is most often preferred. Narrowing excision margins for CM and comprehensive ophthalmological approach in patients with UM make a significant contribution to the organ-sparing treatment. Metastatic routes of CM and UM are essentially different.
Until recently, the survival of patients with metastatic disease in both melanomas was no more than a year. Breakthrough had occurred in the treatment of metastatic CM, while effective treatment is currently absent for metastatic UM. This is a narrative review of the literature with 58 references. PubMed, Google Scholar and clinical decision support resource UpToDate were used with searched keywords cutaneous melanoma and uveal melanoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.