Вектибикс в монотерапии мКРР
В 2006 г. M. Peeters и соавт. [1] впервые представили результаты исследования, в которое были включены 463 больных распространенным колоректальным раком с прогрессированием после режимов с оксалиплатином, иринотеканом и фторпиримидинами. В этом исследовании пациенты были рандомизированы в соотношении 1:1 в группы Вектибикса 6 мг/кг 1 раз в 2 недели в сочетании с наилучшим поддерживающим лечением (best supportive care – BSC) или только одного наилучшего поддерживающего лечения (контрольная группа). Лечение проводили до прогрессии заболевания или до появления признаков непереносимой токсичности. В случае прогрессии заболевания пациенты из контрольной группы наилучшего поддерживающего лечения имели возможность перейти в дополнительное исследование и получать Вектибикс в дозе 6 мг/кг 1 раз в 2 недели (такой переход был у 75% больных после прогрессирования на лучшей поддерживающей терапии).
Взаимосвязь между наличием мутаций гена KRAS и результатами лечения была оценена в ретроспективном исследовании по архивным парафинированным образцам опухолевой ткани. Из 427 (92%) пациентов, у которых проводилась оценка гена KRAS, у 184 были обнаружены мутации гена. По результатам анализа через 8 недель среди пациентов с KRAS дикого типа прогрессирование не было отмечено у 59,7% больных, получавших Вектибикс, и только у 21,0% в группе с наилучшим поддерживающим лечением (различие 38,7%; 95% ДИ 27,4–50,0). Различие в медиане времени без прогрессирования для пациентов с мутациями KRAS не было отмечено в исследуемых группах. К 8-й неделе прогрессирование не было отмечено у 21,4% больных в группе Вектибикса и у 28,0% в группе наилучшего поддерживающего лечения. Различий по общей выживаемости между группами также не было отмечено.
Среди больных с KRAS дикого типа объективный эффект составил 17% для группы Вектибикса и BSC c медианой времени продолжительности ответа 19,7 недель и 0% для группы наилучшего поддерживающего лечения. У пациентов с мутациями KRAS ни в одной группе объективных противоопухолевых эффектов зафиксировано не было. Стабилизация заболевания у пациентов с KRAS дикого типа отмечена у 34% пациентов в группе, получавшей Вектибикс, и у 12% пациентов в группе наилучшего поддерживающего лечения. Таким образом, контроль заболевания в группе больных с немутированным (диким) типом гена KRAS, получавших Вектибикс, составил 51%.
Отсутствие объективного эффекта у больных с мутантным геном KRAS, получавших Вектибикс и BSC, продемонстрировало 100% положительную прогностическую ценность в отношении отсутствия эффективности терапии Вектибиксом у этой группы больных. Эти результаты обусловливают необходимость генотипирования KRAS перед началом лечения. На основании этого исследования Вектибикс был разрешен к применению сначала FDA в США у больных мКРР с диким типом гена КRAS, а в дальнейшем в Европе и в Росии.
Вектибикс в комбинации с химиотерапией в терапии мКРР
Позднее были представлены результаты применения Вектибикса в I и II линиях терапии в сочетании с иринотеканом и оксалиплатином.
I линия терапии мКРР J.-Y. Douillard и соавт. в ноябре 2010 г. представили окончательные результаты исследования эффективности Вектибикса в сочетании с FOLFOX4 против терапии FOLFOX4 в I линии химиотерапии распространенного колоректального рака [2]. В исследование были включены 1183 пациента, у 93% которых проспективно было оценено наличие мутации гена KRAS. Мутация гена была обнаружена у 40% больных в обеих группах. Анализ эффективности был проведен в соответствии со статусом KRAS. У больных с отсутствием мутации добавление к лечению Вектибикса достоверно увеличивало время до прогрессирования (9,6 мес. против 8,0 мес.) и частоту объективного ответа (55% против 48%). Также была отмечена и тенденция к увеличению общей выживаемости (23,9 мес. против 19,7 мес., р = 0,07). У больных с мутированным геном KRAS различий в эффекте не отмечалось. Время до прогрессирования составило 7,3 мес. против 8,8 мес., общая выживаемость – 15,5 мес. против 19,3 мес.
C.H. Köhne и соавт. в 2010 г. представили результаты исследования эффективности Вектибикса в комбинации с режимом FOLFIRI у 152 больных распространенным колоректальным раком в I линии терапии [3]. Так же, как и в предыдущем исследовании, эффективность зависела от статуса гена KRAS. При сравнении больных с наличием и отсутствием мутации было показано значительное превосходство комбинации химиотерапии и Вектибикса по всем критериям у больных без мутации. Время до прогрессирования составило 8,9 мес. против 7,2 мес., частота полной и частичной ремиссии составила 56,5% против 37,9%.
II линия терапии мКРР M. Peeters и соавт. в 2010 г. представили результаты исследования Вектибикса в сочетании с режимом FOLFIRI против химиотерапии FOLFIRI [4]. В исследование были включены 1186 больных, у 55% которых был обнаружен дикий (немутированный) тип гена KRAS. При оценке эффективности, проведенной раздельно в зависимости от наличия мутации гена, было показано значительное улучшение результатов лечения при добавлении Вектибикса у больных с отсутствием мутации гена KRAS. В этой категории больных время до прогрессирования достоверно увеличивалось с 3,9 мес. до 5,9 мес., частота достижения полной и частичной ремиссии – с 10% до 35%, в то время как общая выживаемость увеличивалась с 12,5 мес. до 14,5 мес. (р = 0,12).
Ответ на вопрос об эффективности Вектибикса после прогрессирования на цетуксимабе был рассмотрен в исследовании PANERB [6]. В исследование были включены 32 пациента с распространенным колоректальным раком с нативным KRAS и прогрессированием после иринотекан-содержащих режимов и цетуксимаба. На фоне монотерапии Вектибиксом общий эффект составил 21,9%, и у 9,4% больных была отмечена стабилизация болезни. Время до прогрессирования составило 3,6 мес. Среди больных, имевших эффект на иринотекане/цетуксимабе, общий эффект составил 54,5% и стабилизация дополнительно у 18,2%. Среди первично-резистентных к цетуксимабу больных эффективность была на уровне 7,7%, и дополнительно 7,7% больных имели стабилизацию болезни.
Это одно из первых исследований по изучению перекрестной резистентности двух ингибиторов рецептора эпидермального фактора роста, демонстрирующего по меньшей мере их неполную перекрестную резистентность. L.S. Schwartzberg и соавт. [7] анонсировали исследование по сравнению эффективности I линии химиотерапии mFOLFOX6 в сочетании с Вектибиксом или бевацизумабом у 280 больных метастатическим колоректальным раком с нативным статусом KRAS. Помимо колоректального рака активность ингибиторов EGFR установлена при плоскоклеточном раке в области головы и шеи. Исследование I фазы с использованием Вектибикса в сочетании с химиотерапией карбоплатином/паклитакселом и лучевой терапией проведено L.J. Wirth и соавт. [8]. 19 больных получили лечение фиксированными еженедельными введениями карбоплатина и Вектибикса. 3 пациента получали паклитаксел 15 мг/м2 еженедельно, остальные 16 – паклитаксел 30 мг/м2 и лучевую терапию. При оценке было установлено 95% клинических полных ремиссий, и при медиане наблюдения в течение 21 мес. у этих больных рецидива болезни не отмечено.
Помимо исследований при распространенном колоректальном раке и раке в области головы и шеи проводится оценка активности Вектибикса при раке желудка (исследование REAL-3) [9], холангиокарциноме [10] и раке яичников [11]. Также довольно активно исследуются комбинации Вектибикса с другими препаратами таргетной терапии. Несколько исследований проводятся по изучению комбинации Вектибикса, мотесаниба (AMG 706, пероральный ингибитор ангиогенеза) и химиотерапии: FOLFIRI, FOLFOX [12]; карбоплатин/паклитаксел [13]; цисплатин/гемцитабин [14]. Интересное исследование комбинации Вектибикса и AMG 102 (моноклонального антитела против фактора роста гепатоцитов) проводится C. Eng и соавт. [15]. В исследование включены 18 больных с распространенным колоректальным раком и диким (немутированным) типом гена KRAS. Максимальная переносимая доза на 6 дозовых уровнях не достигнута, и для исследования выбран режим Вектибикс 6 мг/кг и AMG 102 10 мг/кг каждые 2 недели.
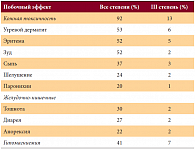
J. Sarantopoulos и соавт. [16] в исследовании IВ фазы оценили побочные эффекты комбинации AMG 479 (моноклонального антитела против инсулиноподобного фактора роста) и Вектибикса 6 мг/кг каждые 2 недели или гемцитабина 1000 мг/м2, в дни 1, 8, 15-й каждые 4 недели у 18 больных рефрактерными солидными опухолями. Дозой AMG выбрано 12 мг/кг каждые 2 недели. У одного больного раком толстой кишки и диким (немутированным) типом гена KRAS отмечена частичная ремиссия после прогрессирования на цетуксимабе. Основным побочным эффектом Вектибикса является кожная токсичность, имеющая различные проявления. M. Peeters и соавт. [17] обобщили побочные эффекты применения Вектибикса на основе проведенных ранее исследований, включавших 902 больных. Помимо проявлений кожной токсичности у больных отмечались тошнота/рвота, диарея и лабораторный феномен, выражавшийся в гипомагниемии. Данные представлены в таблице 1.
Как видно из таблицы, кожная токсичность отмечалась у подавляющего большинства больных, однако выраженной степени она достигала редко (13%). В анализе исследований, включавших 2503 пациентов, проведенном A. Shaker и соавт. [18], было показано, что сочетание с химиотерапией значительно повышает риск развития выраженной кожной токсичности (III–IV степени) (p < 0,001). В то же время было отмечено отсутствие различий в развитии кожных проявлений любой степени как в монотерапии, так и в комбинации с химиотерапией. В этой связи были разработаны средства терапии и профилактики кожной токсичности, включавшие в себя использование увлажняющих кремов, кремы от ультрафиолетового излучения, местные стероиды и в некоторых случаях доксициклин.
В исследовании E.P. Mitchell и соавт. [19] оценена эффективность этих средств (исследование STEPP). Больные на фоне монотерапии Вектибиксом были рандомизированы на профилактическое применение (сразу после 1 дозы Вектибикса) и на терапию возникших проявлений кожной токсичности. При оценке результатов в группе с профилактическим применением средств было отмечено двукратное уменьшение частоты кожных реакций II и более степени и значительное улучшение качества жизни на фоне лечения Вектибиксом.
Заключение
Таким образом, можно отметить, что в настоящее время Вектибикс показал свою эффективность на всех этапах лечения больных распространенным колоректальным раком с диким (немутированным) типом гена KRAS, определение которого является обязательным при решении вопроса о терапии с включением Вектибикса.
Исследования по его применению при других злокачественных опухолях продолжаются, одновременно изучается взаимосвязь эффективности Вектибикса и статуса гена KRAS при других опухолях. Вероятнее всего, профилактика дерматологической токсичности позволит уменьшить клинические проявления и тяжесть основного побочного класс-связанного эффекта Вектибикса.