Алимта (пеметрексед): эффективность при солидных опухолях
- Аннотация
- Статья
- Ссылки

Новый многоцелевой антиметаболит Алимта (пеметрексед) представляет собой антифолат, механизм действия которого заключается в ингибировании синтеза пуринов и пиримидинов. Основной спектр побочных реакций, возникающих при терапии пеметрекседом, наблюдается со стороны системы кроветворения, пищеварительного тракта, а также в виде дерматологических проявлений. Так, нейтропения (3–4-я степень токсичности) наблюдается у 5% больных, фебрильная нейтропения – у 1,9%; диарея возникает у 12,8% пациентов (все степени, 3–4-я степень – у 0,4%); стоматиты наблюдаются у 14,7% пациентов (все степени, 3–4-я степень – у 1,1%); кожная сыпь – у 15% больных (все степени) [1]. При использовании Алимты для снижения риска гематологической токсичности обязательным является назначение фолатов и витамина В12, для профилактики кожной сыпи – кортикостероидов. Роль препаратов фолиевой кислоты и витамина В12 в профилактике побочных действий была впервые продемонстрирована в исследовании активности Алимты при злокачественной мезотелиоме.
Обоснование такого подхода было представлено C. Niyikiza и соавт. [2], кроме того, показано, что применение указанных средств не влияет на противоопухолевую активность Алимты и ее метаболизм. Однако в 2011 г. A. Horiike и соавт. [3] опубликовали данные, содержащие оценку влияния уровня гомоцистеина в сыворотке крови на частоту побочных эффектов у 52 больных немелкоклеточным раком легкого (НМРЛ), получавших монотерапию Алимтой в стандартной дозе в сочетании с профилактическими мерами. Было показано, что частота гематотоксичности положительно коррелирует с уровнем гомоцистеина независимо от профилактических мероприятий. Таким образом, применение фолатов и витамина В12 значительно уменьшает частоту побочных реакций, возникающих при терапии Алимтой; в то же время определение уровня гомоцистеина может быть полезным в отношении прогноза частоты и выраженности побочных эффектов.
Такие показатели эффективности в сочетании с невыраженными побочными действиями дали основания для проведения сравнительного исследования Алимты и доцетаксела, являющегося стандартом 2-й линии химиотерапии. В 2004 г. N. Hanna и соавт. [1] опубликовали результаты исследования эффективности терапии Алимтой в дозе 500 мг/м2 по сравнению с доцетакселом в дозе 75 мг/м2 у 571 больного с НМРЛ, которые ранее получали химиотерапию с включением препаратов платины. При оценке эффективности было показано, что медиана времени до прогрессирования составила 2,9 мес. в обеих группах, а общая выживаемость – 8,3 мес. против 7,9 мес. соответственно. Полная и частичная ремиссии были зарегистрированы в 9,1% и 8,8% случаев соответственно.
Таким образом, установлена равная эффективность обоих препаратов, однако у больных, получавших Алимту, значительно реже развивались побочные эффекты 3–4-й степени (нейтропения наблюдалась у 5,3% больных против 40,2%, р < 0,001; фебрильная нейтропения отмечена в 1,9% случаев против 12,7%, р < 0,001). Меньшему числу больных, получавших Алимту, требовалось наблюдение в клинике и применение гранулоцитарного колониестимулирующего фактора (ГКСФ). Полученные результаты послужили основанием для регистрации Алимты в качестве препарата 2-й линии химиотерапии НМРЛ как в США, так и в России.
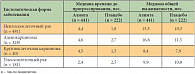
Активность Алимты при НМРЛ в 1-й линии терапии была исследована G.V. Scagliotti и соавт. [8] в рандомизированном исследовании CONSORT с участием 1725 больных НМРЛ, ранее не получавших химиотерапию. Больным назначали цисплатин 75 мг/м2 каждые 21 день и Алимту 500 мг/м2 каждые 21 день или гемцитабин 1250 мг/м2 в 1-й и 8-й дни. Результаты исследования показали, что при всех гистологических типах опухоли медиана общей выживаемости составила 10,3 мес. в обеих группах. Значения медианы времени до прогрессирования в группах были близкими: 4,8 мес. у больных, получавших цисплатин/Алимту, против 5,1 мес. у получавших цисплатин/гемцитабин. Частота ответа на терапию также незначительно различалась: 30,6% против 28,2% соответственно. Однако при оценке эффективности терапии в зависимости от гистологического типа опухоли было установлено, что при неплоскоклеточном раке режим «цисплатин/Алимта» был достоверно более эффективным (табл. 1).
Таким образом, при неплоскоклеточном раке (аденокарцинома или крупноклеточный рак) показатели общей выживаемости на фоне терапии цисплатином/Алимтой значительно превышали результаты применения схемы «цисплатин/гемцитабин». В то же время при плоскоклеточной форме НМРЛ преимущество демонстрирует схема с гемцитабином. В отношении частоты побочных эффектов 3–4-й степени показано, что на фоне химиотерапии цисплатином/Алимтой значительно реже отмечались нейтропения (в том числе фебрильная), анемия и тромбоцитопения. Различий в частоте диареи выявлено не было.
Зависимость эффективности Алимты от гистологического типа опухоли была подтверждена и в комбинированном анализе двух исследований 1-й и 2-й линии терапии. Было установлено, что при неплоскоклеточном типе опухоли эффективность лечения в группе Алимты выше, чем в контрольных группах, тогда как при плоскоклеточной форме заболевания такая терапия менее эффективна. Результаты химиотерапии в группах сравнения (цисплатин/гемцитабин или доцетаксел) не зависели от морфологии опухоли [9]. На основании данных этого исследования представилось возможным рекомендовать режим «цисплатин/Алимта» в 1-й линии химиотерапии у больных неплоскоклеточным типом опухоли. Обычная длительность проведения 1-й линии химиотерапии составляет 4–6 курсов платиносодержащих режимов. Принято считать, что большее число курсов не увеличивает возможности контроля роста опухоли, но повышает риск возникновения побочных эффектов.
M.H. Cohen и соавт. [10] опубликовали результаты исследования, в ходе которого оценивалась эффективность поддерживающей химиотерапии Алимтой после проведения 4 курсов индукционной химиотерапии с платиновыми дублетами (цисплатин/карбоплатин в сочетании с гемцитабином, винорелбином, паклитакселом или доцетакселом). В исследование было включено 663 пациента. Группы больных были сопоставимы по возрасту, полу, расе, анамнезу курения, морфологии опухоли (плоскоклеточный тип рака составлял около 23% случаев). Среди больных с плоскоклеточной формой опухоли было меньше женщин (16% против 31%), выходцев из Азии (14% против 27%) и никогда не куривших (16% против 30%). Пациенты получали Алимту 500 мг/м2 каждые 21 день в сочетании с профилактическими мерами, описанными выше, или плацебо. При оценке результатов после 4 курсов терапии у 50% больных была отмечена полная или частичная ремиссия и у 50% – стабилизация течения опухолевого процесса. Эффективность поддерживающей терапии была продемонстрирована по всем параметрам: медиана времени до прогрессирования составила 4,0 мес. против 2,0 мес., общая выживаемость – 13,4 мес. и 10,6 мес. Результаты, полученные при оценке эффективности терапии в зависимости от гистологического типа опухоли, представлены в таблице 2.
Очевидно, что использование Алимты при неплоскоклеточных формах рака легкого наиболее эффективно, что дополнительно подтверждается отсутствием различий общей выживаемости и времени до прогрессирования при плоскоклеточном раке. Эти результаты позволили зарегистрировать показания к проведению поддерживающего лечения Алимтой после индукционной химиотерапии при неплоскоклеточных формах НМРЛ.
В 2011 г. были опубликованы результаты исследования PARAMOUNT (L.G. Paz-Ares и соавт.) [11] с участием 939 больных с неплоскоклеточной формой рака легкого, получавших 4 индукционных курса химиотерапии «Алимта + цисплатин». Больные с выявленным объективным ответом на лечение или стабилизацией процесса (n = 539) рандомизировались на группы в отношении 2:1 и получали поддерживающую терапию Алимтой в обычном режиме или плацебо соответственно. Медиана времени до прогрессирования после рандомизации составила 3,9 мес. против 2,6 мес. Таким образом, высокая противоопухолевая активность Алимты при неплоскоклеточных формах рака легкого была показана во всех проведенных исследованиях.
В 2006 г. были опубликованы данные о том, что активность тимидилатсинтетазы (основной мишени антиметаболитов, в том числе и Алимты) при НМРЛ была значительно выше при плоскоклеточной форме рака, чем при аденокарциноме (показано как на уровне мРНК при ПЦР, так и экспрессии белка при ИГХ) [12]. Подобные результаты были получены и японскими авторами [13]. Эти исследования позволяют понять причину низкой активности Алимты при плоскоклеточном раке легкого и в то же время открывают возможность отбора пациентов, основываясь не только на гистологическом типе, но и на уровне тимидилатсинтетазы.
Несмотря на очевидную эффективность Алимты при НМРЛ, изучение эффективности препарата при других типах опухолей проходило не столь активно. Исследования проводились при мелкоклеточном раке легкого (в сочетании с платиновыми препаратами) [14, 15], раке поджелудочной железы (в комбинации с гемцитабином) [16], раке молочной железы (после применения антрациклинов и таксанов, в сочетании с гемцитабином) [17], раке желудка (в комбинации с оксалиплатином) [18], распространенном колоректальном раке (во 2-й линии терапии, в комбинации с иринотеканом) [19], раке яичников (в сочетании с карбоплатином в 1-й линии терапии) [20].
В настоящее время проводятся несколько исследований по изучению активности Алимты при НМРЛ (исследования NCT00497315, NCT00248495, NCT00269152, NCT00545948, NCT00923637 на ClinicalTrials.gov). Вызывает интерес оценка эффективности Алимты при опухолях, чувствительных к антиметаболитам (колоректальный рак, рак желудка, рак молочной железы). Таким образом, на сегодняшний день установлено, что Алимта высокоэффективна в 1-й и 2-й линиях химиотерапии неплоско-клеточных форм рака легкого, а также при поддерживающем лечении и отличается низкой частотой возникновения побочных эффектов.
