Таргетная терапия при распространенном немелкоклеточном раке легкого
- Аннотация
- Статья
- Ссылки

В России ежегодно раком легкого заболевают более 60 тыс. человек. Среди мужчин каждый четвертый больной со злокачественной опухолью – это больной раком легкого. К моменту установления диагноза более 75% всех больных раком легкого имеют местно-распространенный или метастатический процесс. По данным ВОЗ, на разных этапах лечения до 80% больных раком легкого нуждаются в химиотерапии (XT). Немелкоклеточный рак легкого (НМРЛ – плоскоклеточный рак, аденокарцинома, крупноклеточный рак) составляет 80–85% от всех форм рака легкого. Химиотерапия при НМРЛ проводится при распространенном процессе (IIIВ и IV стадии), а также как предоперационная (индукционная, неоадъювантная) при II–IIIА стадиях и послеоперационная (адъювантная) – после радикально проведенного оперативного лечения.
До 90-х гг. прошлого столетия среди активных препаратов при НМРЛ были такие, как цисплатин, доксорубицин, метотрексат и др. Их эффективность в монотерапии не превышала 20%. С введением в клиническую практику таких цитостатиков, как паклитаксел (Таксол), доцетаксел (Таксотер), гемцитабин (Гемзар), винорельбин (Навельбин), иринотекан (Кампто), медиана выживаемости с 6,5 мес. увеличилась до 1 года, однолетняя выживаемость при комбинации этих препаратов с платиновыми производными увеличилась почти в 2 раза – с 25% до 40–50%. Стандартами современной химиотерапии при НМРЛ являются следующие комбинации:
- Гемзар + цисплатин;
- Гемзар + карбоплатин;
- Таксол + цисплатин;
- Таксол + карбоплатин;
- Гемзар + Навельбин;
- Таксотер + цисплатин;
- Навельбин + цисплатин;
- Этопозид + цисплатин;
- Алимта + цисплатин.
Эффективность этих схем лечения 40–60%, при этом 10–15% больных с распространенным НМРЛ живут 2 года и более. И хотя в настоящее время нет общего консенсуса о предпочтительном выборе схемы лечения для первой линии химиотерапии НМРЛ, однако в Европе и других странах используется чаще всего схема Гемзар + цисплатин, а в США – Таксол + карбоплатин.
Таргетная терапия НМРЛ
Острая необходимость разработки новых лекарственных препаратов с одновременным развитием знаний о молекулярных законах онкогенеза привели к открытию лекарств, которые нацелены на процессы, участвующие в опухолевом росте, такие как ангиогенез и рецептор эпидермального фактора роста. Как известно, ангиогенез является важным фактором роста опухоли и ее метастазирования. При формировании новых кровеносных сосудов увеличивается скорость пролиферации опухолевых клеток и роста опухоли. Поэтому выявление различных ангиогенных факторов стало задачей онкологов-исследователей. Одним из этих факторов является сосудистый эндотелиальный фактор роста (VEGF), который отвечает за стимуляцию формирования новых кровеносных сосудов. Усиление экспрессии VEGF отмечается при многих злокачественных опухолях, и в том числе при раке легкого. Увеличение концентрации VEGF коррелирует с неблагоприятным прогнозом, с уменьшением выживаемости без прогрессирования и общей выживаемости [1–6].
2. Эрлотиниб (Тарцева) относится к числу наиболее активных ингибиторов EGFR, экспрессия которого сочетается с высоким риском развития метастазов, резистентности к химиотерапии, снижением общей и безрецидивной выживаемости. Механизм действия Тарцевы заключается в прямом ингибировании тирозинкиназного рецептора EGFR и подавлении пролиферации клеток, зависящих от EGFR, блокируя этим самым клеточный цикл в фазе G1.
При НМРЛ Тарцева изучалась в монотерапии в качестве второй линии лечения по сравнению с Таксотером и Алимтой. Результаты исследования показали, что Тарцева обладает одинаковой активностью с этими двумя цитостатиками. В двух крупных исследованиях – TRIBUTE и TALENT – Тарцеву применяли в комбинации с Таксолом и карбоплатином, а также Гемзаром и цисплатином. В этих исследованиях не было получено увеличения эффективности и выживаемости по сравнению с одной химиотерапией. Увеличение выживаемости было получено в исследовании BR.21, в котором 731 больной получал Тарцеву в дозе 150 мг ежедневно либо плацебо. Медиана выживаемости без прогрессирования, медиана общей выживаемости и однолетняя выживаемость были статистически достоверно большими в группе с Тарцевой (р < 0,001).
В большом исследовании TRUST было показано, что при приеме Тарцевы в дозе 150 мг в день до прогрессирования у 2724 больных НМРЛ в качестве второй линии лечения объективный эффект был достигнут у 14% пациентов, а стабилизация процесса – у 54%. Авторы рекомендуют прием Тарцевы как альтернативу второй линии лечения больных НМРЛ. Различные исследования подтвердили хорошую переносимость и умеренную токсичность Тарцевы. Сыпь и диарея являются наиболее частыми побочными явлениями, но они бывают умеренными и слабовыраженными. При этом в высоком проценте случаев отмечается стабилизация заболевания, что в значительной степени влияет на увеличение выживаемости при лечении Тарцевой. Особенно этот факт актуален для пожилых пациентов, которые не могут перенести химиотерапию или химиолучевую терапию [13–21].
V. Miller и соавт. (2008) изучили эффективность Тарцевы при бронхоальвеолярном раке (БАР) и аденокарциноме у 101 больного. Общий эффект (частичная ремиссия) был отмечен у 22% больных. При чистом БАР эффект был получен у 20% с медианой выживаемости 4 мес., а при аденокарциноме и с подтипами БАР – у 23%, 19 мес. соответственно. У больных с мутациями EGFR частичная ремиссия была у 83% с медианой выживаемости 23 мес. Мутации EGFR ассоциировались с частотой объективного эффекта и выживаемостью без прогрессирования. Авторы указывают на роль гистологического диагноза и молекулярных характеристик при лечении НМРЛ [22]. На основании вышеуказанных данных Тарцева была разрешена к применению у больных НМРЛ IIIB и IV стадий, лечившихся без эффекта в первой и второй линии.
Сенсационной стала работа T.S. Mok и соавт., в которой 1217 больных, никогда не куривших, с аденокарциномой легкого были в III фазе клинического исследования рандомизированы на две группы – первая группа получала Ирессу (609 чел.), а вторая группа – Таксол с карбоплатином (608 чел.). В первой группе у 24,9% не было отмечено прогрессирования болезни в течение 1 года, а во второй группе – лишь у 6,7% (р = 0,0001). У пациентов с мутациями EGFR был большой безрецидивный период. Объективный эффект был соответственно 43% и 32% (р = 0,0001), а у больных с мутациями EGFR – 47,3% и 23,5% (р = 0,0013). Это исследование было основанием для рекомендации применения Ирессы в первой линии лечения у больных с аденокарциномой легкого с мутациями EGFR [36].
В последние годы была отмечена закономерность применения различных таргетных препаратов в зависимости от гистологического строения НМРЛ. Так, мультитаргетный препарат Алимта показал лучшие отдаленные результаты и рекомендован при неплоскоклеточном раке для первой и второй линии химиотерапии, а также для поддерживающей химиотерапии. Алимта является новым многоцелевым препаратом из группы антифолатов с усовершенствованным механизмом действия: активируется преимущественно в клетках опухоли за счет процесса полиглутамации и блокирует несколько фолатзависимых ферментов по сравнению с антиметаболитами предыдущего поколения, которые ингибируют только один фермент [37].
Эффективность Алимты была продемонстрирована в крупномасштабном рандомизированном исследовании III фазы с участием 1725 пациентов по оценке комбинации Алимта (пеметрексед) + цисплатин по сравнению с комбинацией Гемзар (гемцитабин) + цисплатин в качестве первой линии терапии распространенного НМРЛ. Дизайном исследования был предусмотрен анализ зависимости результатов лечения от гистологического варианта НМРЛ. Результаты исследования показали, что в группах аденокарциномы и крупноклеточного рака комбинация Алимта + цисплатин продемонстрировала статистически значимое увеличение общей выживаемости по сравнению с комбинацией Гемзар + цисплатин. Медиана общей выживаемости у пациентов с аденокарциномой составила 12,6 мес. в группе Алимта + цисплатин по сравнению с 10,9 мес. в группе Гемзар + цисплатин (р = 0,03). Подобно этому у пациентов с крупноклеточным раком медиана общей выживаемости составила 10,4 мес. в группе Алимта + цисплатин по сравнению с 6,7 мес. в группе Гемзар + цисплатин (р = 0,03). В группе терапии Алимтой и цисплатином значительно реже регистрировались нейтропения, анемия и тромбоцитопения 3–4-й степени тяжести (p ≤ 0,001), фебрильная нейтропения (p = 0,002) и алопеция (p < 0,001) по сравнению с группой Гемзара/цисплатина. Кроме того, использование заместительной трансфузионной терапии (эритроцитарная масса и тромбоцитарная масса) и гемопоэтических факторов роста было достоверно ниже в группе Алимта + цисплатин по сравнению с группой Гемзар + цисплатин [38].
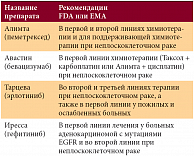
Алимта включена в стандарты терапии Европейского общества медицинской онкологии ESMO (2010) и в рекомендации Национальной образовательной сети по лечению рака NCCN (версия 2011 г.) в качестве первой линии терапии в комбинации с цисплатином, поддерживающей терапии и монотерапии второй линии у пациентов с местнораспространенным и метастатическим неплоскоклеточным НМРЛ. Авастин рекомендован для первой линии лечения в комбинированной химиотерапии Таксол + цисплатин (карбоплатин) также у больных с неплоскоклеточным раком. Иресса и Тарцева продемонстрировали лучший эффект при аденокарциноме легкого. Другие препараты (цетуксимаб, сорафениб, мотесаниб) еще не получили подтверждения для применения при НМРЛ. В заключение приводим таблицу 2 о показаниях к применению отдельных таргетных препаратов при НМРЛ.
