количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Лечение атопического дерматита: преимущества такролимуса перед топическими глюкокортикостероидами
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 2 (19)
- Аннотация
- Статья
- Ссылки
- English
Рассмотрены механизмы действия, показания к применению, побочные эффекты топических глюкокортикостероидов (ТГКС) и топического ингибитора кальциневрина такролимуса. На основании данных литературы показано, что такролимус по силе противовоспалительного эффекта сопоставим с ТГКС умеренной активности, не обладает атрофогенным эффектом и может использоваться для длительной поддерживающей терапии. Представлены результаты собственного исследования с участием 36 пациентов в возрасте от 18 до 38 лет с атопическим дерматитом (АтД) средней и тяжелой степени. В ходе исследования оценивали клиническую эффективность и переносимость 0,1%-ной мази такролимуса при лечении АтД в составе комплексной терапии. Определяли частоту рецидивов заболевания в течение года у пациентов, ответивших на лечение. Применение мази такролимуса способствовало высокому суммарному проценту клинического выздоровления и значительного улучшения (88,9%), а также быстрому достижению положительного эффекта (на 7-й день). Показана высокая активность препарата в качестве средства длительной поддерживающей терапии.

Таблица. Динамика индекса SCORAD и ДИКЖ в процессе лечения
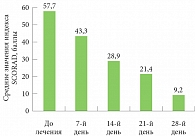
Рис. 1. Средние значения индекса SCORAD до лечения и на 7, 14, 21, 28-й день терапии
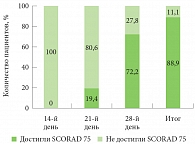
Рис. 2. Количество пациентов, достигших (не достигших) показателя SCORAD 75 в ходе лечения и за весь период исследования
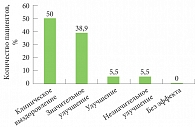
Рис. 3. Эффективность препарата Протопик на 28-й день комплексного лечения АтД (относительно всех больных, n = 36)
Внедрение топических глюкокортикостероидов (ТГКС) в клиническую практику стало своеобразной революцией в дерматологии. С 1952 г., когда M. Sulzberger и V. Witten применили гидрокортизон – первый эффективный препарат из этой группы [1], ТГКС считаются основными лекарственными средствами для лечения воспалительных дерматозов. Терапевтическая эффективность местных ГКС возросла за счет индукции двойной связи между первой и второй молекулами углерода, а также за счет образования эфира с жирными кислотами в позиции С-17 или С-21. Галогенизация (фтором или хлором) в позиции С-6-альфа и С-9-альфа также усиливает эффект данных препаратов [2, 3]. В настоящее время в арсенале врача-дерматовенеролога имеется достаточно широкий спектр ТГКС различной степени активности.
Концентрация ТГКС повышается в зоне воспалительного процесса, поэтому они не оказывают существенного супрессивного воздействия на центральную иммунную и другие системы организма, что позволяет избегать серьезных побочных реакций [4].
Действие ТГКС направлено на основных участников воспалительной реакции – медиаторы воспаления, сосуды и иммунокомпетентные клетки. Препараты характеризуются противовоспалительным, антиаллергическим, иммуносупрессивным и антипролиферативным эффектами. Механизм действия ТГКС достаточно сложен и связан как с активацией экспрессии различных генов, отвечающих за синтез противовоспалительных белков (липокортина, нейтральной эндопептидазы, ингибитора секреции лейкоцитов, антагониста рецепторов интерлейкина (ИЛ) 1) [5], так и с супрессией транскрипции провоспалительных цитокинов (ИЛ-1–6, 8, 11, 12, фактора некроза опухоли альфа, гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ)), ферментов (циклооксигеназы, фосфолипазы А2), эндотелина-1, молекул адгезии и других факторов [6].
Таким образом, применение ТГКС обоснованно при всех иммуноопосредованных заболеваниях кожи, в том числе при атопическом дерматите (АтД).
АтД – один из наиболее распространенных воспалительных дерматозов. Заболеваемость им среди населения разных стран, как правило, составляет не менее 5–10%, в индустриально развитых государствах – около 20%. У детей АтД уже давно является лидирующей патологией [7–10].
Иммуногенез АтД определяется особенностями генетически запрограммированного иммунного ответа на антиген под воздействием различных провоцирующих факторов. Длительная экспозиция антигена, стимуляция T-хелперов II типа, продукция аллергенспецифических IgE антител, дегрануляция тучных клеток, эозинофильная инфильтрация и воспаление, усиливаемые повреждением кератиноцитов вследствие расчесов, приводят к хроническому воспалению в коже, которое играет важнейшую роль в патогенезе кожной гиперреактивности [11–13].
ТГКС действительно считаются препаратами выбора при лечении обострений АтД, однако для профилактики рецидивов не используются в силу того, что обладают атрофогенным эффектом и угнетают размножение фибробластов и их активность в отношении синтеза коллагена. Помимо атрофии кожи и подкожно-жировой клетчатки ТГКС способны вызывать и другие побочные эффекты: гипертрихоз, телеангиэктазии, стероидные акне, застойную гиперемию, замедленное заживление ран, присоединение вторичной инфекции (грибковой, вирусной, бактериальной). Длительное применение этих препаратов, особенно в детском возрасте, может привести и к системным проявлениям – задержке роста, артериальной гипертензии, синдрому Кушинга [4].
Несмотря на широкий спектр побочных эффектов, у ТКГС долгое время не существовало альтернативных препаратов, обладающих соизмеримым с ними терапевтическим эффектом и хорошей переносимостью. На сегодняшний день подобными свойствами характеризуется препарат из группы ингибиторов кальциневрина, обладающий избирательным иммуносупрессивным действием, – такролимус (Протопик®, «Астеллас Фарма Юроп Б.В.», Нидерланды). Препарат относится к классу топических ингибиторов кальциневрина и предназначен для наружной терапии среднетяжелого и тяжелого АтД. Такролимус выпускается в форме 0,03%-ной мази для детей (от двух лет), а также 0,1%-ной мази для взрослых.
Такролимус, впервые синтезированный в Японии в 1980-е гг. из почвенных бактерий Streptomyces tsukubaensis, имеет макролидную структуру, подобную циклоспорину А.
Преимущество препарата заключается в том, что он способен проникать через поврежденную кожу. Это обусловливает его местное применение при воспалительных заболеваниях кожи. Избирательное действие такролимуса в коже основано на ингибировании фосфатазной активности кальциневрина, торможении транскрипции генов и подавлении локальной продукции провоспалительных цитокинов (ИЛ-2, 4, 5, ГМ-КСФ и др.). Кроме того, под влиянием такролимуса происходит ингибирование высвобождения медиаторов воспаления из тучных клеток, базофилов и эозинофилов, снижение экспрессии FcεRI (высокоаффинного поверхностного рецептора для IgE) на клетках Лангерганса, а следовательно, уменьшение их активности [14, 15].
Преимущество препарата заключается в том, что он способен проникать через поврежденную кожу. Это обусловливает его местное применение при воспалительных заболеваниях кожи. Избирательное действие такролимуса в коже основано на ингибировании фосфатазной активности кальциневрина, торможении транскрипции генов и подавлении локальной продукции провоспалительных цитокинов (ИЛ-2, 4, 5, ГМ-КСФ и др.). Кроме того, под влиянием такролимуса происходит ингибирование высвобождения медиаторов воспаления из тучных клеток, базофилов и эозинофилов, снижение экспрессии FcεRI (высокоаффинного поверхностного рецептора для IgE) на клетках Лангерганса, а следовательно, уменьшение их активности [14, 15].
Основным преимуществом наружных ингибиторов кальциневрина перед ТГКС является низкая частота развития побочных эффектов и соответственно возможность их длительного применения. Мазь такролимуса не влияет на синтез коллагена, не вызывает атрофии кожи. Всасывание такролимуса в системный кровоток при местном применении минимально [9, 16].
Положительные свойства такролимуса изучали в многочисленных клинических исследованиях с участием взрослых и детей от двух лет. Препарат продемонстрировал эффективность по сравнению как с плацебо, так и со стандартной наружной терапией (местные ГКС, увлажняющие средства) [17–22]. При этом отмечалось уменьшение частоты обострений АтД и потребности в ТГКС, что свидетельствовало о стероидсберегающем эффекте. Установлено, что такролимус не воздействует на гипоталамо-гипофизарно-надпочечниковую систему, не подвергается метаболизму, не накапливается в коже даже при длительном применении, не влияет на содержание церамидов в роговом слое эпидермиса [23]. В настоящее время уже свыше 20 млн больных во всем мире применяют мазь такролимуса для профилактики и лечения обострений АтД различной степени тяжести [24].
Как показали результаты исследований, по силе действия такролимус сопоставим с ТКГС сильного (III) класса по Европейской классификации (гидрокортизона 17-бутиратом, флутиказона пропионатом) и значительно превосходит слабые и умеренные ТКГС (гидрокортизона ацетат, алклометазона дипропионат) [25, 26]. В одном из крупномасштабных исследований (с участием 1000 пациентов с умеренным и тяжелым АтД) продемонстрировано, что при лечении такролимусом в течение шести месяцев обострения возникали только у 11% больных. В то же время в группе, получавшей гидрокортизна 17-бутират, частота рецидивов составила 26% (р = 0,01). Кроме того, в группе такролимуса по сравнению с группой ТГКС доля пациентов, достигших показателя клинической ремиссии и значительного улучшения, была выше (р < 0,001) [27].
В нашей стране был проведен ряд исследований эффективности такролимуса при АтД у небольших групп пациентов. Согласно полученным данным препарат действительно обладает высокой эффективностью и безопасностью как у взрослых, так и у детей. Продемонстрированы высокая приверженность лечению и значительное улучшение показателей качества жизни больных АтД [28–30]. На фоне лечения такролимусом улучшалась микроциркуляция в коже [31].
На кафедре кожных и венерических болезней Военно-медицинской академии им. С.М. Кирова было проведено исследование клинической эффективности, переносимости и профилактической эффективности препарата Протопик в форме мази у больных АтД средней и тяжелой степени.
Основная цель исследования – оценить клиническую эффективность 0,1%-ной мази Протопик при лечении АтД в составе комплексной терапии. Кроме того, в ходе исследования определяли частоту рецидивов АтД в течение года у пациентов, ответивших на лечение, при поддерживающей монотерапии такролимусом (два раза в неделю) и оценивали безопасность и переносимость мази Протопик у больных АтД.
Материал и методы исследования
Критериями включения в проспективное открытое исследование стали возраст от 18 до 60 лет, обострение АтД средней и тяжелой степени. Все участники подписали информированное согласие.
Критерии исключения: период беременности и кормления грудью, наружное применение ГКС в течение 14 дней до даты включения в исследование.
Все пациенты, участвовавшие в первоначальном визите и соответствовавшие критериям включения/исключения, вошли в одну группу. Длительность исследования составила четыре недели, длительность периода последующего наблюдения – один год.
Контрольные осмотры проводили в начале исследования (визит 1), через одну, две, три и четыре недели терапии (визиты 2–5). В период наблюдения визиты проводили в случае обострения заболевания. Контрольный визит осуществлялся спустя год после окончания терапии.
В основу исследования легли:
- сбор медицинского анамнеза;
- комплексная клиническая
- оценка;
- определение индекса SCORAD (SCORing Atopic Dermatitis – комплексная оценка симптомов и проявлений атопического дерматита) и ДИКЖ (дерматологический индекс качества жизни);
- итоговая оценка эффективности и переносимости препарата (врачом);
- регистрация нежелательных явлений;
- мнение больных об эффективности и безопасности препарата.
Итоговая оценка эффективности и переносимости препарата выносилась на визите 5 (28-й день терапии) и складывалась из следующих параметров: клинического выздоровления, значительного улучшения, улучшения, незначительного улучшения, без эффекта, ухудшения.
Пациенты, достигшие показателей клинического выздоровления и значительного улучшения, включались в группу наблюдения. Они наносили 0,1%-ную мазь Протопик два раза в неделю на участки тела, которые обычно поражаются при обострениях заболевания.
Нежелательные явления классифицировали по условной шкале:
- 1 балл – побочный эффект, требующий отмены препарата и проведения дополнительных медицинских мероприятий;
- 2 балла – нежелательный побочный эффект, оказывающий значительное отрицательное влияние на состояние больного и требующий отмены препарата;
- 3 балла – побочные эффекты, оказывающие влияние на состояние пациента и не требующие отмены препарата;
- 4 балла – незначительные побочные эффекты, не вызывающие серьезных проблем у пациента и не требующие отмены препарата;
- 5 баллов – отсутствие побочных эффектов.
В исследовании участвовали 36 пациентов (амбулаторно и стационарно) обоего пола в возрасте от 18 до 38 лет с установленным диагнозом АтД (20 (55,5%) мужчин и 16 (44,5%) женщин). Все больные составили одну группу, получавшую комплексную терапию – общую и наружную. Общая терапия включала антигистаминные, десенсибилизирующие, седативные препараты (по показаниям), средства, нормализующие микрофлору кишечника (по показаниям). Наружную терапию проводили с применением 0,1%-ной мази Протопик. Пациентам были рекомендованы гипоаллергенная диета и ограничение контакта с бытовыми аллергенами.
В течение всего периода исследования 0,1%-ную мазь такролимуса наносили два раза в сутки на очаги поражения (с захватом здоровой кожи). При достижении клинической ремиссии препарат наносили два раза в неделю на участки кожи, обычно поражаемые при обострениях.
Эффективность лечения оценивали по клинической картине, динамике индекса SCORAD, ДИКЖ, субъективным ощущениям пациента. Учитывалось также мнение больных об эффективности и удобстве применения препарата.
Результаты и их обсуждение
При обследовании больных АтД кожные проявления заболевания соответствовали клинике данного дерматоза и характеризовались очагами поражения с преимущественной локализацией в области лица, шеи, сгибательных поверхностей конечностей. Диагноз АтД устанавливали на основании клинических диагностических критериев, предложенных J. Hanifin и G. Rajka в 1980 г. [32].
У 24 (66,7%) пациентов заболевание впервые проявилось в раннем детстве (детская экзема или диатез в анамнезе), у 8 (22,2%) – в возрасте старше десяти лет, у 4 (11,1%) – в возрасте старше 25 лет. Аллергические заболевания в семейном анамнезе отмечали 29 (80,6%) больных, 18 (50,0%) обследованных указывали на сезонные обострения в осенне-весенний период, 10 (27,8%) испытывали ухудшение в зимний период, у 6 (16,4%) заболевание носило непрерывно-рецидивирующий характер.
Факторы, способствовавшие возникновению рецидивов АтД:
- стресс – 22 (61,1%) пациента;
- нарушения в диете – 8 (22,2%);
- острые респираторные заболевания, ангина – 4 (11,1%);
- сезонные изменения погоды – 2 (5,6%) пациента.
Распределение по площади поражения кожного покрова:
- до 10% – 2 (5,6%) пациента;
- от 10 до 20% – 22 (61,1%);
- более 20% – 12 (33,3%) больных.
По степени тяжести течения заболевания больные АтД распределились следующим образом:
- средняя (индекс SCORAD 30–60 баллов) – 24 (66,7%) больных, среднее значение в группе 52,5 ± 5,46;
- тяжелая (индекс SCORAD > 60 баллов) – 12 (33,3%) пациентов, среднее значение в группе 65,5 ± 5,43.
Больных с легкой степенью (индекс SCORAD 0–30 баллов) не было.
В таблице представлены данные, свидетельствующие о динамике индекса SCORAD и ДИКЖ. Статистически значимые различия по индексу тяжести течения АтД (группа до лечения и во время лечения) получены уже на 7-й день терапии (p < 0,05).
Максимальные значения достигнуты на 28-й день (p < 0,001). ДИКЖ к концу лечения снизился почти в три раза (p < 0,001), что свидетельствовало об улучшении качества жизни пациентов.
Максимальные значения достигнуты на 28-й день (p < 0,001). ДИКЖ к концу лечения снизился почти в три раза (p < 0,001), что свидетельствовало об улучшении качества жизни пациентов.
Наглядно динамика снижения индекса SCORAD представлена на рис. 1. На фоне комплексного лечения отмечалось достаточно выраженное и быстрое снижение индекса SCORAD, что говорило о быстрой положительной динамике на фоне терапии. К 14-му дню значение индекса тяжести течения АтД уменьшилось вдвое, а на 28-й день – более чем в пять раз.
Эти факты подтверждаются достижением 88,9% пациентов показателя SCORAD 75 (снижение индекса SCORAD более чем на 75% от исходных показателей) (рис. 2).
По окончании 28-дневного курса лечения проводили итоговую оценку эффективности и переносимости препарата. У 18 (50%) больных высыпания полностью разрешились (за исключением вторичных пятен, незначительной сухости кожи), у 14 (38,9%) определялось значительное улучшение, у 4 (5,5%) – улучшение и незначительное улучшение. Случаев без эффекта и ухудшения не отмечено (рис. 3).
Эффективность противорецидивной терапии (два раза в неделю) оценивали у 32 пациентов, достигших показателей «клиническое выздоровление» и «значительное улучшение». У 20 пациентов в течение года обострений не было, у 11 зафиксировано одно обострение, у одного пациента – два.
В период исследования зарегистрировано два случая нежелательных явлений (НЯ):
1) выраженное жжение кожи после нанесения препарата (оценка по шкале НЯ – 3 балла, препарат не отменен, жжение прошло самостоятельно через две недели);
2) остиофолликулит лица через три недели применения препарата (оценка по шкале НЯ – 3 балла, препарат не отменен, состояние купировано нанесением антибактериальной мази).
Частота НЯ – 5,5%, безопасность оценена как высокая.
Переносимость и косметическую приемлемость оценивали как отличную 26 (72,2%) пациентов, хорошую – 6 (16,7%), удовлетворительную – 4 (11,1%). При этом 13 (41,7%) больных жаловались на чувство жжения после нанесения мази в течение первых трех дней терапии, которое проходило самостоятельно.
Заключение
Результаты проведенного клинического исследования показали, что препарат Протопик в форме мази высокоэффективен и безопасен в составе комплексной терапии АтД средней и тяжелой степени, о чем свидетельствовал высокий суммарный процент клинического выздоровления и значительного улучшения (88,9%), а также быстрое достижение положительного эффекта (на 7-й день). Побочные эффекты, характерные для ТГКС, не отмечены, что значительно расширяет возможности лечения пациентов с данным заболеванием. Показана высокая активность препарата в качестве средства длительной поддерживающей терапии.
Протопик в форме мази можно рекомендовать для широкого применения не только в стационаре, но и в амбулаторных условиях.
1. Sulzberger M.B., Witten V.H. The effect of topically applied compound F in selected dermatoses // J. Invest. Dermatol. 1952. Vol. 19. № 2. P. 101–102.
2. Европейское руководство по лечению дерматологических болезней / под. ред. А.Д. Кацамбаса, Т.М. Лотти. М.: МЕДпресс-информ, 2008.
3. Хэбиф Т.П. Кожные болезни: диагностика и лечение. М.: МЕДпресс-информ, 2008.
4. Свирщевская Е.В., Матушевская Е.В. Сравнительный анализ эффективности и безопасности фторированных и хлорированных топических глюкокортикостероидов // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2010. Т. 3. № 3. С. 76–80.
5. Barnes P.J. New directions in allergic diseases: mechanism-based anti-inflammatory therapies // J. Allergy. Clin. Immunol. 2000. Vol. 106. № 1. Pt. 1. P. 5–16.
6. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем / под ред. А.А. Кубановой, В.И. Кисиной. М.: Литтерра, 2005.
7. Кунгуров Н.В., Герасимова Н.М., Кохан М.М. Атопический дерматит. Типы течения, принципы терапии. Екатеринбург: Уральский университет, 2000.
8. Leung D.Y., Bieber T. Atopic dermatitis // Lancet. 2003. Vol. 361. № 9352. P. 151–160.
9. Горланов И.А., Заславский Д.В., Милявская И.Р. и др. Детская дерматовенерология: учебник для медицинских вузов. М.: Издательский центр «Академия», 2012.
10. Paller A.S., Eichenfield L.F., Kirsner R.S. et al. Three times weekly tacrolimus ointment reduces relapse in stabilized atopic dermatitis: a new paradigm for use // Pediatrics. 2008. Vol. 122. № 6. P. e1210–1218.
11. Кочергин Н.Г. Атопический дерматит, чувствительные участки кожи и выбор наружной терапии // Вестник дерматолологии и венерологии. 2009. № 4. P. 80–85.
12. Sehgal V.N., Srivastava G., Dogra S. Atopic dermatitis: current options and treatment plan // Skinmed. 2010. Vol. 8. № 6. P. 335–344.
13. Дерматовенерология. Национальное руководство / под ред. Ю.К. Скрипкина, Ю.С. Бутова, О.Л. Иванова. М.: ГЭОТАР-Медиа, 2011.
14. Nghiem P., Pearson G., Langley R.G. Tacrolimus and pimecrolimus: from clever prokaryotes to inhibiting calcineurin and treating atopic dermatitis // J. Am. Acad. Dermatol. 2002. Vol. 46. № 2. P. 228–241.
15. Ellis C.N., Drake L.A., Prendergast M.M. et al. Cost-effectiveness analysis of tacrolimus ointment versus high-potency topical corticosteroids in adults with moderate to severe atopic dermatitis // J. Am. Acad. Dermatol. 2003. Vol. 48. № 4. P. 553–563.
16. Hultsch T., Kapp A., Spergel J. Immunomodulation and safety of topical calcineurin inhibitors for the treatment of atopic dermatitis // Dermatology. 2005. Vol. 211. № 2. P. 174–187.
17. Ruzicka T., Bieber T., Schöpf E. et al. A short-term trial of tacrolimus ointment for atopic dermatitis. European Tacrolimus Multicenter Atopic Dermatitis Study Group // N. Engl. J. Med. 1997. Vol. 337. № 12. P. 816–821.
18. Hanifin J.M., Ling M.R., Langley R. et al. Tacrolimus ointment for the treatment of atopic dermatitis in adult patients: part I, efficacy // J. Am. Acad. Dermatol. 2001. Vol. 44. Suppl. 1. P. S28–38.
19. Paller A., Eichenfield L.F., Leung D.Y. et al. A 12-week study of tacrolimus ointment for the treatment of atopic dermatitis in pediatric patients // J. Am. Acad. Dermatol. 2001. Vol. 44. Suppl. 1. P. S47–57.
20. Reitamo S., Harper J., Bos J.D. et al. 0.03% Tacrolimus ointment applied once or twice daily is more efficacious than 1% hydrocortisone acetate in children with moderate to severe atopic dermatitis: results of a randomized double-blind controlled trial // Br. J. Dermatol. 2004. Vol. 150. № 3. P. 554–562.
21. Arkwright P.D., Gillespie M.C., Ewing C.I., David T.J. Blinded side-to-side comparison of topical corticosteroid and tacrolimus ointment in children with moderate to severe atopic dermatitis // Clin. Exp. Dermatol. 2007. Vol. 32. № 2. P. 145–147.
22. Kim K.H., Kono T. Overview of efficacy and safety of tacrolimus ointment in patients with atopic dermatitis in Asia and other areas // Int. J. Dermatol. 2011. Vol. 50. № 9. P. 1153–1161.
23. Paslin D., Wertz P. A study to determine the effect of tacrolimus on ceramide levels in the stratum corneum of patients with atopic dermatitis // Int. J. Dermatol. 2006. Vol. 45. № 4. P. 352–356.
24. Nakagawa H. Comparison of the efficacy and safety of 0.1% tacrolimus ointment with topical corticosteroids in adult patients with atopic dermatitis: review of randomised, double-blind clinical studies conducted in Japan // Clin. Drug. Investig. 2006. Vol. 26. № 5. P. 235–246.
25. Reitamo S., Rustin M., Ruzicka T. et al. Efficacy and safety of tacrolimus ointment compared with that of hydrocortisone butyrate ointment in adult patients with atopic dermatitis // J. Allergy. Clin. Immunol. 2002. Vol. 109. № 3. P. 547–555.
26. Reitamo S., Van Leent E.J., Ho V. et al. Efficacy and safety of tacrolimus ointment compared with that of hydrocortisone acetate ointment in children with atopic dermatitis // J. Allergy. Clin. Immunol. 2002. Vol. 109. № 3. P. 539–546.
27. Beck L.A. The efficacy and safety of tacrolimus ointment: a clinical review // J. Am. Acad. Dermatol. 2005. Vol. 53. № 2. Suppl. 2. P. S165–170.
28. Воронина В.Р., Пампура А.Н. Применение 0,03% мази такролимуса при атопическом дерматите у детей // Российский вестник перинатологии и педиатрии. 2012. Т. 57. № 6. С. 42–48.
29. Прошутинская Д.В., Бутарева М.М., Иноятова Л.А. Новые возможности терапии атопического дерматита у детей и взрослых // Вестник дерматологии и венерологии. 2013. № 3. С. 78–82.
30. Кочергин Н., Мельниченко А., Билалова У. Качество жизни и приверженность лечению при атопическом дерматите // Врач. 2011. № 13. С. 74–76.
31. Соколовский Е.В., Монахов К.Н., Аксенова О.И. Эффективность и переносимость 0,1% мази такролимуса при лечении больных атопическим дерматитом средней степени тяжести, влияние препарата на микроциркуляцию в коже // Вестник дерматологии и венерологии. 2012. № 4. C. 85–89.
32. Hanifin J., Rajka G. Diagnostic features of atopic dermatitis // Acta Derm. Venereol. Suppl. 1980. Vol. 92. P. 44–47.
Treatment of atopic dermatitis: advantages of using tacrolimus compared to topical glucocorticosteroids
A.V. Samtsov, A.V. Sukharev, A.V. Patrushev
Kirov Military Medical Academy, Saint-Petersburg
Contact person: Aleksandr Vladimirovich Patrushev, alexpat2@yandex.ru
Mode of action, indications for administration, and side effects of topical glucocorticosteroids (TG) as well as topical calcineurin inhibitor tacrolimus are discussed. Based on available publications it was shown that tacrolimus is comparable with moderate activity TG in terms of their anti-inflammatory strength, has no atrophogenic effect and may be used for a long-term maintenance therapy. We provide the results of personal study conducted on 36 patients, aged 18–38 years, with moderate and severe atopic dermatitis (AD). Clinical efficacy and tolerability of tacrolimus 0.1% ointment as a part of a combination therapy upon treatment of AD were assessed. Annual incidence rate of relapses in patients responded to therapy was measured. Administration of tacrolimus ointment contributed both to high cumulative percentage of clinical recovery and significant improvement (88.9%) as well as rapid achievement of positive effect (on day 7). In addition, this drug was shown to have a high activity during a long-term maintenance therapy.
Новости на тему
29.01.2021
29.07.2015
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.