Метастатический гормоночувствительный рак молочной железы в постменопаузе: новые тенденции. Петербургский онкологический форум «Белые ночи – 2015». Сателлитный симпозиум компании «АстраЗенека»
- Аннотация
- Статья
- Ссылки
В рамках форума 9 июня 2015 г. состоялся симпозиум, организованный при поддержке компании «АстраЗенека». Специалисты-онкологи обсудили актуальные проблемы лечения рака молочной железы у больных в постменопаузальном периоде, продемонстрировали преимущества применения фулвестранта при гормоночувствительных опухолях.
В рамках форума 9 июня 2015 г. состоялся симпозиум, организованный при поддержке компании «АстраЗенека». Специалисты-онкологи обсудили актуальные проблемы лечения рака молочной железы у больных в постменопаузальном периоде, продемонстрировали преимущества применения фулвестранта при гормоночувствительных опухолях.


Выбор терапии при метастатическом гормоночувствительном раке молочной железы в постменопаузе
Вопросы выбора оптимального метода терапии метастатического рака молочной железы (РМЖ) у женщин в постменопаузальном периоде подробно рассмотрел Пьер-Франко КОНТЕ (Университет г. Падуя, Италия). Он подчеркнул, что при распространенном (метастатическом) раке молочной железы гормональная терапия является предпочтительным вариантом для большинства пациенток.
В рекомендациях Национальной сети многопрофильных онкологических центров США (National Comprehensive Cancer Network, NCCN) указано, что у многих женщин с гормонопозитивным РМЖ при прогрессировании заболевания хорошего лечебного эффекта удается добиться при последовательном применении нескольких режимов эндокринной терапии. Именно поэтому пациентки с подобной опухолью, отвечающие на гормональное лечение либо уменьшением массы (размеров) опухоли, либо длительной стабилизацией процесса, при прогрессировании заболевания должны получать последующую гормонотерапию1.
Гормонотерапия считается эффективным методом лечения гормонопозитивного рака даже при наличии висцеральных метастазов в отсутствие резистентности к гормонотерапии2.
Таким образом, гормонотерапия – основной вид лечения больных гормоночувствительным РМЖ. Исключение составляют два случая – клинически агрессивное течение заболевания, требующее более быстрого эффекта, и наличие сомнений в чувствительности опухоли к эндокринной терапии3.
Согласно результатам исследований, у пациенток с гормонопозитивным метастатическим РМЖ лечение следует начинать не с химиотерапии, а с эндокринной терапии. Сказанное не распространяется на случаи быстро прогрессирующего заболевания. Химиотерапия характеризуется более высокой частотой объективных ответов, но различий в общей выживаемости в группах химиотерапии и гормонотерапии нет. Данные клинических исследований показывают, что эндокринная терапия, как правило, менее токсична4.
Часть больных с гормонопозитивным распространенным РМЖ первоначально получают химиотерапию – до достижения наилучшего ответа. Решение о проведении химиотерапии основывается на клинических показаниях, включающих массивное поражение внутренних органов, рецидив во время или вскоре после адъювантной гормонотерапии, симптоматические метастазы. По окончании курса химиотерапии такие пациентки должны получать поддерживающую гормонотерапию.
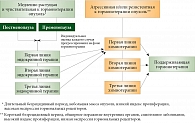
В одном из исследований оценивали общую выживаемость больных от начала химиотерапии первой линии в зависимости от поддерживающей гормональной терапии. Было показано увеличение медианы общей выживаемости (48,08 месяца) в группе больных с поддерживающей гормонотерапией по сравнению с пациентками группы без гормонотерапии (30,03 месяца)5. Алгоритм лечения гормонопозитивного/HER2 (human epidermal growth factor receptor-2)-негативного распространенного РМЖ представлен на рис. 1.
Докладчик отметил, что при назначении лечения необходимо учитывать стадию болезни, морфологическую картину опухоли, индивидуально оценивать каждый случай прогрессирования заболевания на фоне гормональной терапии.
В настоящее время, исходя из традиционных подходов к лечению гормонопозитивного РМЖ, висцеральные метастазы не являются противопоказанием к проведению эндокринной терапии. Во второй версии международных согласительных рекомендаций Европейского общества медицинской онкологии (European Society for Medical Oncology – ESMO) по распространенному раку молочной железы ABC2 (Advanced Breast Cancer 2) висцеральный криз определяется как выраженное нарушение функции органов на основании клинических признаков или данных лабораторных анализов на фоне быстрого прогрессирования заболевания.
По мнению экспертов, висцеральный криз – это не просто наличие висцеральных метастазов, а серьезное нарушение функции внутренних органов, при котором имеются клинические показания к терапии с быстрым эффектом, когда существует риск, что сменить терапию в случае прогрессирования будет невозможно6.
Анализ применения гормональной терапии в лечении гормонопозитивного/HER2-негативного РМЖ продемонстрировал, что в США из 19 120 больных только 60% получили первую линию гормонотерапии, а в Европе из 399 больных – 69%. До первой линии химиотерапии в США в 44% случаев применяют одну линию гормонотерапии, в 12% – две линии и только в 4% – три и более. В Европе в 62% случаев применяют одну линию гормонотерапии, в 7% – две. Предполагается, что использование нескольких линий гормонотерапии в США и Европе при гормонопозитивном/HER2-негативном метастатическом РМЖ ограниченно. Это может быть обусловлено относительно невысокой активностью стандартных гормональных режимов после прогрессирования заболевания на фоне применения нестероидных ингибиторов ароматазы в ранних клинических исследованиях7, 8.
В клинических исследованиях новых режимов гормонотерапии во второй линии (фулвестранта в дозе 500 мг, а также гормонотерапии в комбинации с таргетными препаратами) были получены более обнадеживающие показатели клинической эффективности, беспрогрессивной и общей выживаемости.
Алгоритм лечения гормонопозитивного/HER2-негативного метастатического РМЖ в постменопаузе включает оценку:
-
локализации и распространенности заболевания и его симптомов; гормонального статуса;
-
HER2-статуса;
-
временных интервалов без признаков заболевания и без лечения;
-
общего состояния больного.
При использовании у пациенток с гормонопозитивным метастатическим РМЖ гормонотерапии первой линии медиана времени без прогрессирования может достигать 12–15 месяцев, второй линии – 6–8 месяцев, третьей – 3–4 месяца. При отсутствии эффекта от гормонотерапии или угрозе жизни больной целесообразен переход к первой линии химиотерапии.
Следует отметить, что в случае ранее регистрировавшегося эффекта гормонотерапии повышается вероятность ответа на последующие линии гормонального лечения.
Тем не менее при всех гормонопозитивных опухолях рано или поздно развивается резистентность к гормональному лечению (вторичная гормональная резистентность). Резистентность к гормональной терапии может быть первичной (присутствует с самого начала) или вторичной (заболевание прогрессирует после ответа на проведенную терапию). Сегодня стратегия лечения метастатического РМЖ направлена на своевременное выявление заболевания, увеличение общей выживаемости, повышение качества жизни больных и снижение токсичности лечения с учетом первичной и приобретенной резистентности.
В настоящее время одним из наиболее распространенных исследований, используемых в диагностике большинства онкологических заболеваний, является биопсия. Биопсия метастазов при рецидиве позволяет уточнить прогноз заболевания и индивидуализировать лечение.
Докладчик привел результаты исследования с участием больных РМЖ, которым выполнили биопсию очагов, подозрительных на рецидив, для определения профиля опухоли. При этом рецидивирование РМЖ отмечалось в 119 случаях. В исследовании оценивали прогностическое значение несоответствия в рецепторном статусе между первичной и рецидивирующей опухолью молочной железы. Установлено, что фенотип опухоли может изменяться в ходе прогрессирования РМЖ9. Экспрессия рецепторов к половым гормонам считается одним из наиболее информативных прогностических критериев при РМЖ. Снижение экспрессии рецепторов к эстрогенам и прогестерону служит неблагоприятным фактором прогноза, ассоциированным с метастазированием10.
При гормонопозитивном/HER2-негативном распространенном РМЖ применяют такие препараты, как тамоксифен, анастрозол, летрозол, эксеместан, фулвестрант. Кроме того, в настоящее время изучается эффективность комбинаций препаратов. Новые варианты лечения включают такие комбинации, как анти-HER2-препараты + ингибиторы ароматазы при гормонопозитивной/HER2-положительной опухоли, фулвестрант 500 мг после ингибитора ароматазы, эверолимус + эксеместан после нестероидных ингибиторов ароматазы. Исследуются комбинации CDK4/6 ингибитор + ингибитор ароматазы, CDK4/6 ингибитор + фулвестрант 500 мг, ингибиторы PARP для гормонопозитивных опухолей с мутацией BRCA.
Таким образом, результаты исследований показывают, что, если опухоль не демонстрирует первичную гормонорезистентность, эффективно последовательное применение нескольких линий гормонотерапии – антиэстрогенов (тамоксифен, фулвестрант), ингибиторов ароматазы.
В заключение П.-Ф. Конте подчеркнул, что в свете новых стандартов адъювантной терапии и новых эффективных видов лечения распространенного РМЖ следует пересмотреть определения первичной и вторичной гормональной резистентности11.
Новые возможности эндокринной терапии метастатического рака молочной железы
Старший научный сотрудник отдела терапевтической онкологии НИИ онкологии им. Н.Н. Петрова, доцент кафедры Северо-Западного государственного медицинского университета им. И.И. Мечникова, д.м.н. Татьяна Юрьевна СЕМИГЛАЗОВА рассказала о современных методах эндокринной терапии метастатического РМЖ. Она отметила, что сохранение качества жизни при лечении этого заболевания остается одной из важнейших целей терапии.
Современный подход к молекулярно-генетической классификации РМЖ позволяет выделить следующие биологические подтипы заболевания: люминальный А, люминальный В, HER2-позитивный (нелюминальный) и трижды негативный.
При гормонозависимых формах РМЖ (люминальный А, люминальный В) опухолевые клетки содержат рецепторы к стероидным гормонам – эстрогенам или прогестерону. При этом люминальный гормонозависимый подтип РМЖ встречается в 65–75% случаев.
Наличие эстрогеновых рецепторов служит предиктором ответа на планируемую эндокринную терапию12.
С момента первого применения овариоэктомии в 1896 г. гормонотерапия РМЖ претерпела значительные изменения. В арсенале современной гормонотерапии достаточно большое количество препаратов – от классического препарата тамоксифена до ингибиторов ароматазы, агонистов рилизинг-гормонов и антипрогестинов. С 1994 г. в практику лечения РМЖ введены чистые антиэстрогены, представляющие собой соединения как стероидной, так и нестероидной природы и лишенные эстрогеновой активности.
Тамоксифен конкурентно связывает рецептор эстрогена, приводя к уменьшению транскрипции генов, регулируемых эстрогеном. Он блокирует фазу G1 клеточного цикла и замедляет пролиферацию. Больным, получающим тамоксифен, показано каждые три месяца выполнение ультразвукового исследования малого таза для определения толщины эндометрия.
Наряду с гормонотерапией тамоксифеном вторым значимым компонентом лечения больных гормонопозитивным РМЖ являются ингибиторы ароматазы третьего поколения. Как известно, эти препараты способны значительно влиять на плотность костной ткани у пациенток. Поэтому даже в отсутствие метастазов в костях пациентки, принимающие препараты ингибиторов ароматазы, должны находиться под наблюдением эндокринолога. При снижении показателей денситометрии им один раз в полгода показано введение остеомодифицирующих агентов.
Согласно метаанализу 35 рандомизированных клинических исследований, проведенному в 1990-е гг. и включавшему 5160 больных, тамоксифен был признан стандартом гормонотерапии. Результаты кохрейновского анализа (2009 г.), в котором сравнивали ингибиторы ароматазы и другие препараты эндокринной терапии в первой линии лечения РМЖ, продемонстрировали преимущество ингибиторов ароматазы у пациенток в постменопаузальном периоде13. Тем не менее к данным результатам нужно относиться с осторожностью, поскольку более чем у 30–40% пациенток был неизвестен рецепторный статус.
Для улучшения результатов лечения эстроген-чувствительных форм РМЖ разработана новая группа препаратов – чистые антиэстрогены. Представитель этой группы фулвестрант относится к стероидным антиэстрогенам. В отличие от тамоксифена он обеспечивает более полное подавление функции рецепторов эстрогенов и не оказывает эстрогенного эффекта на матку.
В клинической практике используется доза 500 мг один раз в месяц внутримышечно с нагрузочной дозой 500 мг в 14-й день первого месяца14. По словам Т.Ю. Семиглазовой, такая форма введения препарата облегчает объективный контроль за соблюдением режима терапии.
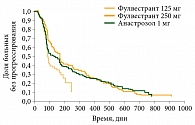
Изучению эффективности и безопасности фулвестранта посвящен ряд исследований. Так, в ранних клинических исследованиях III фазы (0020/0021) оценивали эффективность фулвестранта (Фазлодекс®) в сниженной дозе 250 мг ежемесячно и ингибитора ароматазы третьего поколения (анастрозола) у постменопаузальных пациенток с ER+ метастатическим РМЖ, прогрессирующим на фоне приема адъювантной гормональной терапии или гормональной терапии первой линии. Были проанализированы результаты терапии 428 больных, принимавших фулвестрант 250 мг, и 423 пациенток, получавших анастрозол15.
Как показали результаты, фулвестрант в дозе 250 мг в месяц не уступает анастрозолу по времени до прогрессирования заболевания.
В исследовании № 0020 при уменьшении дозы фулвестранта до 125 мг в месяц отмечалось снижение эффективности препарата (рис. 2)16.
Дополнительные свидетельства зависимости эффекта фулвестранта от дозы получены в исследовании NEWEST неоадъювантной терапии у пациенток в постменопаузе с эстроген-чувствительными опухолями. Сравнивали высокие (500 мг) и низкие дозы (250 мг) фулвестранта с помощью биологических маркеров.
Основным маркером эффективности неоадъювантной терапии является индекс Ki-67. В исследовании снижение индекса Ki-67 для 500 и 250 мг составило 78 и 47% соответственно. Показано, что после четырех недель терапии фулвестрантом экспрессия биологических маркеров снижалась в обеих группах, но в группе больных, получавших фулвестрант 500 мг, эффективность препарата была выше17.
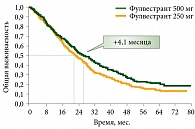
Результаты международного двойного слепого исследования III фазы в параллельных группах CONFIRM подтвердили предположения о повышении эффективности при увеличении дозы и послужили основанием для регистрации препарата фулвестрант в дозе 500 мг. В исследовании участвовали женщины в постменопаузе с положительным эстроген-рецепторным статусом после проведенной адъювантной гормонотерапии или гормонотерапии первой линии тамоксифеном либо ингибиторами ароматазы. Показано, что применение препарата в более высокой дозе – 500 мг в первый день, 14-й, 28-й дни и далее ежемесячно эффективнее, чем использование препарата в дозе 250 мг в месяц. Выявлено статистически значимое уменьшение риска прогрессирования заболевания на 20% на фоне применения фулвестранта (Фазлодекс®) в дозе 500 мг по сравнению с дозой 250 мг. Отмечено увеличение однолетней выживаемости без прогрессирования с 25 до 34%, а также увеличение медианы общей выживаемости на 4,1 месяца (снижение риска смерти на 19%) (рис. 3). Преимущество дозы 500 мг наблюдалось независимо от возраста больных, наличия или отсутствия висцеральных метастазов, варианта предшествующей терапии (ингибиторы ароматазы или антиэстрогены), а также ответа на нее. При этом увеличение дозы фулвестранта практически не повлияло на частоту нежелательных явлений и не привело к нарастанию риска развития ишемических сердечно-сосудистых событий.
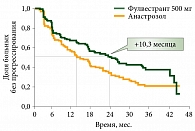
В исследовании II фазы FIRST сравнивали эффективность фулвестранта 500 мг с ингибитором ароматазы анастрозолом в первой линии у больных распространенным гормонозависимым РМЖ. В группе фулвестранта по сравнению с группой анастрозола было зарегистрировано увеличение медианы времени до прогрессирования на 10,3 месяца (с 13,1 до 23,4 месяца), а также увеличение медианы общей выживаемости на 5,7 месяца (с 48,4 до 54,1 месяца) (рис. 4)15.
Таким образом, в исследованиях показано преимущество повышения дозы препарата фулвестрант (Фазлодекс®) до 500 мг для лечения эстроген-рецептор-положительного метастатического РМЖ у женщин в постменопаузальном периоде. Фазлодекс® продемонстрировал эффективность в первой линии лечения и результативность, не уступающую ингибиторам ароматазы. Как во второй, так и в первой линии терапии применение фулвестранта в дозе 500 мг привело к статистически значимому увеличению медианы общей выживаемости на 4,1 и 5,7 месяца.
Т.Ю. Семиглазова рассказала о применении новых комбинаций гормональных и таргетных препаратов в терапии метастатического РМЖ и остановилась на ряде клинических исследований эффективности подобных режимов.
В рандомизированном двойном слепом исследовании III фазы BOLERO-2 с участием постменопаузальных пациенток с гормоночувствительным HER2-негативным распространенным РМЖ, резистентным к терапии нестероидными ингибиторами ароматазы, отмечалось значительное увеличение выживаемости без прогрессирования при добавлении эверолимуса к стероидному ингибитору ароматазы эксеместану18. К сожалению, различия в выживаемости без прогрессирования не привели к существенному увеличению общей выживаемости19.
В исследовании II фазы PALOMA-1 наблюдалось статистически значимое увеличение выживаемости без прогрессирования заболевания на десять месяцев при добавлении палбоциклиба (ингибитор CDK4/6) к летрозолу в первой линии у пациенток в постменопаузе с местнораспространенным или метастатическим РМЖ, экспрессирующим рецепторы эстрогенов, в отсутствие экспрессии HER2-20.
Указанные результаты были сравнимы с результатами, полученными в исследовании FIRST при замене анастрозола в первой линии фулвестрантом в дозе 500 мг (увеличение медианы времени до прогрессирования на 10,3 месяца)21. При этом добавление таргетных препаратов к фулвестранту в дозе 500 мг в исследованиях второй и последующих линий позволило дополнительно увеличить медиану выживаемости без прогрессирования с 3,7 до 7,4 месяца в исследовании II фазы FERGI (фулвестрант 500 мг + ингибитор PI3K пиктилисиб, подгруппа ЭР+ и ПрР+) и с 3,8 до 9,2 месяца в исследовании III фазы PALOMA-3 (фулвестрант 500 мг + палбоциклиб).
В заключение Т.Ю. Семиглазова подчеркнула, что применение фулвестранта в дозе 500 мг в комбинированной терапии РМЖ демонстрирует высокую эффективность. Перспективой лекарственного лечения метастатического РМЖ является активное внедрение современных методов эндокринной терапии.
Заключение
На сегодняшний день основной целью лечения метастатического РМЖ являются предупреждение прогрессирования и объективный контроль над заболеванием с использованием методов гормональной терапии. Фулвестрант (Фазлодекс®, компания «АстраЗенека») – представитель нового класса стероидных антиэстрогенов, ингибирующих пролиферативные эффекты эстрогенов на чувствительные ткани. Препарат действует как высокоселективный антагонист эстрогенных рецепторов, полностью блокирует эффекты эстрогенов и не проявляет при этом эстрогеноподобной активности.
В экспериментальных исследованиях фулвестрант продемонстрировал благоприятный профиль безопасности, хорошую переносимость пациентками и отсутствие серьезных побочных реакций, в том числе при использовании в комбинации с таргетной терапией.
Применение препарата в лечении больных метастатическим РМЖ способствует повышению общей выживаемости и отдаляет сроки прогрессирования заболевания.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.