Микробиота кожи с точки зрения фундаментальной медицины
- Аннотация
- Статья
- Ссылки
- English
Микробиом и его роль в развитии болезней кожи
Одним из фундаментальных достижений медицины начала XXI в. стало выполнение международного проекта «Микробиом человека» (‘Human Microbiome Project’), конечная цель которого улучшение здоровья посредством мониторинга или манипулирования человеческим микробиомом.
С позиций современной медицины микробиом сопоставим с резервуаром генов человека и их сосуществование является результатом совместной эволюции [1]. Формирование оси «микробиота – кишечник – мозг» начинается уже на этапе внутриутробного развития и представляет собой динамическую матрицу тканей и органов, которые взаимодействуют сложным разнонаправленным образом для поддержания гомеостаза. Изменение микробиоты может привести к широкому спектру физиологических и поведенческих эффектов, включая активацию гипоталамо-гипофизарно-надпочечниковой оси, влияние на активность нейромедиаторных систем и иммунной функции [2].
Микробное сообщество на поверхности кожи должно иметь идеальное состояние для эффективного регулирования иммунной толерантности, что позволяет избегать проникновения патогенов. Неспособность поддерживать гармоничные отношения между микробами и макроорганизмом становится причиной страданий от большинства кожных заболеваний, включая хронические [2].
Правильное развитие иммунных клеток на ранних стадиях онтогенеза имеет решающее значение для здоровья на протяжении всей жизни. Программируемое в процессе развития преимущественное поколение врожденных лимфоидных клеток (кожный лимфоцитарный антиген ILC1s) на перинатальных стадиях помогает регулировать раннюю колонизацию микробиоты кожи [3]. Именно функционирование тканеспецифических иммунных клеток на неонатальных стадиях необходимо для установления местного тканевого иммунного гомеостаза. В эксперименте у новорожденных мышей показано, что в коже NK1+ ILC1s регулируют правильную колонизацию микробиоты и контролируют условно патогенный возбудитель Pseudomonas aeruginosa [4].
В последние годы получены данные о влиянии микробного сообщества на функцию адаптивной и врожденной иммунной системы у пациентов с атопическим дерматитом (АтД), псориазом, акне, себорейным дерматитом и другими заболеваниями кожи [5–9]. В частности, установлено, что штаммы с антимикробной активностью часто встречаются у лиц без АтД, ранее неизвестные антимикробные пептиды, продуцируемые некоторыми видами CoNS, включая S. epidermidis и S. hominis, являются штаммоспецифичными, высокоэффективными, избирательно подавляют рост S. aureus и выступают в синергизме с человеческим антимикробным пептидом LL-37 [9, 10].
У пациентов с АтД на поверхности кожи штаммы с антимикробной активностью встречаются значительно реже, чем у здоровых людей, и их распространенность коррелирует с колонизацией Staphylococcus aureus [11, 12].
В новом исследовании международной группы ученых предложен надежный и доступный для применения в клинической практике протокол полногеномного анализа метагенома. Благодаря его применению удалось выявить отличие микробиома атопичной кожи от микробиома здоровой кожи: обогащение Streptococcus и Gemella и отсутствие Dermacoccus. Результаты экспериментов на кератиноцитах и полученных из моноцитов дендритных клетках свидетельствуют, что иммунный ответ на S. aureus и S. еpidermidis различается у здоровых и больных. При этом различия отмечены как при врожденном иммунном ответе с участием интерлейкина 1 (ИЛ-1), так и при адаптивном – с участием Т-хелперов. Представленность указанных бактерий сочетается с нарушением сообщества эукариотов и функциональными сдвигами в наборе генов совокупного микробиома, усугубляющими сухость и защелачивание кожи при АтД. Это в свою очередь способствует росту популяции патогенных микроорганизмов и воспалению. Таким образом, нарушение взаимодействия иммунной системы, микробного сообщества и микроокружения на поверхности кожи усиливает дисбаланс в этой системе и приводит к обострению атопического дерматита [11, 13].
Факторы, влияющие на микробиом кожи
Очевидно, что на состояние микробиома кожи влияют экзогенные и эндогенные факторы. Существенная роль в этом отводится рН кожи. Если рН кожи находится в диапазоне 4–6, рН внутренней среды организма поддерживается в пределах 7–9, то есть близок к нейтральному. Это создает резкий градиент в две-три единицы между рН эпидермиса и дермы. Более высокие значения рН ассоциируются с колонизацией пропионобактериями и стафилококками. Возрастание численности нормальной флоры кожи происходит в кислой среде, патогенных бактерий – в нейтральной [5, 6, 10].
Проницаемость рогового слоя зависит от его гидрофобной способности, распределения липидов и их организации в пластинчатые бислои. Два ключевых фермента, задействованных в обработке липидов: β-глюкоцереброзидаза и кислая сфингомиелиназа – также участвуют в синтезе церамидов – критических компонентов барьерной проницаемости. Поддержание кислой среды в роговом слое предотвращает развитие индуцированного гаптеном атопического дерматита. Снижение рН предотвращает эпидермальную гиперплазию тканей, уменьшает эозинофилию и нормализует структуры эпидермиса. Существующие «физиологические пробелы» при кислотном барьере зависят от зоны кожного покрова. Особенно это касается межпальцевых пространств и крупных складок – подмышечных, паховых, подгрудных, где значения рН выше, чем на других участках кожи. Дермицидин, антимикробный пептид, обнаруженный в поте, обладает антимикробной активностью в отношении разных патогенных микроорганизмов. При инкубации S. aureus в седьмой фракции пота, содержащей дермицидин, в буфере с рН 5,5 бактерицидный эффект превышает 90%, в буфере с рН 6,5 – снижается до 60% [14, 15].
Большое внимание сегодня уделяется экспозом-факторам как одной из причин дисбиотических процессов, происходящих в коже. Короткая длина волны видимого света, излучаемого от смартфонов и планшетов, увеличивает распространение золотистого стафилококка и разбалансирует микрофлору кожи. Ультрафиолет А и В также оказывает выраженное качественное и количественное влияние на состав микробиома кожи. Изменение в составе микробиома происходит после воздействия каждой из доз и сохраняется как минимум 24 часа после воздействия ультрафиолета. В исследованиях показано, что разные микроорганизмы под воздействием ультрафиолета по-разному влияют на состояние кожи. Бактерии семейства Cyanobacteria продуцируют соединения, способные раздражать кожу и вызывать появление сыпи. Lactobacillaceae, напротив, поддерживают здоровье кожи и проявляют противовоспалительную активность. Кроме того, они способны снизить негативное влияние на кожу ультрафиолетового излучения [16].
Антибактериальное мыло, топические или пероральные антибиотики, воздействуя на микробиом кожи, способны усилить колонизацию патогенных микроорганизмов и способствовать формированию биопленки [9]. При этом S. aureus активно колонизирует эккриновые каналы желез кожи и влияет на секрецию цитокинов кератиноцитами, вызывая дифференциацию и апоптоз последних. Индукция высвобождения кератиноцитами ИЛ-1 и ИЛ-36, синтеза ИЛ-17 при дефекте снижения уровня ИЛ-1α и ИЛ-36 приводит к снижению активности локальной воспалительной реакции и неэффективности стафилококк-индуцированного воспаления. К биологическим эффектам S. аureus также относят адгезию с кожным покровом, инвазивность в ткани, препятствование фагоцитозу и выживанию внутри фагоцитов, выделение гемолизинов, липазы, дезоксирибонуклеазы, стафилокиназы, коагулазы, образование суперантигенов [12, 14, 15].
Атопический дерматит
Роль S. аureus в патогенезе атопического дерматита неоспорима. Данный вид бактерий преобладает и при обострении заболевания. Негативная роль S. аureus связана с протеолитической активностью и способностью нарушать многокомпонентную систему кожного барьера, активацию Т-клеток, стимуляцию дегрануляции базофилов, тучных клеток и продукции иммуноглобулина E (IgE).
При преимущественном поражении волосистой части головы и шеи (достаточно трудноизлечимая форма АтД) ведущая роль в инициации заболевания отводится аллергенам Malassezia. Так, установлена связь с реакцией гиперчувствительности первого типа к антигенам Malassezia. Белок M. globosa (MGL_1304) и его гомологи из M. sympodialis (Mala s 8) и M. restricta (Mala r 8) оказались вовлеченными в патогенез дерматита головы и шеи и проявляли различную активность в высвобождении гистамина [17].
Белки Malassezia обнаруживаются в поте, поэтому заболевание провоцируется потоотделением (так называемая аллергия на пот). Отмечается эритематозное вовлечение кожи век, лба и шеи. Иногда изменения напоминают крапивницу [17, 18].
Высвобождению аллергена Malassezia может способствовать повышенный рН, что характерно для пациентов с атопическим дерматитом. При этом IgE-антитела к Malassezia обнаруживаются примерно у 27% детей и 65% взрослых с АтД [17, 18]. Провоспалительные цитокины и Malassezia-специфические IgE-антитела вырабатываются через Т-клеточную опосредованную активацию B-клеток, а также через дендритные и тучные клетки, что приводит к воспалению кожи.
Взаимодействие Malassezia с иммунной системой кожи является как гуморальным, так и клеточно-опосредованным. Это усиливает ранее существовавшее воспаление кожи [19, 20].
На сегодняшний день известно 17 видов дрожжей Malassezia. Они являются частью нормального микробиома кожи. Однако им присущ и патогенный потенциал, способность вызывать кожные заболевания через активацию иммунной системы, что отмечается не только при атопическом дерматите, но и при себорейном дерматите, отрубевидном лишае, или колонизацию большим количеством малассезийных дрожжей пилосальной единицы, как при фолликулите, вызванном Malassezia [21–23].
Malassezia взаимодействуют практически со всеми клеточными компонентами нормального эпидермиса (кератиноцитами, клетками Лангерганса, меланоцитами), а также с иммунной системой хозяина непосредственно и/или опосредованно через химические медиаторы [23].
Представленность видов Malassezia зависит от экзогенных липидов, поскольку у них, за исключением M. pachydermatis, отсутствуют гены синтазы жирных кислот. Существует также корреляция между видовым разнообразием и анатомическим местом. Видовое распределение и патогенетический потенциал дрожжей варьируются в зависимости от заболевания (дерматит головы и шеи, себорейный дерматит, разноцветный лишай, фолликулит). Заболевания, вызванные Malassezia, лечат противогрибковыми препаратами. При симптомах воспаления добавляют противовоспалительную терапию [18, 23, 24].
Себорейный дерматит
Не меньшую проблему в современной дерматологии представляет себорейный дерматит – воспалительный дерматоз в местах с высокой концентрацией сальных желез. Распространенность себорейного дерматита значительно выше у ВИЧ-инфицированных, пациентов с болезнью Паркинсона, лиц с травмой спинного мозга [9]. К предрасполагающим факторам себорейного дерматита относят иммуносупрессию, диабет, гематологические злокачественные новообразования, окклюзию и потливость.
Роль дрожжей Malassezia в патогенезе себорейного дерматита не вызывает сомнений. M. furfur, выделенные из очагов себорейного дерматита, продуцируют in vitro значительно больше биологически активных индольных веществ по сравнению со штаммами, выделенными из здоровой кожи. Такие вещества, как индирубин, 6-формилиндоло[3,2-b] карбазол (FICZ), индоло[3,2-b] карбазол (ICZ), малассезин и питириацитрин, обнаружены на коже при себорейном дерматите и соответствуют наиболее известным лигандам ариловых углеводородных рецепторов [21, 22]. В качестве маркера их клинического значения индирубин используется для лечения псориаза. Клинические испытания, в которых оцениваются лиганды ариловых углеводородных рецепторов, применяемых локально для терапии себорейного дерматита, продолжаются [25].
В процессе жизнедеятельности Malassezia выделяют свободные жирные кислоты, перекись сквалена, что способствует нарушению кожного барьера и вызывает раздражение кожи.
Себорейный дерматит следует дифференцировать от себопсориаза. Нарушение регуляции иммунного ответа на антигены микробиоты кожи играет существенную роль в развитии воспаления. При псориазе в коже повышена концентрация антимикробных пептидов, изменяется состав ее микробиоты. В псориатических очагах повышена доля Firmicutes –толстостенных грамположительных бактерий с низким содержанием гуанина и цитозина, к которым также относятся стафилококки, стрептококки, энтерококки, клостридии, лактобациллы. Кроме того, при псориазе значительно снижено количество актинобактерий и пропионобактерий [26, 27].
Для дифференциации перекрывающихся случаев псориаза и себорейного дерматита (себопсориаза) используют иммуногистохимические маркеры, которые обращаются к клиническим и патологическим нечетким случаям себопсориаза.
Пациенты с себорейным дерматитом и больные псориазом не имеют общих локусов восприимчивости [21].
Фолликулиты, вызванные Malassezia
Malassezia ответственны за развитие фолликулитов. Наиболее часто с данной патологией ассоциируются M. globosa (83,9%), M. sympodialis (12,9%) и М. furfur (3,2%). При этом отмечается высокая генотипическая изменчивость M. globosa [9, 23]. Malassezia-фолликулит может быть диагностирован как акне или бактериальный фолликулит, особенно у подростков, однако комедоны при нем отсутствуют, а зуд является распространенным симптомом [9, 17]. При фолликулите Malassezia вторгаются в пило-сальный комплекс. Внутри фолликулов наблюдается ретикулярный рисунок кератиновой закупорки, что приводит к дилатации фолликулов, разрыву их стенки и формированию смешанного воспалительного инфильтрата из нейтрофилов, лимфоцитов и гистиоцитов в дерме и клиническому воспалению [23].
Практически при всех патологических состояниях энтеротоксины S. аureus и ферментативная деятельность Malassezia spp. ингибируют апоптоз клеток воспалительного инфильтрата (в первую очередь CLA+-Т-лимфоцитов), что способствует хронизации воспаления [3, 6, 12, 15, 20].
Активированный пиритион цинка
Активированный пиритион цинка – действующее вещество нестероидного противовоспалительного препарата Скин-кап. Он снижает колонизацию кожи M. furfur и других видов грибов, а также S. aureus. Применение препарата Скин-кап сопровождается уменьшением выраженности кожного зуда, степени активности кожного процесса, потребности в топических и антигистаминных препаратах [28, 29].
Скин-кап практически не всасывается с поверхности кожи, не оказывает цитостатического эффекта и не воздействует на синтез ДНК. Связывается с фосфолипидами и нарушает проницаемость мембран, снижает уровень аденозинтрифосфата. Нарушение основных ферментативных процессов на мембранах приводит к гибели бактерий (стрептококка, стафилококка, синегнойной палочки, кишечной палочки, протея) и грибов (Malassezia spp., Candida spp.) [28, 29].
В исследовании, проведенном M. Park и соавт., пиритион цинка увеличивал фагоцитарную активность макрофагов, значительно повышал уровень клеточного цинка и незначительно – клеточной меди. Он также ингибировал функцию митохондрий и синтез кластеров Fe-S в M. restricta, снижал экспрессию липазы [30].
Активированный пиритион цинка может применяться для коррекции микробиома кожи при различных воспалительных дерматозах, в патогенезе которых значимую роль играет нарушение микробиоценоза (псориаз, атопический дерматит, себорейный дерматит). Как было отмечено ранее, препарат активированного цинка пиритиона обладает противовоспалительной, противогрибковой и противомикробной активностью. Особенности механизма его действия позволяют избегать дополнительной сенсибилизации или формирования резистентности микроорганизмов.
Скин-кап выпускается в следующих лекарственных формах: крем, шампунь, аэрозоль, а также в качестве косметического средства – геля для душа. Выбор формы зависит от остроты процесса.
Помимо активированного пиритиона цинка в состав крема Скин-кап входят полиглицерил дистеарат – эмульсионный компонент, увлажняющее и смягчающее средство, изопропил пальмитат – вещество, обладающее смягчающим воздействием, сукрозы кокоат – гидрофильный эмолент, глицерол – компонент, оказывающий смягчающее и дерматопротекторное воздействие, обладающий гигроскопичными и смазывающими свойствами, активирующий обменные процессы в коже, и метилдекстрозы и макрогола-20 эфир – увлажнитель, кондиционер для кожи, эмолент.
Препарат обладает приятным запахом, не пачкает одежду, легко наносится, что обеспечивает высокую комплаентность пациентов лечению.
К преимуществам крема и аэрозоля Скин-кап также следует отнести возможность применения у детей с года и на всех участках тела без ограничений по площади [31].
Опыт применения
Клинический случай 1. Под наблюдением находился пациент К. десяти лет.
При первичном обращении в ноябре 2018 г. жалобы на постоянный зуд, плотные толстые корки на волосистой части головы.
Из анамнеза известно, что болен с двух лет. В течение восьми лет корки смазывали маслом и удаляли. Семейный анамнез отягощен по материнской линии. У матери экзема и поллиноз.
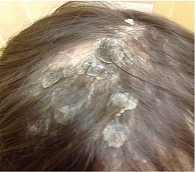
При осмотре: распространенный патологический процесс. Кожа туловища и конечностей сухая, в локтевых сгибах мелкие незначительные папулезные высыпания до 0,1–0,2 см. В теменно-височной области толстые серовато-коричневые плотно прилегающие корки и очаги облысения.
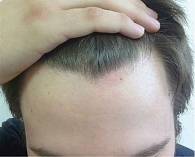
Диагноз: атопический дерматит, детский возрастной период, сквамозно-пруригинозная форма, средняя степень тяжести, асбестовидный лишай (рис. 1).
Назначена терапия: эмоленты ежедневно, системный флуконазол 100 мг еженедельно № 6, наружно шампунь Скин-кап два-три раза в неделю и крем Скин-кап дважды в день в течение месяца.
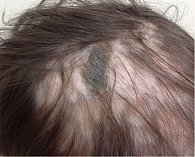
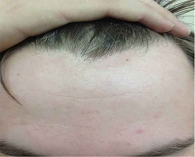
На контрольном визите в декабре 2018 г. отмечено выраженное улучшение, корки стали меньше по размеру и мягче, значительно уменьшился зуд (рис. 2).
Пациент продолжил получать поддерживающую терапию кремом Скин-кап. Режим применения: один раз в семь дней. Шампунь Скин-кап использовал раз в две недели.
На рисунке 3 пациент К. спустя шесть месяцев от начала лечения.
Клинический случай 2. Под наблюдением находился пациент Б., 18 лет.
На момент первого обращения в августе 2018 г. жаловался на высыпания на волосистой части головы, умеренный зуд, шелушение и изменение ногтевых пластин. Болен около года. Высыпания на границе роста волос появились после стресса. Применял разные шампуни, но без эффекта. Примерно шесть месяцев назад отметил изменение ногтевых пластин. Семейный анамнез не отягощен.
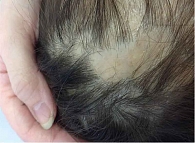
При осмотре: патологический процесс локализуется на голове в области роста волос, преимущественно по краю, умеренное шелушение, границы бляшек четкие, неправильные, ярко-розового цвета. В области локтевых суставов плоские бляшки до 1,0–1,5 см с умеренным шелушением. Псориатическая триада положительна. Ногти на большом и указательном пальцах обеих кистей с точечными углублениями.
Диагноз: вульгарный псориаз, прогрессирующая стадия, псориаз волосистой части головы, псориаз ногтей (рис. 4).
Назначено лечение: комбинация бетаметазона дипропионата и кальципотриола в виде геля два раза в день в течение месяца, шампунь Скин-кап два-три раза в неделю.
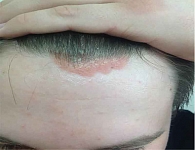
На фоне терапии достигнут хороший клинический эффект (рис. 5).
Поскольку пациент испытывал стресс по поводу своего заболевания, при этом имел выраженную стероидофобию, в качестве поддерживающей терапии рекомендован Скин-кап крем 0,2%-ный два раза в день в течение месяца, затем один раз в день два-три раза в неделю.
На контрольном визите через восемь месяцев обнаружена едва заметная гиперпигментация (рис. 6).
Пациент привержен лечению и тщательно выполняет все рекомендации.
O.I. Letyaeva, MD, PhD, Prof.
South Ural State Medical University
Contact person: Olga I. Letyaeva, Olga-letyaeva@yandex.ru
The article discusses the current understanding of the skin microbiome and its significance in the pathogenesis of various dermatoses. In particular, emphasis is made on the participation of Staphylococcus aureus in the initiation and maintenance of inflammation in atopic dermatitis, the role of lipophilic fungi of the genus Malassezia in the pathogenesis of seborrheic dermatitis and folliculitis. Discussed the possibility of skin microbiocenosis correction. Provided data of our own clinical observations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.