Миофасциальный болевой синдром: клинико-патофизиологические аспекты и эффективное обезболивание
- Аннотация
- Статья
- Ссылки
- English
Введение
Боли, не связанные с вовлечением корешков и периферических нервов, а также внутренних органов, относят к мышечно-скелетным болям (неспецифические возрастные или связанные с микроповреждением либо мышечно-скелетной дисфункцией) [1]. Это самый распространенный тип боли (почти 98% всех случаев болей в спине). Типичным примером мышечно-скелетной боли является миофасциальный болевой синдром (МБС), который вызывает значительную дезадаптацию пациентов. МБС затрагивает до 85% населения в целом в течение жизни, тогда как его общая распространенность составляет 46% [2, 3]. Высокая распространенность МБС в популяции обусловлена урбанизацией, малоподвижным образом жизни, изменением двигательных стереотипов, характером питания и прочими факторами риска [4, 5].
МБС – яркий представитель клинического полиморфизма, представляет собой совокупность сенсорных, моторных и вегетативных симптомов, включая локальную боль, снижающую диапазон активных движений (чаще всего МБС локализуется в спине, шее, голове и суставах [6]), и мышечную слабость. Влияние МБС на повседневное функционирование может быть значительным, поскольку пациенты страдают не только от снижения функционального статуса, связанного с костно-мышечной болью и потерей двигательной функции, но и от расстройств эмоционально-волевой сферы и снижения качества жизни [7].
В качестве синонимов МБС ранее использовались термины «фибромиозит», «миалгия», «мышечный ревматизм», «несуставной ревматизм», часть из них нашли отражение в Международной классификации болезней 10-го пересмотра. В классе болезней костно-мышечной системы представлены миозит (М60.9), миофасциит (острый) (М60.9), миофиброз (М62.8), миофиброзит (М97.0), миалгия (межреберная) (М79.1), фасциит (М72.5). В классе болезней нервной системы боли в мышцах указаны как миопатии (G72.9) [8].
Факторы риска
Все факторы риска развития вертеброневрологической патологии принято разделять на некорректируемые (наследственность, возраст, пол) и корректируемые, устранив которые можно в значительной степени повлиять на этиологическую составляющую патологического процесса [9].
Женский пол – некорректируемый фактор риска. Женщины чаще жалуются на разнообразные временные или рецидивирующие мышечные боли (кроме тех, что они испытывают во время менструаций, беременности и родов) [10] и отмечают более сильную, частую и продолжительную боль [11]. Наиболее выраженные половые различия наблюдаются в возрасте 17–44 лет. Распространенность МБС всех локализаций уменьшается в пожилом и старческом возрасте, так же как нивелируется и половая дифференциация распространения МБС. Исключение составляют только суставные боли [12, 13] и фибромиалгии [14], которые чаще встречаются у женщин пожилого возраста.
К корректируемым факторам риска, которые составляют основу преждевременного развития хронической боли в спине, относятся:
- профессиональные (физический труд, статические нагрузки на позвоночник, позные нагрузки с наклонами вперед и ротацией тела, работа, вибрация);
- психосоциальные факторы, связанные с острым и хроническим стрессом;
- нарушения двигательного стереотипа, обусловленные сколиозом, кифосколиозом, сутулость ввиду слабости мышечного корсета и отсутствия регулярных физических нагрузок, занятий физкультурой;
- влияние метеофакторов (локальное или общее переохлаждение);
- нерациональное питание и заболевания желудочно-кишечного тракта (нарушения всасывания витаминов группы В, синдром мальабсорбции, употребление пищи с большим содержанием пуриновых оснований, избыточная масса тела, ожирение);
- курение, злоупотребление алкоголем.
Один из корректируемых факторов – сидячий образ жизни, следствием которого становятся уменьшение выраженности поясничного лордоза, увеличение давления на переднюю часть межпозвоночного диска и растяжение его задней части, растяжение связок и капсул фасеточных суставов, нарушение гидратации и кровоснабжения диска, нарушение тонуса мышц спины и брюшного пресса.
Этиология и патогенез
МБС – полиэтиологическое состояние. D.G. Simons и соавт. предположили, что начало и персистирование МБС связаны с локализованной зоной изменения болевой чувствительности, называемой триггерными точками (ТТ) [15]. По определению Международной ассоциации по изучению боли (IASP), МБС представляет собой хронический болевой синдром, возникающий от одного или нескольких ТТ одной или нескольких мышц [16]. К факторам формирования ТТ относятся:
- определяющие (вертеброгенный, висцерогенный, травматический);
- предрасполагающие (генетический, нейровегетативный, психогенный);
- провоцирующие (неблагоприятные статокинетические и психоэмоциональные воздействия) [17].
В качестве первичных этиологических факторов рассматривают растяжение мышц, перегрузку на фоне чрезмерной физической активности при продолжительной повторяющейся монотонной физической деятельности, локальные травмы, профессиональную мышечную микротравматизацию, перегрузку мышц при разной длине нижних конечностей, предпочтение конечности в результате особенностей физической нагрузки или психологический стресс [18]. Низкая эргономичность, длительное неправильное постуральное позиционное положение, мышечная утомляемость, ожирение могут стать причиной формирования МТТ. По некоторым данным, хорошая физическая форма у здоровых людей или тренированных спортсменов снижает риск формирования МТТ, что предполагает высокий порог сопротивляемости провоцирующим перечисленным факторам или их комбинации, инициирующим ТТ [19]. Старение, соматические заболевания, поражения внутренних органов и психологический стресс могут дополнять перечисленные механизмы развития МТТ [20, 21]. Описано образование МТТ в результате спонтанного болевого синдрома у лиц, страдающих фибромиалгией [22, 23]. ТТ также наблюдались у пациентов с рефлекторной симпатической дистрофией, которая, по мнению многих исследователей, возникает из-за личностного эмоционального и психологического состояния или острого/хронического психологического стресса [24, 25].
В качестве вторичных причин МБС рассматривают ятрогенный фактор – применение препаратов химиотерапии (таксан-содержащих режимов), используемых при различных видах опухолей [26, 27].
Согласно результатам игольчатой электронейромиографии, в МТТ регистрируется повышенная миогенная активность, в то время как прилегающая мышца остается беззвучной при психологическом стрессе [20]. Острый или хронический стресс увеличивают выработку стрессовых гормонов и активируют симпатическую нервную систему. Считается, что повышение уровня гормонов и симпатическая стимуляция в этом состоянии способствуют увеличению выделения ацетилхолина в нервно-мышечном соединении, вследствие чего сокращаются моторные единицы, реализующие гиперраздражимость ТТ [28]. Понимание биомеханики МТТ имеет решающее значение для разработки методов лечения МБС.
Г.А. Иваничев называет ТТ объектом раздражения ноцицепторов, который иннервирует связки, капсулы суставов, жировую ткань, периост, скелетные мышцы и наружные оболочки кровеносных сосудов [17]. Согласно предложенному определению D.G. Simons и соавт., МТТ – гиперраздражимая очаговая область в уплотненном или тугом тяже скелетной мышцы и/или ее фасции, болезненная при пальпации [18]. Во всех случаях ведущими патогенетическими механизмами формирования МТТ служат рефлекторные тонические изменения в мышце на ее ограниченном участке [29]. Локальные области мышцы – пальпируемые жесткие тугие тяжи (узлы). Считается, что эта жесткость может возникнуть в результате чрезмерного сокращения саркомера в этой области [30, 31].
Гистологическое исследование биопсий мышц из МТТ обнаруживает структурные признаки гиперконстрикции мышц с устойчивым высвобождением кальция из саркоплазматического ретикулума из-за интенсивной нейрональной активации и генерации потенциала действия [31]. J. Borg-Stein и D.G. Simons подтверждают, что ТТ проявляют спонтанную электрическую активность и генерацию потенциала аберрантного действия [32]. Дальнейшее изучение биопсийного материала гипертонической мышцы выявило саркомерное сокращение, деградацию белка и миофибрилла, митохондриальную дисфункцию с последующим развертыванием метаболического стресса и истощения аденозинтрифосфата (АТФ). К важнейшим звеньям патогенетического процесса длительных тонических изменений в мышце относятся не только увеличение метаболического стресса, но и вторично возникающие нарушения микроциркуляции. Этот комплекс формирует устойчивую патологическую систему, связанную с высвобождением миокинов, провоспалительных цитокинов и нейротрансмиттеров, которые также, несомненно, генерируют МТТ и формируют МБС [33].
Основные звенья патогенеза соматогенных болевых синдромов, в том числе и МБС, были раскрыты в рефлекторной концепции D.G. Simons [15]:
- аномальное выделение ацетилхолина в сокращенной мышце;
- увеличение напряжения мышечного волокна, которое рассматривается как тугой мышечный тяж, и рефлекторное сокращение мышечного волокна с дальнейшей деформацией мышцы способствуют нарушению микроциркуляции;
- возникающая локальная гипоксия разрушает митохондриальный энергетический метаболизм, снижает содержание АТФ и приводит к следующей стадии;
- нарушение тканевого обмена;
- выделение алгогенов и сенситизация рецепторов в области повреждения;
- активация автономных механизмов, которая замыкает петлю обратной связи и приводит вновь к аномальному высвобождению ацетилхолина.
Концепция D.G. Simons была дополнена результатами исследований R.D. Gerwin и соавт. [28], которые предложили более конкретные детали цикла обратной связи. К примеру, активность симпатической нервной системы увеличивает высвобождение ацетилхолина, а также потенцирует местную гипоперфузию, вызванную сокращением мышц. Развившаяся в результате ишемия/гипоксия становится причиной сдвига кислотно-щелочного равновесия (снижению рН). Эксперименты показали, что инъекции кислого солевого раствора (рН = 4) могут вызывать мышечную боль путем активации ноцицепторов мышечных волокон, а именно кислотно-чувствительных ионных каналов (ASIC3) [34, 35]. Подобный уровень рН намного ниже порога ишемии, и активация каналов ASIC3 происходит при меньшем физиологическом уровне рH [36]. Длительная локальная ишемия/гипоксия приводит к мышечной травме, высвобождению калия, брадикининов, цитокинов, АТФ и субстанции Р [28, 37], активации кальцитонин ген-зависимого пептида (calcitonin gene-related peptide – CGRP), что вызывает деполяризацию ноцицептивных нейронов и формирует феномен боли [38]. CGRP ингибирует ацетилхолинэстеразу, повышает количество ацетилхолиновых рецепторов и высвобождает ацетилхолин. Спонтанное выделение ацетилхолина на концевой пластине постсинаптической мембраны в результате воздействия CGRP называют утечкой ацетилхолина [39]. Последующее снижение рН также может вызвать увеличение высвобождения ацетилхолина [40]. Результатом каскадного процесса становятся увеличение ацетилхолина в нервных терминалях, синаптической щели и увеличение потенциалов на концевой пластине мышечного волокна, что обусловливает ее большее сокращение и гипертонус [41, 42].
Вследствие усиления ноцицептивного афферентного потока и сенситизации ноцицептивных нейронов на различных уровнях центральной нервной системы со временем первичная зона болевой чувствительности расширяется и в дальнейшем может выходить за пределы поврежденных тканей. Участки с повышенной болевой чувствительностью к повреждающим стимулам называют зоной гипералгезии [43].
Выделяют первичную и вторичную гипералгезию. Первичная гипералгезия охватывает поврежденные ткани, вторичная гипералгезия локализуется вне зоны повреждения. По мнению А.М. Василенко и соавт., основу формирования зоны первичной гипералгезии составляет феномен периферической сенситизации [44]. Он заключается в повышении возбудимости периферических нервных рецепторов под влиянием нейротрансмиттерных аминокислот и нейропептидов, выделяющихся из поврежденной ткани и неповрежденных тканевых элементов под воздействием ноцицептивной стимуляции. Гипервозбудимые периферические рецепторы обеспечивают повышение афферентации к задним рогам спинного мозга, снижение мембранного потенциала первичных центральных ноцицептивных нейронов и повышение их возбудимости. Так возникает центральная сенситизация – основа формирования генератора патологически усиленного возбуждения и зон вторичной гипералгезии. Зона вторичной гипералгезии может располагаться на достаточном удалении от места повреждения, в том числе на противоположной стороне [44]. Таким образом, периферическое первичное повреждение запускает каскад патофизиологических и регуляторных процессов, впоследствии вовлекающий всю ноцицептивную систему от тканевых рецепторов до корковых нейронов.
Классификация
Для систематизации различных видов МБС было предложено достаточно большое количество различных классификаций. Среди наиболее часто используемых в практической деятельности – классификация Г.А. Иваничева [17], согласно которой МБС подразделяется на локальную, регионарную, генерализованную.
Локальная боль не испытывается в покое, провоцируется давлением или растяжением мышцы, определяется в виде тугого тяжа вдоль мышцы. Отраженная боль отсутствует. Мышца при пальпации обычной консистенции и не укорочена. Местные вегетативные реакции (пиломоторный эффект, гипергидроз, вазодистонические реакции) в покое не выражены, воспроизводятся только при энергичной пальпации.
Регионарная боль тянущего характера ощущается по всей длине мышцы. При локальном мышечном гипертонусе боль может быть спонтанной и вызванной. Характерны болезненные переживания ночью, уменьшающиеся при активности. При пальпации воспроизводится типичная отраженная боль в соседние участки, определяется повышение тонуса всей мышцы или мышц-агонистов, при этом боль может сопровождаться негрубым снижением мышечной силы.
Генерализованная боль – диффузная боль в группе мышц, как выраженная в покое, так и усиливающаяся при любом движении. Пальпация мышцы сопровождается генерализацией болезненности и резким повышением тонуса не только мышц-агонистов, но и антагонистов. Определение локального мышечного гипертонуса затруднено из-за повышенного тонуса исследуемой мышцы. Генерализованная боль характеризуется значительным снижением мышечной силы, формирующимся патологическим двигательным стереотипом, надсегментарными вегетативными расстройствами, астено-депрессивным синдромом и диссомническими нарушениями.
Диагностика
К основным клиническим критериям МБС относятся уплотнение мышцы, ее болезненность, повышение сократительной активности, нарушение нормальных координационных отношений между различными мышечными группами. Уплотнение мышцы может иметь различные размеры, конфигурацию, протяженность, консистенцию и другие объективные характеристики.
МБС, как было отмечено ранее, определяется ТТ [18]. Клинически МТТ верифицируются как активные или латентные (скрытые). Активная МТТ – нейрофизиологическая основа, вызывающая спонтанную локальную боль, а также двигательные и местные вегетативные симптомы (пиломоторный эффект, гипергидроз, вазодистонические реакции) при пальпации скелетной мышцы и/или ее фасции [45]. Активные ТТ проявляются избыточным вовлечением в сократительную активность мышц-агонистов. Латентные МТТ не вызывают спонтанного болевого ответа, локальная боль провоцируется только давлением, пальпацией или сжатием ТТ [46]. Фактически латентные ТТ отображают все признаки активной ТТ, но в меньшей степени. К примеру, скрытые ТТ могут ассоциироваться с местными вегетативными реакциями, мышечной слабостью, ограниченностью амплитуды движений только при энергичной пальпации, в покое они практически не выражены [47, 48].
Диагностика МБС основывается на определении характеристик боли и клиническом обследовании. Необходимо установить тип и интенсивность боли как субъективно значимого критерия, а также ее длительность и локализацию, оценить факторы, влияющие на интенсивность боли, и площадь болевых ощущений.
Можно выделить такие правила пальпации:
- деликатность;
- постепенное, медленное и острожное погружение в мышцу;
- проведение исследования теплыми руками и в теплом помещении;
- удобное, не вызывающее напряжения и утомления положение и врача, и пациента.
К основным ошибкам при пальпации относятся следующие:
- эмоциональная реакция пациента на пальпацию как показатель точности диагноза;
- большое давление пальцем (снижается точность исследования);
- интенсивная пальпация кончиками пальцев (снижается чувствительность);
- оценка степени выраженности боли по размерам ТТ;
- исследование через белье, даже самое тонкое.
Критериями диагностики МТТ служат «симптом прыжка» и локальный судорожный ответ либо дрожание при щипковой пальпации. Характерный болевой паттерн и вегетативная реакция (вазодистония, дермографизм) возникают при умеренном непрерывном давлении на МТТ или в ответ на пенетрацию ТТ инъекционной иглой. Легче всего эти феномены выявляются в верхней грудной и пояснично-крестцовой областях спины.
Лечение
Учитывая полиэтиологичность и сложность формирования патогенетического каскада при МБС, его лечение требует мультидисциплинарного подхода. Первостепенная задача – инактивировать ТТ, чтобы снизить выраженность болевого синдрома, при этом воздействие на ТТ не должно быть изолированным. Дальнейшие шаги включают нивелирование мышечного дисбаланса, формирование нового стереотипа правильного баланса между постуральной и динамической мускулатурой, коррекцию факторов риска и предупреждение хронизации болевого синдрома. В клинической практике в настоящее время наблюдается парадоксальная тенденция: количество методов и способов лечения болевых синдромов ежегодно увеличивается, а число случаев терапевтической резистентности неуклонно растет, так же как и их распространенность в популяции.
Применение лекарственных средств при МБС патогенетически обосновано и направлено на следующие звенья цепи [43]:
- подавление синтеза медиаторов воспаления;
- ограничение поступления ноцицептивной импульсации из зоны повреждения в центральной нервной системе;
- активацию структур антиноцицептивной системы.
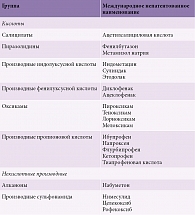
Основная терапевтическая мишень – подавление синтеза медиаторов воспаления, что одновременно позволяет предотвратить периферическую сенситизацию. Подобным эффектом обладает группа нестероидных противовоспалительных препаратов (НПВП), назначаемых с первого дня заболевания и имеющих высокий уровень доказательности [49–51]. Большинство НПВП – неселективные ингибиторы фермента циклооксигеназы, они подавляют действие обеих изоформ (разновидностей) – 1 и 2. Циклооксигеназа отвечает за выработку простагландинов и тромбоксана из арахидоновой кислоты, которая в свою очередь образуется из фосфолипидов клеточной мембраны за счет фермента фосфолипазы А2. Простагландины среди прочего выступают в качестве посредников и регуляторов в развитии воспалительной реакции [52]. По селективности в отношении различных форм циклооксигеназы НПВП подразделяются на селективные и неселективные. В зависимости от химической структуры различают кислоты и нескислотные производные (табл. 1) [53].
С целью повышения эффективности НПВП в лечении скелетно-мышечных болевых синдромов используют локальную противовоспалительную терапию, нашедшую широкое применение в клинической практике. Длительность назначения системных НПВП не должна превышать 10–14 дней во избежание побочных симптомов со стороны желудочно-кишечного тракта, сердечно-сосудистой и кроветворной системы. В отличие от пероральных форм терапия местными формами НПВП может быть более продолжительной.
Среди преимуществ местной терапии НПВП при МБС (по сравнению с системной) можно выделить относительную простоту и безопасность использования, обеспечение высокой концентрации препарата в месте нанесения, быстрое проникновение к очагу воспаления, слабо выраженное системное действие. Это позволяет предотвратить побочные эффекты, наблюдаемые при системной терапии НПВП, и обеспечивает пролонгированное действие.
Одной из локальных форм НПВП является Долгит® крем для наружного применения 5%. В настоящее время показана высокая эффективность и безопасность препарата Долгит® крем, оказывающего эффективное обезболивающее и мощное противовоспалительное действие на мышечную ткань за счет активного вещества – ибупрофена. Ибупрофен – неселективный ингибитор циклооксигеназы 1 и 2, нарушая метаболизм арахидоновой кислоты и уменьшая количество простагландинов и провоспалительных цитокинов как в здоровых тканях, так и в очаге активного воспаления, снижает агрегацию тромбоцитов. Оказывая анальгезирующий эффект путем снижения болевой чувствительности, купирует болевой синдром как в покое, так и в движении, увеличивая при этом объем активных движений. Характеризуется достаточным противоотечным эффектом.
Применение препарата Долгит® крем 5% позволяет снизить риск развития системных побочных эффектов НПВП, а также, локально воздействуя на спазмированную мышцу, создает высокую концентрацию активного вещества в месте нанесения. Быстрое проникновение к очагу воспаления обеспечивает анальгезию уже спустя несколько минут после нанесения. Крем не оставляет следов на коже и одежде. После прохождения полного курса лечения достигается стойкий долговременный эффект.
Высокая эффективность и безопасность локальной терапии ибупрофеном (противовоспалительным и анальгезирующим препаратом Долгит® крем) были отмечены P.W. Billigmann (1996) [54], J. Campbell и T. Dunn (1994) [55], R.L. Dreiser (1988) [56], J. Machen и M. Whitefield (2002) [57], N. Ramesh и U. Steuber (1983) [58]. Эти работы были включены в анализ исследований, посвященных изучению эффективности различных НПВП при острой боли [59]. В этих пяти исследованиях в общей сложности приняли участие 436 пациентов с острой скелетно-мышечной болью, в том числе вызванной растяжениями, спортивными травмами. 218 пациентов получали местное лечение ибупрофеном 5% в виде тонкой полоски крема, накладываемой на участок наибольшей болевой чувствительности на протяжении семи дней (не менее трех). Частота нанесения крема с НПВП составляла в среднем не реже раза в сутки. 218 пациентов получали плацебо по той же схеме. Был продемонстрирован значительный эффект местного лечения в виде снижения болевого синдрома и скорейшего восстановления повседневного функционирования по сравнению с плацебо. Доля участников, которые отметили положительный результат, в среднем составила при применении ибупрофена местно 55% (n = 120, от 31 до 81%), при применении плацебо – 33% (n = 73, от 13 до 76%).
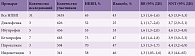
При сравнении результатов лечения с помощью ибупрофена и других НПВП выяснилось, что ибупрофен по коэффициенту NNT (среднее число пациентов, которых необходимо пролечить, чтобы достичь определенного благоприятного исхода или предотвратить один неблагоприятный исход) был сопоставим с пироксикамом (NNT = 4,6 и 4,4 соответственно) и в значительной степени превышал индометацин (NNT = 8,3). Кроме того, ибупрофен 5% продемонстрировал меньшее число нежелательных побочных эффектов (коэффициент NNН) в виде жжения и зуда в области нанесения крема, аллергического дерматита и высокий результат относительной выгоды (коэффициент RB) по сравнению с диклофенаком (табл. 2). Таким образом, высокая эффективность, хорошая переносимость и отсутствие нежелательных явлений по результатам исследования позволяют рекомендовать ибупрофен (Долгит® крем 5%) к применению при МБС.
С целью уменьшения выраженности МБС и расслабления при мышечном спазме следует комбинировать НПВП и миорелаксанты (р < 0,01) [60]. Эта комбинация позволит сократить сроки лечения и уменьшить риск развития системных побочных эффектов от пероральных форм НПВП за счет снижения доз последних. Применение миорелаксантов способствует снижению гипертонуса и нивелированию ТТ, уменьшает выраженность болевого синдрома, а также предупреждает хронизацию болевого синдрома в результате активации антиноцицептивной системы. Кроме того, подобная комбинация улучшает функциональную способность опорно-двигательного аппарата, облегчает возможность проведения широких реабилитационных мероприятий и способствует сохранению трудоспособности пациента, его активности в повседневной жизни. Для активации структур антиноцицептивной системы, контролирующих проведение ноцицептивной импульсации в центральной нервной системе, может быть использован целый спектр лекарственных препаратов, включая бензодиазепины [61], антиконвульсанты [62]. Систематический обзор Кокрейновской базы показал эффективность назначения антиконвульсантов не только при остром МБС, но и при хроническом болевом синдроме, в том числе при фибромиалгии [63]. Чем выше риск генерализации МБС, тем важнее роль препаратов адъювантного ряда: трициклических антидепрессантов и селективных ингибиторов обратного захвата серотонина и норадреналина [64].
Физиотерапевтическое лечение, мануальная терапия, локальная инъекционная терапия (блокады ТТ), чрескожная электрическая нейростимуляция и магнитная стимуляция, лазерная терапия – неотъемлемая часть терапевтической стратегии при МБС. Указанные немедикаментозные методы способствуют нормализации гомеостаза, стимулируют защитные рефлексы, иммунную систему, процессы репарации, приводят к восстановлению подвижности, коррекции мышечно-силового дисбаланса, формируют правильный двигательный стереотип, моделируют сформированный стереотип движений. В восстановлении оптимального двигательного режима предполагается огромный спектр лечебных комплексов физических упражнений, направленных на укрепление мышечного корсета.
Заключение
Несмотря на широкий арсенал средств, оптимальное лечение пациентов с МБС остается трудной задачей. Несомненно, приоритет имеет мультидисциплинарный подход, включающий нефармакологические методы, изменение образа жизни и функциональную повседневную активность. Среди наиболее эффективных и удобных в практическом применении фармакологических методов – использование локальных форм НПВП, что подтверждается результатами специальных исследований и многолетней клинической практикой.
Ye.M. Yevdokimova, A.E. Shagbazyan, G.R. Tabeyeva
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Yelena Mikhaylovna Yevdokimova, chernovalm@inbox.ru
Myofascial pain syndrome is a polietiologic state of health characterized by complex processes of symptomatology. The influence of myofascial pain on daily functioning can be pretty significant, as the patients suffer not only from the decrease in functional status associated with musculoskeletal pain and the loss of motor function, but also from disorders of the emotional-volitional sphere as well as the reduction of life quality in general. The strategic goal of myofascial pain syndrome treatment involves pain control, the gradual increase in motor abilities and change in the generated movement patterns. Among the pharmacological methods the use of local forms of non-steroidal anti-inflammatory drugs is one of the most effective and convenient in practical application as evidenced by the results of special studies and much year clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.