Молекулярные факторы опухолевой прогрессии при увеальной меланоме
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано и пролечено 30 пациентов (12 мужчин и 18 женщин, соотношение 2:3) в возрасте 23–72 лет (средний возраст 52,5 ± 9,1 года) с первичной УМ. Во всех случаях проведена энуклеация с гистологически подтвержденным диагнозом УМ. Мутации в генах GNAQ/GNA11 и полиморфизм гена ABCB1/MDR1 определены на основании ПЦР-ПДРФ-анализа.
Результаты. В 27 (90%) из 30 образцов выявлены мутации в экзонах 4 и 5 генов GNAQ/GNA11. Частота мутаций в экзонах 4 и 5 гена GNAQ составила 40 и 16,7%, гена GNA11 – 0 и 50% соответственно.
Показана статистически значимая ассоциация между частотой мутации глутамина в 209-м положении гена GNAQ и высокой отслойкой сетчатки (0,55 при p < 0,05). Частота мутации в экзоне 5 гена GNA11 в опухоли веретеноклеточного типа в 2,8 раза выше по сравнению с эпителиоидно-клеточным типом. Аллель С полиморфного маркера С3435Т гена ABCB1 выявлен в 80% случаев. Частота предрасполагающего генотипа СС у больных УМ в четыре раза выше, чем в контрольной группе. Данный генотип ассоциирован с высоким риском развития УМ (относительный риск 8,5; p = 7 × 10-6). Установлена достоверная корреляционная связь частоты встречаемости генотипа СС полиморфного маркера C3435T гена АBСB1 с высотой и степенью пигментации опухоли (р = 0,0391 и р = 0,0381), состоянием сосудов и эпителиоидно-клеточным/смешанно-клеточным типом УМ (0,0493 и 0,0569). Генотип ТТ у больных УМ не выявлен.
Заключение. Показана высокая частота мутаций в генах GNAQ/GNA11 и ассоциация аллеля С полиморфного маркера C3435T гена ABCB1 с неблагоприятными клиническими и морфологическими вариантами УМ. Выявленные особенности могли бы быть использованы для разработки в ходе дальнейших исследований современных подходов к прогнозированию течения УМ, а также для скрининга пациентов, входящих в группу риска по данному заболеванию.
Материал и методы. Обследовано и пролечено 30 пациентов (12 мужчин и 18 женщин, соотношение 2:3) в возрасте 23–72 лет (средний возраст 52,5 ± 9,1 года) с первичной УМ. Во всех случаях проведена энуклеация с гистологически подтвержденным диагнозом УМ. Мутации в генах GNAQ/GNA11 и полиморфизм гена ABCB1/MDR1 определены на основании ПЦР-ПДРФ-анализа.
Результаты. В 27 (90%) из 30 образцов выявлены мутации в экзонах 4 и 5 генов GNAQ/GNA11. Частота мутаций в экзонах 4 и 5 гена GNAQ составила 40 и 16,7%, гена GNA11 – 0 и 50% соответственно.
Показана статистически значимая ассоциация между частотой мутации глутамина в 209-м положении гена GNAQ и высокой отслойкой сетчатки (0,55 при p < 0,05). Частота мутации в экзоне 5 гена GNA11 в опухоли веретеноклеточного типа в 2,8 раза выше по сравнению с эпителиоидно-клеточным типом. Аллель С полиморфного маркера С3435Т гена ABCB1 выявлен в 80% случаев. Частота предрасполагающего генотипа СС у больных УМ в четыре раза выше, чем в контрольной группе. Данный генотип ассоциирован с высоким риском развития УМ (относительный риск 8,5; p = 7 × 10-6). Установлена достоверная корреляционная связь частоты встречаемости генотипа СС полиморфного маркера C3435T гена АBСB1 с высотой и степенью пигментации опухоли (р = 0,0391 и р = 0,0381), состоянием сосудов и эпителиоидно-клеточным/смешанно-клеточным типом УМ (0,0493 и 0,0569). Генотип ТТ у больных УМ не выявлен.
Заключение. Показана высокая частота мутаций в генах GNAQ/GNA11 и ассоциация аллеля С полиморфного маркера C3435T гена ABCB1 с неблагоприятными клиническими и морфологическими вариантами УМ. Выявленные особенности могли бы быть использованы для разработки в ходе дальнейших исследований современных подходов к прогнозированию течения УМ, а также для скрининга пациентов, входящих в группу риска по данному заболеванию.



Введение
Злокачественные внутриглазные опухоли меланоцитарного генеза представляют угрозу не только для зрения, но и для жизни пациента. Их частота достигает 15% общего числа меланом других локализаций. При этом частота увеальной меланомы (УМ) составляет 85–88% всех первичных внутриглазных злокачественных новообразований [1].
В России заболеваемость УМ колеблется от 6,23 до 8 человек на 1 млн взрослого населения в год [1]. В педиатрической популяции данный показатель значительно ниже [2].
УМ характеризуется агрессивным, прогрессирующим течением, высокой вероятностью метастазирования и летального исхода. Через пять лет у 50% пациентов с УМ после проведенного лечения диагностируют метастазы в печени [3, 4].
Поиску факторов прогноза течения опухолевого процесса при УМ в последние годы придается особое значение. Первыми были изучены клинические факторы. К ним относятся пол, возраст, расовая принадлежность, иммунологический статус, общий статус больного, сопутствующие заболевания, локализация и размеры опухоли [5, 6]. К сожалению, на текущий момент взаимосвязь многих из перечисленных факторов с УМ изучена недостаточно. Более чувствительны патоморфологические факторы: тип гистологического строения опухоли, степень инвазии склеры, прорастание за пределы фиброзной капсулы, характер и тип ангиогенеза, степень лимфоидной инфильтрации в строме опухоли, уровень пролиферативной активности клеток новообразования, размеры ядра и ядрышкового анализатора и т.д. [7].
Выявление молекулярно-генетических изменений при УМ представляется наиболее перспективным способом прогнозирования течения заболевания. На сегодняшний день накоплен большой опыт в изучении цитогенетических изменений при УМ [8–9, 11]. К наиболее характерным хромосомным перестройкам и нарушениям численности отдельных хромосом можно отнести потерю одной копии хромосомы 3 (моносомия 3), что коррелирует с увеличением размера опухоли, вовлеченностью цилиарного тела, наличием в опухоли эпителиоидных клеток, полей оранжевого пигмента на поверхности опухоли, а также наличием замкнутых сосудистых петель [8–11].
В УМ удалось выявить мутации онкогенов, характерные для кожных меланом, однако частота их встречаемости невелика. Например, мутации BRAF при УМ обнаруживают в 13% случаев. При кожных меланомах частота данных мутаций достигает 90% [12]. В последние годы выявлена мутация новых онкогенов GNAQ и GNA11 в ряде опухолевых процессов органа зрения. Частота обнаружения мутации при УМ, по данным разных авторов, – 46–90% [13–15]. Роль полиморфизма гена ABCB1 при УМ изучена в единичных работах [16, 17].
Целью исследования стал анализ мутаций в онкогенах GNAQ и GNA11 и полиморфизма гена ABCB1/MDR1, их корреляции с клиническими и морфологическими характеристиками при первичной УМ.
Материал и методы исследования
Всего обследовано 30 пациентов (12 мужчин и 18 женщин, соотношение 2:3) в возрасте от 23 до 72 лет (средний возраст 52,5 ± 9,1 года). Высота опухоли – от 2,6 до 13,8 мм (9,05 ± 3,8 мм), диаметр основания опухоли – от 8,2 до 21,9 мм (15,4 ± 5,6 мм). Объектом изучения стали опухоли цилиохориоидальной области (n = 5 (16,7%)), хориоидеи (n = 22 (73,3%)) и иридоцилиохориоидальной области (n = 3 (10%)).
Из исследования были исключены больные с обострением хронических воспалительных процессов, аутоиммунными, наследственными и психическими заболеваниями. В качестве популяционного контроля при анализе полиморфизма гена ABCB1 использовали сопоставимую по половозрастным характеристикам выборку онкологически здоровых индивидуумов (n = 60).
Исследованы препараты ДНК, выделенные из образцов УМ, полученных при энуклеации пораженного глаза. Гистологическая верификация опухоли проведена в отделе патологической анатомии и гистологии Московского НИИ глазных болезней им. Гельмгольца. По гистологическому строению выделяли опухоли веретеноклеточного типа – 16 (53,3%) пациентов, смешанно-клеточного – девять (30%) и эпителиоидно-клеточного – пять (16,7%) больных. ДНК из образцов свежезамороженной опухолевой ткани выделяли методом фенол-хлороформной экстракции. Выделенные образцы ДНК хранились при температуре -20 оС.
Для выявления мутации в генах GNAQ и GNA11 использовали метод определения полиморфизма длины рестрикционных фрагментов (ПДРФ-анализ, RFLP – restriction fragment length polymorphism). Нуклеотидные последовательности праймеров приведены в табл. 1. Идентификация аллелей полиморфного маркера C3435T (rs1045642) гена АBСB1 также осуществлялась на основании анализа ПЦР-ПДРФ. Для ПЦР использовали следующие олигонуклеотиды: ABCB-3435-F 5`-aggtttcacatcaccaagattcc-3` и ABCB-3435-R 5`- TTCTCAGAAAGGAGTATGCCTTA-3`. ПЦР проводили в 25 мкл реакционной смеси, содержащей 60 мМ Трис-HCl, рН 8,9, 10 мМ 2-меркаптоэтанол, 25 мМ КСl, 0,1%-ный Тритон Х-100; 0,25 мМ каждого dNTP; 1–10 нг ДНК; 25 пмолей каждого праймера; 2,0 ед Taq-полимеразы («СибЭнзим»); MgCl2 в концентрации 2,0 мM. Амплификацию (на амплификаторe Терцик, Россия) выполняли по следующей программе: 95 °С, 1 минута 30 секунд; 35 циклов 92 °С, 15 cекунд; 60 °С, 20 секунд; 72 °С, 15 секунд; 72 °С, 1 минута 30 секунд. Далее амплифицированный фрагмент ДНК подвергали обработке соответствующей рестриктазой (табл. 1). Полноту расщепления ДНК рестриктазами проверяли путем расщепления 1 мкг фага лямбда за один час. Для продукта амплификации использовали трехкратное количество фермента.
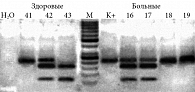
Амплифицированный фрагмент ДНК гена АBСB1 подвергали обработке с использованием рестриктазы PctI («СибЭнзим») в термостате при температуре 50 °С в течение 16 часов. При наличии мутантного ТТ-генотипа амплифицируемый в ходе ПЦР фрагмент гена АBСB1 размером 206 п.н. гидролизуется рестриктазой PctI на два фрагмента – 143 и 63 п.н. В гетерозиготном генотипе гена АBСB1-СТ присутствуют все три фрагмента.
Результаты ПДРФ анализировали электрофоретически в 10%-ном полиакриламидном геле с добавлением бромистого этидия (0,5 мкг/мл) и визуализацией в проходящем ультрафиолетовом свете (рис. 1).
Статистический анализ проводили с использованием точного критерия Фишера. Расчеты осуществлялись в пакетах программ для Windows (Microsoft Excel, Statistica 6.0 RUS).
Результаты и их обсуждение
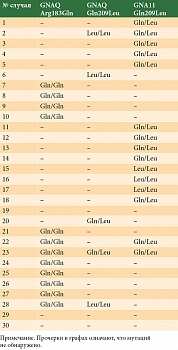
При ПДРФ-анализе 30 препаратов УМ-мутации в генах GNAQ и GNA11 были выявлены у 27 (90%) из 30 обследованных пациентов (табл. 2). Мутации в 5-м экзоне (Gln209) в гене GNAQ обнаружены у пяти (16,7%) пациентов, в гене GNA11 – у половины (50%).
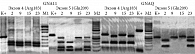
В 4-м экзоне (Arg183) гена GNAQ у 12 (40%) обследованных пациентов зафиксированы гомозиготные мутации. В 4-м экзоне (Arg183) гена GNA11 мутаций не найдено. В 93% случаев (в 25 из 27) мутации глутамина в 209-м положении и аргинина в 183-м положении в генах GNAQ и GNA11 взаимоисключающие, то есть наличие одной мутации исключает наличие другой, что согласуется с данными литературы [13–15]. Примеры анализа мутаций приведены на рис. 2. В то же время, согласно данным литературы, частота мутаций в 5-м экзоне (Gln209) генов GNAQ и GNA11 составляет 45 и 32% соответственно, в 4-м экзоне (Arg183) для обоих генов ≈ 6% [13–15].
У трех пациентов из 27 выявлены одновременно две мутации. В случае мутации в паре GNAQ (Gln209)/GNA11 (Gln209) опухоль имела цилиохориоидальную локализацию. В другом случае при выявлении мутации в паре GNAQ (Arg183)/GNAQ (Gln209) опухоль имела смешанно-клеточный тип строения, у пациента присутствовал отягощенный семейный анамнез по онкологическим заболеваниям. В третьем случае при наличии мутаций в паре GNAQ (Arg183)/GNA11 (Gln209) опухоль располагалась в хориоидее и имела смешанно-клеточный тип строения. В одном случае удалось выявить три мутации в генах GNAQ (Arg183)/GNAQ (Gln209)/GNA11 (Gln209). У данного пациента опухоль располагалась также в хориоидее и имела веретеноклеточный тип строения.
По данным литературы, статистически значимых ассоциаций между мутациями в генах GNAQ и GNA11 при первичной УМ и клиническими (пол, возраст, высота и диаметр основания опухоли, пигментация), цитогенетическими или молекулярными параметрами не зафиксировано [13–15].
Нами проведена оценка ассоциаций между мутациями в генах GNAQ и GNA11 и клиническими параметрами опухоли, такими как локализация, размеры образования, наличие пигментации, гемофтальма, отслойки сетчатки, субретинального экссудата, видимых собственных сосудов, полей оранжевого пигмента, экстрабульбарного роста, а также гистологическим типом опухоли и наличием отягощенного семейного анамнеза в отношении онкологической патологии у пациента. При этом удалось установить статистически значимую ассоциацию частоты мутации глутамина в 209-м положении гена GNAQ с высокой отслойкой сетчатки (4/11 против 1/19, p = 0,0472). В то же время с другими клиническими признаками значимых связей не зарегистрировано.
По данным C.D. Van Raamsdonk и соавт., мутации в генах GNAQ и GNA11 наиболее часто отмечаются в УМ эпителиоидно-клеточного и смешанно-клеточного типа по сравнению с веретеноклеточным типом. Однако подобная разница не носит статистически значимого характера [14]. В нашем исследовании частота мутации в экзоне 5 гена GNA11 в опухоли веретеноклеточного типа в 2,8 раза превышала таковую при эпителиоидно-клеточном типе (9/16 (56%) против 1/5 (20%)).
Учитывая, что веретеноклеточная УМ характеризуется более благоприятным течением по сравнению с эпителиоидно-клеточной и смешанно-клеточной, можно предположить, что выявление означенной мутации может свидетельствовать о более доброкачественном варианте течения УМ. Тем не менее данный вопрос сложный и многофакторный, требующий дальнейшего изучения.
Распределение частот аллелей и генотипов полиморфного маркера C3435T гена АBСB1 в контрольной группе и группе больных УМ представлено в табл. 3. В 80% случаев выявлен аллель С, что свидетельствует о высокой специфичности данного аллеля для УМ. При этом в опытной группе аллель С встречался почти в два раза чаще, чем в контрольной (80 против 41,7%).
Показана достоверная ассоциация предрасполагающего генотипа СС-гена АBСB1 с риском развития УМ. Так, частота данного генотипа в группе больных оказалась в четыре раза выше, чем в группе контроля. Между тем генотип ТТ у больных не обнаружен. Ассоциация генотипа CТ с риском развития УМ отмечалась в 40% случаев от общего количества аллелей С. Вместе с тем данная ассоциация не была значимой (p > 0,05). Таким образом, можно предположить, что наличие аллеля С является неблагоприятным фактором при развитии УМ, в то время как аллель Т можно рассматривать как благоприятный фактор.
Корреляция частот генотипов СТ и СС полиморфного маркера C3435T гена АBСB1 с параметрами прогрессии УМ представлена на рис. 3.
Выявлена значимая ассоциация генотипа СС полиморфного маркера C3435T гена ABCB1 со степенью пигментации опухоли (с выраженной пигментацией исследовано 13 случаев, со слабой – 14, без пигментации – три) (диаграмма А, рис. 3). Частоты генотипов СТ и СС при выраженной пигментации опухоли значительно не отличались друг от друга и составили 52 и 46% соответственно. В случае умеренно выраженной пигментации или в ее отсутствие частота генотипа СС более чем в два раза превышала таковую для генотипа СТ (71% (12/17) против 29% (5/17)).
В настоящее время нет единого мнения о роли пигментации в опухолевом процессе при УМ, но большинство исследователей сходятся во мнении, что именно беспигментные и малопигментированные опухоли прогностически наиболее неблагоприятны [5]. В связи с этим наши данные могут свидетельствовать о большей злокачественности опухолей с генотипом СС.
Анализ распределения частот генотипов СС и СТ в зависимости от высоты опухоли показан на диаграмме Б (рис. 3). Исследованные опухоли были разделены на две группы: < 10 мм (n = 18) и ≥ 10 мм (n = 12). При этом частота генотипов СС и СТ в первой группе была одинаковой – 50% (по девять глаз в каждой группе). Во второй группе отмечалось трехкратное увеличение частоты генотипа СС по сравнению с генотипом СТ (75 и 25% соответственно), что свидетельствует о важной роли предрасполагающего генотипа СС гена ABCB1 в прогрессии УМ.
Выявлена также значимая ассоциация частот генотипов СС и СТ с наличием видимых сосудов в опухоли (n = 23), что также принято считать относительно неблагоприятным прогностическим фактором (диаграмма В, рис. 3). При этом частота генотипа СС составила 65%, частота генотипа СТ – 35%. В семи случаях видимые собственные сосуды при офтальмоскопии не обнаружены, при этом частота генотипов СС и СТ отличалась незначительно – 42 и 58% соответственно.
При оценке ассоциации генотипов гена ABCB1 с различными гистологическими типами опухолей, такими как прогностически благоприятный веретеноклеточный (n = 16), менее благоприятный смешанно-клеточный (n = 9) и неблагоприятный эпителиоидно-клеточный (n = 5), смешанно-клеточный и эпителиоидно-клеточный типы были объединены в одну группу (диаграмма Г, рис. 3). Частота генотипов СС и СТ при веретеноклеточном типе опухоли не различалась – по 50% (по восемь глаз в каждой группе). В случае смешанно-клеточного типа опухоли частота генотипа СТ достигла 33% (три глаза). Частота генотипа СС была в два раза больше – 66% (шесть глаз). При эпителиоидно-клеточном типе опухоли разница была еще заметнее: частота генотипа СТ – 20% (один глаз), частота генотипа СС – 80% (четыре глаза). В объединенной группе с эпителиоидно-клеточным и смешанно-клеточным типом опухоли частота генотипа СТ составила 30%, генотипа СС – 70%.
Таким образом, показана неблагоприятная прогностическая значимость генотипа СС гена ABCB1 для развития УМ.
В одной из работ продемонстрирована возможность выявления данных полиморфизмов в периферической крови, что в перспективе можно рассматривать в качестве потенциального скрининга по УМ для пациентов, входящих в группу риска по данному заболеванию, а также прогнозирования течения заболевания [18].
Заключение
В настоящей работе изучено распределение частот генотипов полиморфного маркера C3435T гена АBСB1 и мутаций в онкогенах GNAQ и GNA11 с риском развития УМ и их связь с клинико-патоморфологическими параметрами УМ. Показана связь частоты мутаций в гене GNA11 с гистологическим типом опухоли. Выявлена ассоциация мутации в гене GNAQ с высокой отслойкой сетчатки. Определена статистически значимая ассоциация генотипа СС и ряда клинических (умеренная пигментация опухоли, высота опухоли и наличие видимых собственных сосудов) и патоморфологических (смешанно-клеточный и эпителиоидно-клеточный тип опухоли) факторов. В то же время наличие аллеля Т гена АBСB1, безусловно, свидетельствует об относительно благоприятном течении опухолевого процесса.
Полученные нами данные могут свидетельствовать о значимости генотипов полиморфного маркера C3435T гена АBСB1 и онкогенов GNAQ и GNA11 в развитии УМ и их патогномоничности для этой патологии. Выявленные особенности могли бы быть использованы для разработки в ходе дальнейших исследований современных подходов к прогнозированию течения УМ, а также для скрининга пациентов, входящих в группу риска по данному заболеванию.
S.V. Saakyan, A.Yu. Tsygankov, A.G. Amiryan, V.I. Loginov, A.M. Burdenny
Moscow Helmholtz Research Institute of Eye Diseases
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Research Institute of General Pathology and Pathophysiology
Contact person: Aleksandr Yuryevich Tsygankov, alextsygankov1986@yandex.ru
Objective – to analyze mutations in oncogenes GNAQ and GNA11 as well as polymorphism in gene ABCB1/MDR1, their correlation with clinical and morphological characteristics in primary uveal melanoma (UM).
Materials and methods. There were examined and treated 30 patients (12 males and 18 females, 2:3 ratio) aged 23–72 (average age 52.5 ± 9.1 years) with primary UM. In all cases, patients underwent enucleation with histologically confirmed diagnosis of UM. Mutations in genes GNAQ/GNA11 and polymorphism in gene ABCB1/MDR1 were assessed by using PCR-RFLP analysis.
Results. It was found that 27 (90%) out of 30 samples contained mutations in exon 4 and 5 of genes GNAQ/GNA11. Rate of mutations in exon 4 and 5 in gene GNAQ was 40 and 16.7%, in gene GNA11 – 0 and 50%, respectively. A significant association between rate of mutated glutamine at position 209 in gene GNAQ and high rate of retinal detachment (0.55 at p < 0.05) was found. Rate of mutations in exon 5 of gene GNA11 was fund to be higher by 2.8-fold in spindle-cell vs. epithelioid type tumor. Allele C of polymorphic marker C3435T in gene ABCB1 was found in 80% cases. Rate of predisposing genotype CC in patients with UM vs. control group was higher by 4-fold. Such genotype was associated with high risk of developing UM (relative risk 8.5; p = 7 × 10-6). A significant correlation between incidence rate of CC genotype of polymorphic marker C3435T in gene АBСB1 and height and pigmentation degree of the tumor (p = 0.0391 and p = 0.0381) as well as condition of vascular vessels and epithelioid/mixed cell type of UM (0.0493 and 0.0569) was observed. TT genotype was not found in UUM patients.
Conclusions. High rate of mutations in genes GNAQ/GNA11 as well as association of allele C of polymorphic marker C3435T in gene ABCB1 with unfavorable clinical and morphological UM types were found. These data might be used in further studies for developing modern approaches for predicting course of UM as well as for screening UM risk group patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


