Мультиморбидная среда обитания: адалимумаб в лечении пациентов с ревматическими и другими сопутствующими заболеваниями
- Аннотация
- Статья
- Ссылки

В настоящее время становится очевидным, что необходимо лечить не ревматоидный артрит (РА), а пациента с РА. Для реализации этой задачи специалисты ведут работу в двух направлениях. Первое – разработка новых препаратов и схем терапии для достижения длительной ремиссии заболевания. Так, благодаря генной инженерии был создан препарат адалимумаб.
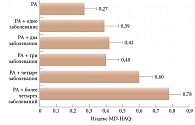
Второе направление – улучшение качества жизни больного, которое зависит не только от достижения ремиссии РА, но и от наличия и течения сопутствующих заболеваний. Каждое следующее сопутствующее заболевание ухудшает качество жизни пациентов в геометрической прогрессии, несмотря на ремиссию РА (рис. 1)1.
Так, у больных при наличии только РА в состоянии ремиссии индекс MD-HAQ (Multi-Dimensional Health Assessment Questionnaire – многомерный опросник оценки здоровья) равен 0,27 балла, а при сочетании РА с четырьмя и более сопутствующими заболеваниями индекс составляет уже 0,78 балла. При этом наибольший риск связан с состояниями, определяющими организменный дисметаболизм. К ним относятся хроническая болезнь почек, гепатопатии, ожирение, инсулинорезистентность, гиперурикемия, анемия, атеросклероз, поражение легких, инфекции, депрессия и возраст.
Поскольку наличие мультиморбидности, или пула приобретенных хронических состояний, типично для больных РА, использование адалимумаба предполагает его внедрение в мультиморбидную среду организма. В этой связи очень важным представляется вопрос взаимодействия лекарства и организма.
С практической точки зрения большое значение имеют данные об эффективности и безопасности лечения адалимумабом пациентов пожилого возраста. Установлена сопоставимая эффективность и переносимость терапии адалимумабом как у пожилых пациентов (> 65 лет), так и у молодых (< 65 лет)2. Анализ результатов четырех двойных слепых рандомизированных контролируемых и пяти открытых исследований также позволил сделать вывод о том, что адалимумаб одинаково безопасен у пациентов разного возраста3.
Однако у пациентов старше 65 лет применять препарат следует с осторожностью, поскольку в данной возрастной группе частота возникновения серьезных инфекций оказалась выше, чем у пациентов моложе 65 лет. Профессор А.В. Гордеев еще раз подчеркнул, что различий в эффективности терапии в группах не выявлено и корректировки дозы препарата не требовалось4.
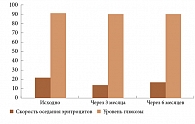
Не менее важным представляется влияние адалимумаба на метаболизм глюкозы. Известно, что фактор некроза опухоли (ФНО) способен ингибировать аутофосфорилирование инсулиновых рецепторов, индуцировать развитие инсулинорезистентности, угнетать экспрессию белкового переносчика глюкозы, стимулировать липолиз, увеличивая содержание жирных кислот. В исследовании, посвященном оценке влияния анти-ФНО-терапии на метаболизм глюкозы у больных анкилозирующим спондилоартритом (АС), псориатическим артритом (ПсА) и ювенильным идиопатическим артритом (ЮИА), показано, что адалимумаб эффективно снижает воспаление, не воздействуя при этом на метаболизм глюкозы (рис. 2)5.
Другое исследование было посвящено влиянию адалимумаба на инсулинорезистентность, бета-клетки поджелудочной железы и активацию инсулина у больных РА (по сравнению с абатацептом)6. На фоне приема адалимумаба у пациентов с высокими показателями инсулинорезистентности статистически более значимо, чем на фоне приема абатацепта, снижались инсулинорезистентность, уровень глюкозы и инсулина в крови, улучшалась функция бета-клеток поджелудочной железы. Продемонстрировано также, что анти-ФНО-терапия тормозит образование рецептора инсулина 1 Ser312.
Доказан эффект ингибиторов ФНО-α в отношении липидного профиля. Так, на фоне терапии увеличилось содержание общего холестерина и липопротеинов высокой плотности, при этом не изменились атерогенный индекс и уровень липопротеинов низкой плотности. Кроме того, ингибиторы ФНО-α способствовали аккумуляции жира (подкожного и висцерального). Предполагают, что препараты данной группы способны снижать риск сердечно-сосудистых заболеваний благодаря противовоспалительному действию.
Наличие собственного антиатерогенного эффекта отличает адалимумаб от других ингибиторов ФНО-α. Адалимумаб ингибирует аккумуляцию холестерина и блокирует мембранный ФНО-α, когда имеет место воспалительный процесс в виде активного РА или нестабильность атеросклеротических бляшек7.
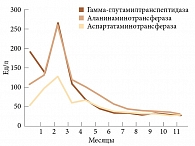
Роль ФНО-α в патогенезе неалкогольного жирового гепатита определяется его способностью влиять на инсулинорезистентность, воспаление и апоптоз. Экспрессия ФНО-α коррелирует с фиброзом печени. Доказан положительный эффект адалимумаба на неалкогольный фиброз печени (рис. 3)8.
Результаты исследования по оценке терапии ингибиторами ФНО-α больных АС показали отсутствие гепатотоксичности на фоне терапии адалимумабом. Так, несмотря на большую продолжительность терапии (12 месяцев), показатели аспартатаминотрансферазы и аланинаминотрансферазы не превышали нормальных значений9.
Считается, что применение ингибиторов ФНО-α может приводить к развитию таких осложнений, как гранулематозные (туберкулез, гистоплазмоз, криптококкоз) и бактериальные инфекции, неинфекционные гранулематозные заболевания, легочные узлы, интерстициальные/фиброзные поражения, аутоиммунные заболевания легких. Ингибиторы ФНО-α, действительно, чаще и прогностически менее благоприятно влияют на легкие, чем синтетические базисные противовоспалительные препараты. Однако результаты канадского исследования продемонстрировали, что частота смертей среди больных РА с предшествующим интерстициальным поражением легких в группе ингибиторов ФНО-α составила 2,8%, в группе болезнь-модифицирующих антиревматических препаратов – 1,9%10. Указанные различия не были статистически значимыми.
В гораздо меньшей степени неблагоприятное воздействие на легкие оказывает адалимумаб. По данным исследования BIOGEAS (1990–2010 гг.), адалимумаб в 10 раз реже приводит к интерстициальному поражению легких, чем этанерцепт и инфликсимаб11. Безопасность и клиническая эффективность адалимумаба изучались на модели развития бронхиальной астмы у животных. В патогенезе заболевания важная роль принадлежит ФНО-α: от констрикции гладкой мускулатуры до эозинофилии. При бронхиальной астме наблюдаются перибронхиальное периваскулярное воспаление, утолщенные и воспаленные альвеолы. На фоне лечения адалимумабом у животных с индуцированной бронхиальной астмой данные проявления отсутствовали. Адалимумаб достоверно уменьшал гипертрофию и отек перибронхиальной гладкой мускулатуры, клеточную инфильтрацию, легочный счет (р = 0,003)12.
Оценивалось влияние адалимумаба и на риск развития различных видов рака, а также его рецидивов. Был сделан вывод: заболеваемость разными видами рака на фоне терапии адалимумабом не отличается от таковой в популяции, за исключением частоты лимфом. Частота развития лимфом была выше у пациентов с РА, получавших адалимумаб, однако не превышала таковую у пациентов с РА, не получавших ингибиторы ФНО. Время возникновения первой опухоли не зависело от ревматологического заболевания и было стабильно за весь период наблюдения13–15.
Были отмечены и некоторые особенности – небольшое, но значимое увеличение риска развития немеланомного рака кожи у пациентов с РА, псориазом и болезнью Крона. Риск рецидива «старой» опухоли был статистически не значим. Именно поэтому больные, перенесшие радикальную операцию и химиотерапию, могут принимать препарат, не опасаясь риска рецидива16.
Накопленный за 1997–2010 гг. клинический материал (более 23 458 пациентов) свидетельствует о низкой частоте (менее 0,1 случая на 100 пациенто-лет) развития серьезных оппортунистических инфекций на фоне терапии адалимумабом.
Так, кандидозный эзофагит зафиксирован в трех случаях. На кандидозный сепсис, аспергиллез, кокцидиоидомикоз, цитомегаловирусную инфекцию, нокардиоз, опоясывающий лишай приходится по два случая17. Грибковая инфекция при приеме адалимумаба развивалась реже, чем при приеме этанерцепта и инфликсимаба.
В ряде работ продемонстрирована возможность применения адалимумаба у больных с предтерминальной и терминальной стадиями хронической почечной недостаточности18.
Исследований применения адалимумаба у пациентов с хронической сердечной недостаточностью (ХСН) не проводилось. Однако при клинических испытаниях другого ингибитора ФНО наблюдалось повышение количества нежелательных реакций со стороны сердечно-сосудистой системы, включая развитие и прогрессирование ХСН. Случаи прогрессирования ХСН описывались также у пациентов, принимавших адалимумаб. Именно поэтому пациентам с сердечной недостаточностью следует с осторожностью назначать адалимумаб и регулярно проводить мониторинг их состояния4.
Получены данные о применении препарата пациентами со вторичным амилоидозом и фокальным сегментарным гломерулосклерозом (ФСГС), резистентными к традиционной терапии. У 40% пациентов с ФСГС на фоне 16-месячной терапии адалимумабом сохранялась неизменной скорость клубочковой фильтрации и в два раза уменьшилась протеинурия19.
Анализ литературы показывает, что лечение адалимумабом снижает уровень депрессии и улучшает качество жизни больных20. Так, через 12 недель у пациентов с ПсА в группе адалимумаба выраженность депрессии по шкале Зунга снизилась практически на 6 баллов, в группе плацебо – примерно на 2 балла (р = 0,001).
Резюмируя вышесказанное, можно сделать вывод, что мультиморбидность для адалимумаба действительно является средой обитания. Обширная доказательная база подтверждает не только высокую эффективность препарата, но и благоприятный профиль безопасности у больных с различными ревматическими заболеваниями, обремененных большим спектром сопутствующих состояний.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.