Настоящее и будущее терапии урологических инфекций. XV конгресс Российского общества урологов. Сателлитный симпозиум компании «Астеллас»
- Аннотация
- Статья
- Ссылки







Рациональные подходы к терапии рецидивирующих циститов и уретритов
Необходимо понимать, что важную роль в патогенезе рецидивов цистита играет взаимодействие микроорганизма (резистентность, вирулентность, патогенность возбудителей, способность моделировать врожденный иммунный ответ слизистых, создание внутриклеточных бактериальных сообществ) и макроорганизма (несостоятельность мукозального иммунитета и персистенция возбудителей).
Восходящий путь инфицирования при неосложненной ИНМП давно доказан многочисленными исследованиями. Уропатогенная кишечная палочка колонизирует периуретру и влагалище, затем восходит по мочеиспускательному каналу в мочевой пузырь. Ответная воспалительная реакция со стороны слизистой мочевого пузыря запускается уропатогенной Escherichia coli через факторы вирулентности – фимбрии, адгезины и пр., которые служат посредниками адгезии к уротелию.
Докладчик объяснила, что чувствительность пациента к ИНМП обусловлена генетическими механизмами, которые контролируют врожденный иммунный ответ, более того, Escherichia coli способна моделировать воспалительный ответ уротелия.
При ИНМП штаммы уропатогенной кишечной палочки могут проникать в эпителиальные клетки стенки мочевого пузыря и формировать внутриклеточные бактериальные сообщества, в которых они персистируют в течение длительного времени, периодически вызывая обострения цистита.
Актуальной проблемой, связанной с лечением рецидивирующей ИНМП, является также рост резистентности уропатогенов. По данным исследования ДАРМИС (2010–2011), в которое были включены 987 внебольничных штаммов уропатогенов из 28 центров 20 городов России, Беларуси и Казахстана, высокий уровень резистентности Escherichia coli отмечался к ампициллину, амоксициллину клавуланату, налидиксовой кислоте, фторхинолонам и др.1
Профессор Т.С. Перепанова отметила, что подходы к лечению острого и рецидивирующего цистита различаются. Цель лечения острого цистита – это полная эрадикация возбудителей, рецидивирующего цистита – увеличение безрецидивного периода и, как следствие, улучшение качества жизни пациента.
В настоящее время, в связи с новыми знаниями о патогенезе рецидивирующей ИНМП, изменились и рекомендации по профилактике обострений цистита. Пациенткам с рецидивирующей ИНМП адекватная антибактериальная терапия назначается только после того, как были неэффективны меры неантимикробной профилактики.
По мнению международных экспертов, в качестве антимикробной профилактики рецидивирующей ИНМП могут применяться фосфомицина трометамол, нитрофураны, цефалоспорины, фторхинолоны в виде курсовой терапии. Российские эксперты не рекомендуют длительное лечение антимикробными препаратами в субингибирующих дозах, поскольку оно способствует селекции резистентных штаммов микроорганизмов, биопленкообразованию, развитию аллергических реакций.
В российских и европейских рекомендациях 2015 г. лечение обострений ИНМП рекомендовано полными курсовыми дозами антимикробных препаратов в зависимости от результатов бактериологического исследования мочи.
К неантимикробной профилактике относится применение иммунных препаратов (Уро-Ваксом®, интерфероны), эстрогенов местно, фитопрепаратов, пробиотиков, препаратов клюквы, а также эндовезикальные инстилляции препаратов гиалуроновой кислоты.
Профессор Т.С. Перепанова акцентировала внимание слушателей на возможностях иммунопрофилактики рецидивирующих ИНМП. С 2010 г. Европейская ассоциация урологов рекомендует использовать для иммунопрофилактики рецидивирующих ИНМП препарат Уро-Ваксом®, который представляет собой лиофилизат 18 штаммов Escherichia coli. С 2012 г. препарат включен и в российские рекомендации по лечению ИНМП.
Уро-Ваксом® принимают по схеме: одна капсула утром натощак в течение трех месяцев, затем перерыв в течение трех месяцев, после чего повторный прием по одной капсуле в течение десяти дней в начале каждого из трех последующих месяцев (рис. 1).
Результаты исследований показали, что Уро-Ваксом® вызывает стимуляцию как врожденного, так и приобретенного иммунного ответа.
Уро-Ваксом® стимулирует фагоцитарную активность макрофагов и нейтрофилов, активизирует созревание дендритных клеток и увеличивает экспрессию адгезивных молекул нейтрофилами. На поверхности эпителия кишечника бактериальные компоненты препарата Уро-Ваксом® распознаются дендритными клетками и инициируют различные реакции специфического иммунного ответа. Происходит поляризация врожденного иммунитета, стимуляция антиген-презентирующих клеток в пейеровых бляшках, что приводит к индуцированию выработки секреторного иммуноглобулина А. В эпителии мочевыводящих путей накапливается большое количество секреторного иммуноглобулина А, защищающего клетки уротелия от инвазии уропатогенов, что является важным фактором профилактики ИНМП и их рецидивов2, 3.
Эффективность препарата Уро-Ваксом® в профилактике и лечении ИНМП изучалась в ряде исследований. В ходе метаанализа, оценивавшего эффективность иммунопрофилактики ИНМП, доказано снижение на 76% частоты рецидивов заболевания и на 50% потребления антибиотиков после терапии препаратом Уро-Ваксом®. На фоне приема препарата Уро-Ваксом® значительно уменьшались и клинические проявления ИНМП, такие как лейкоцитурия – на 45%, бактериурия – на 33%, дизурия – на 52%. Результаты исследований продемонстрировали хорошую переносимость препарата4.
Профессор Т.С. Перепанова представила данные сравнительного исследования, в котором изучалось влияние препарата Уро-Ваксом® на эффекторы мукозального иммунитета у женщин, страдающих рецидивирующими ИНМП. Применение препарата повышало уровень экспрессии генов дефенсинов (противомикробных пептидов) в течение одного месяца, что свидетельствовало о корригирующем влиянии препарата Уро-Ваксом® на врожденные эффекторы локального слизистого иммунитета.
Таким образом, клинические исследования подтверждают эффективность препарата Уро-Ваксом® в отношении снижения частоты рецидивов неосложненных ИНМП.
Еще одной сложной задачей в урологической практике является ведение пациентов с рецидивирующим негонококковым уретритом. На сегодняшний день среди специалистов нет единой точки зрения по диагностике и управлению этим состоянием. Персистирующий или рецидивирующий, симптоматический уретрит возникает через 30–90 дней после эпизода острого негонококкового уретрита у 10–20% пациентов. В клинических рекомендациях указано, что у пациента с признаками рецидивирующего уретрита необходимо взять уретральный материал на микроскопию. Диагноз ставится при обнаружении более 10–15 полиморфноядерных лейкоцитов в мазке из уретры у мужчины, леченного по поводу острого негонококкового уретрита. Рекомендован двух- или трехнедельный курс макролидов с пятидневным курсом метронидазола.
Согласно отечественным Клиническим рекомендациям по ведению больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями (2012), для терапии инфекции хламидийной этиологии предпочтительно использовать джозамицин 500 мг три раза в сутки, доксициклина моногидрат 100 мг два раза в сутки в течение 7–21 дня, азитромицин 1,0 г однократно (в зависимости от локализации).
Существуют проблемы выбора препарата для лечения урогенитальной инфекции, вызванной Mycoplasma genitalium. Это связано не только с трудностями культивирования возбудителя инфекции, мониторинга чувствительности к антибиотикам, но и с низким уровнем клинического эффекта тетрациклинов и азитромицина в отношении Mycoplasma genitalium. Поэтому при уретрите, вызванном данным патогеном, рекомендуется применение в течение десяти дней джозамицина 500 мг три раза в сутки или доксициклина моногидрата 100 мг два раза в сутки. К альтернативным схемам относятся левофлоксацин 500 мг один раз в сутки или офлоксацин 400 мг два раза в сутки, оба препарата принимаются также в течение десяти дней.
Джозамицин является одним из самых эффективных антибиотиков для лечения урогенитальной инфекции, вызванной хламидиями, микоплазмами и уреаплазмами, у разных категорий пациентов, включая беременных и детей. Беременным джозамицин (Вильпрафен®) назначается по 500 мг три раза в сутки в течение семи – десяти дней, детям с массой тела до 45 кг – 50 мг/кг/сут в три приема в течение семи – десяти дней5.
Вильпрафен® обладает благоприятными фармакокинетическими свойствами. К его преимуществам относятся устойчивость к гидролизу в кислой среде и быстрое создание высокой концентрации в клетках и тканях. Концентрация препарата почти в 20 раз выше в полиморфноядерных лейкоцитах человека, моноцитах и альвеолярных макрофагах, чем в крови. Вильпрафен® отличается иммуномодулирующими свойствами, которые могут способствовать усилению эффекта у больных с воспалительными заболеваниями, а также высоким уровнем безопасности.
Лечение рецидивирующих инфекций нижних мочевыводящих путей. Результаты многоцентрового исследования FLORA
Нерациональная антибиотикотерапия и самолечение запускают порочный круг развития рецидивирующей ИНМП: цистит неадекватный прием антибиотиков рост резистентности и дисбактериоз неполная эрадикация возбудителя рецидив.
Стратегия ведения пациентов с рецидивирующими ИНМП предусматривает не только назначение антибактериальной терапии, но и проведение неантимикробной профилактики. Среди препаратов, которые способствуют увеличению безрецидивного периода и имеют наибольшую доказательную базу, можно выделить Уро-Ваксом®. К настоящему моменту проведено более 12 клинических исследований эффективности этого препарата. Результаты продемонстрировали значительное уменьшение числа рецидивов ИНМП (в среднем на 40%) в группах больных, получающих Уро-Ваксом®.
На одном из международных саммитов в качестве альтернативной стратегии лечения ИНМП была предложена терапия препаратом Уро-Ваксом® в комбинации с цефиксимом. Уро-Ваксом® назначался по одной капсуле один раз в сутки в течение десяти дней с последующим продолжением приема препарата в течение трех месяцев в качестве средства профилактики при одном из обострений рецидивирующей ИНМП, а цефиксим – по 400 мг один раз в сутки в течение семи дней.
Для того чтобы подтвердить эффективность этой гипотезы, была проведена открытая проспективная многоцентровая наблюдательная программа FLORA с участием пяти российских медицинских научных центров: РМАПО, Первого МГМУ им. И.М. Сеченова, МГМСУ им. А.И. Евдокимова, Красноярского ГМУ им. В.Ф. Войно-Ясенецкого, Ростовского ГМУ. В рамках программы оценивались результаты комбинированной терапии рецидивирующих неосложненных ИНМП в повседневной лечебной практике врачей-урологов. В программу включали пациентов с двумя и более обострениями рецидивирующих ИНМП в течение шести месяцев, наличием клинических признаков обострения как минимум в течение двух дней до включения в исследование, бактериурией ≥ 103 КОЕ/мл. Больным назначались цефиксим (Супракс® Солютаб®6) и Уро-Ваксом®.
Первичная конечная точка исследования – частота обострений рецидивирующей ИНМП на одну пациентку через шесть месяцев от момента включения в программу (общее количество рецидивов ИНМП по сравнению с исходным уровнем). За вторичные конечные точки были приняты такие показатели, как продолжительность обострений на одну пациентку через шесть месяцев от момента включения в программу по сравнению с исходным уровнем, продолжительность антибиотикотерапии, частота нежелательных явлений.
В исследование были включены 52 пациентки, средний возраст 42,4 ± 16,2 года, средняя продолжительность заболевания циститом до момента включения в исследование 1,1 ± 2,6 года. Среднее количество рецидивов составило 2,9 ± 1,0, длительность рецидива – 8,6 ± 2,7 дня. Дизурия отмечалась у 100% пациенток, лейкоцитурия – у 51 (98,1%), бактериурия ≥ 103 КОЕ/мл – у 48 (92,3%), эритроцитурия – у 11 (21,2%) пациенток.
В течение наблюдательного периода пациентки получали комбинированное лечение. Эффективность терапии оценивалась в ходе пяти визитов. В результате лечения статистически значимо снизились частота (-93%) и продолжительность рецидивов (-94%), а также средняя продолжительность приема антибиотиков (-90%) (рис. 2). В ходе наблюдения также было зафиксировано уменьшение клинических проявлений ИНМП в части прекращения дизурии, бактериурии, эритроцитурии и снижении лейкоцитурии по сравнению с исходными данными.
Терапия была оценена как безопасная. Ни у одной пациентки, хотя бы однократно получившей Уро-Ваксом® и Супракс® Солютаб®, не было отмечено нежелательных явлений.
Завершая свое выступление, профессор Л.А. Синякова подчеркнула, что применение системного антибактериального препарата Супракс® Солютаб® при выявлении возбудителя в титре ≥ 103 КОЕ/мл и его чувствительности к указанному препарату в сочетании с препаратом Уро-Ваксом® способствует значительному улучшению качества жизни пациенток с неосложненными рецидивирующими ИНМП благодаря продлению безрецидивного периода.
Новое в этиопатогенезе и лечении хронического простатита. Данные российского исследования TAURUS
Как отметил д.м.н., профессор Первого МГМУ им. И.М. Сеченова Андрей Зиновьевич ВИНАРОВ, Европейская ассоциация урологов для лечения бактериального хронического простатита рекомендует использовать фторхинолоны, триметоприм, макролиды и тетрациклины, способные проникать в предстательную железу. При хроническом бактериальном простатите или подозрении на инфекционную этиологию хронической тазовой боли предпочтительно применять фторхинолоны в течение четырех недель. В случае резистентности к фторхинолонам или появления побочных реакций может быть назначен триметоприм на срок от 4 до 12 недель. Необходимо проводить повторную оценку состояния пациента в процессе лечения. Прием антибиотиков целесообразно продолжать лишь при наличии роста в исходном посеве и/или при наличии эффекта антибиотикотерапии. Общий период лечения больных хроническим простатитом должен составлять от четырех до шести недель.
Из группы фторхинолонов наибольшее распространение получили левофлоксацин и ципрофлоксацин. Возможности левофлоксацина в лечении хронического бактериального простатита изучались во множестве исследований. В одном из них 243 пациента с хроническим бактериальным простатитом получали левофлоксацин 500 мг/сут в течение 29 дней. В конце курса излечение или улучшение отмечено у 93,5% больных. Микробиологическая эффективность в конце терапии составила 94,9%7.
Широкое применение антибиотиков привело к росту резистентности патогенов при ИНМП. Однако в мире проведено ограниченное количество исследований по оценке устойчивости возбудителей при бактериальном простатите. В одном из них изучали эпидемиологические особенности и резистентность уропатогенов, изолированных у больных хроническим бактериальным простатитом. Исследователи отметили увеличение доли энтерококка и снижение доли кишечной палочки среди возбудителей заболевания по сравнению с данными 1990-х гг. Однако даже микробиологическая верификация возбудителя еще не гарантирует его эрадикации. В последние годы наблюдается нарастание антибактериальной полирезистентности уропатогенов, в том числе кишечной палочки, которая традиционно считается одним из главных возбудителей острого и хронического бактериального простатита8, 9. Некоторые авторы даже ставят вопрос о целесообразности назначения пероральных фторхинолонов в качестве антибиотикопрофилактики при трансректальной биопсии простаты10. Вероятно, это связано с тем, что в течение последних десятилетий фторхинолоны использовались в лечении широкого круга инфекционно-воспалительных заболеваний. В результате могла произойти селекция штаммов уропатогенов с приобретенной или врожденной устойчивостью к этой группе антибиотиков. В нашей стране количество резистентных к фторхинолонам внебольничных штаммов кишечной палочки приближается к 20%1, что заставляет в ряде случаев пересматривать тактику эмпирической терапии больных инфекционно-воспалительными заболеваниями мочевыделительной системы.
Вместе с тем исследование биоматериала, в том числе биоптата предстательной железы, методом полимеразной цепной реакции продемонстрировало наличие у больных хроническим простатитом и/или хронической тазовой болью в 37–40% случаев внутриклеточной бактериальной флоры, которая отсутствовала в биоптатах здоровых мужчин и могла быть причиной развития воспалительного процесса10–13. Препаратами выбора для лечения хронического простатита при обнаружении внутриклеточных бактериальных агентов (хламидий, уреаплазм и микоплазм) являются макролиды и тетрациклины.
В нашей стране была проведена проспективная наблюдательная программа TAURUS (2013–2014) по оценке эффективности макролидов и тетрациклинов у мужчин с хроническим простатитом в повседневной клинической практике. В программе TAURUS участвовали 30 врачей-исследователей из 23 центров Российской Федерации. В программу были включены 1268 больных хроническим простатитом, получающих терапию в амбулаторных условиях, в окончательный анализ вошли данные 1218 пациентов. Средний возраст участников составил 39,7 ± 12,7 года. В течение предшествующих трех месяцев лечение по поводу хронического простатита получали 14,6% больных, соматические заболевания отмечены у 28,2% пациентов.
Наблюдение включало два визита к врачу. В ходе первого визита после получения согласия пациентов на исследование проводили сбор анамнеза, обследование и назначали лечение. Во время второго визита пациенты проходили контрольное обследование, врач оценивал эффективность и безопасность терапии.
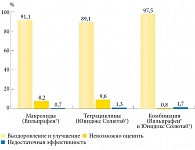
Пациенты были рандомизированы на три группы: 304 (25,0%) пациента получали макролиды, 393 (32,2%) – тетрациклины, 521 (42,8%) – комбинированную терапию. Участники принимали доксициклина моногидрат в дозе 100 мг два раза в сутки и/или джозамицин в дозе 500 мг три раза в сутки. По окончании исследования выздоровление и улучшение отмечено у 93,2% пациентов. В группе терапии макролидами этот показатель составил 91,1%, в группе терапии тетрациклинами – 89,1%, в группе комбинированной терапии – 97,5% (рис. 3).
В ходе исследования в общей популяции были зарегистрированы 44 нежелательных явления у 31 (2,6%) пациента – 3,3, 3,1 и 1,7% на фоне приема макролидов, тетрациклинов и их комбинации соответственно. Чаще всего наблюдались побочные эффекты со стороны желудочно-кишечного тракта. Однако общее число и качество побочных эффектов в целом соответствовали профилю безопасности исследуемых препаратов.
На основании результатов исследования TAURUS можно сделать вывод о высокой клинической эффективности и безопасности макролидов (джозамицина) и тетрациклинов (доксициклина моногидрата) и целесообразности их применения в терапии хронического простатита в рутинной клинической практике.
Завершая выступление, профессор А.З. Винаров отметил необходимость дальнейшего изучения эффективности и безопасности антибактериальных препаратов в лечении хронического простатита с учетом новых данных об этиологии заболевания и резистентности возбудителей.
Хронический простатит и влияние внутриклеточных возбудителей на фертильность мужчин
Проблему взаимосвязи хронического простатита и нарушений фертильности у мужчин рассмотрел д.м.н., профессор Первого МГМУ им. И.М. Сеченова Владимир Александрович БОЖЕДОМОВ.
Если значение в этиологии простатита таких патогенов, как Escherichia coli, Enterococcus faecalis, Proteus mirabilis, можно считать доказанным, то роль нетипичных микроорганизмов остается предметом дискуссий. В последнее время появляется все больше данных, подтверждающих участие хламидий, микоплазм, уреаплазм в развитии хронического простатита и нарушений мужской репродуктивной функции.
Докладчик представил данные собственного исследования этиологических факторов хронического воспаления предстательной железы у 283 бесплодных мужчин. Преобладающими патогенами были признаны типичные грамотрицательные микроорганизмы, прежде всего кишечная палочка. Однако в секрете простаты обнаруживались внутриклеточные патогены, такие как хламидии и микоплазмы, что может свидетельствовать об их возможном влиянии на развитие хронического воспаления.
Следует отметить, что частота встречаемости хламидий и других атипичных микроорганизмов в соскобах из уретры и секрете простаты у пациентов с урогенитальной инфекцией зависит от количества выделяемого секрета. При малом объеме секрета простаты проводимый анализ не может быть основанием для постановки диагноза.
К возможным механизмам снижения мужской фертильности на фоне хронического простатита относят развитие стриктур уретры и эякуляторных нарушений, повышение продукции активных радикалов кислорода полиморфноядерными лейкоцитами спермы, нарушения секреторной функции простаты, стимуляцию продукции антиспермальных антител, а также влияние патогенных микроорганизмов14.
По мнению экспертов Европейской ассоциации урологов, хронический простатит является одним из факторов риска нарушения мужской фертильности. Метаанализ 12 исследований показал, что воспалительные изменения предстательной железы отрицательно сказываются на показателях спермограммы у пациентов с хроническим простатитом15.
По данным другого исследования (n = 4265), в 10–20% случаев бесплодие было обусловлено инфекционными заболеваниями урогенитального тракта16. Внутриклеточные микроорганизмы (микоплазмы, хламидии, уреаплазмы) могут оказывать воздействие на сперматозоиды, нарушая их функцию и вызывая апоптоз.
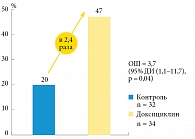
Фертильность и бесплодие при хроническом простатите различаются не концентрацией лейкоцитов в сперме, а комплексом факторов. Среди последних профессор В.А. Божедомов отметил продолжительность анамнеза хронического простатита, частоту рецидивов, наличие конкрементов в простате, нарушение дренажной функции семенных пузырьков, фагоцитарную активность лейкоцитов и другие признаки17. Концентрация спермальных лейкоцитов и выраженность клинических симптомов у пациентов не являются независимыми факторами риска развития бесплодия. В исследовании японских ученых было показано, что лейкоцитоспермия низкого уровня (0,2–1,0 млн/мл) может негативно влиять на мужскую фертильность. Антибактериальная терапия доксициклином в течение трех недель повышает шансы на естественное зачатие (рис. 4)18.
Докладчик подчеркнул, что нарушение мужской фертильности как следствие инфекционно-воспалительного процесса урогенитального тракта напрямую связано с окислительным стрессом, который повреждает мембрану сперматозоидов, снижает их подвижность и оплодотворяющую способность.
До недавнего времени считалось, что наличие Ureaplasma urealyticum и мужская фертильность не взаимосвязаны. Однако результаты исследований, в которых оценивали влияние Ureaplasma urealyticum на генетический материал сперматозоидов, продемонстрировали, что, несмотря на сохранение показателей фертильности спермы, инфицирование Ureaplasma urealyticum приводит к повреждению ДНК сперматозоидов с последующим негативным влиянием на эмбриогенез. Лечение пациентов, инфицированных Ureaplasma urealyticum, доксициклином позволило восстановить параметры, отражающие нормальную структуру генетического материала сперматозоидов (рис. 5)19.
Одной из причин мужского бесплодия являются аутоиммунные реакции, которые сопровождаются выработкой антиспермальных антител (АСАТ). При этом у пациентов с АСАТ наиболее выраженные нарушения качества спермы наблюдаются на фоне урогенитального хламидиоза, вызываемого Chlamydia trachomatis. Было показано, что после адекватного лечения хламидиоза количество АСАТ-позитивных сперматозоидов уменьшается.
В целом, лечение хронического простатита – это комплекс терапевтических мероприятий, проводимых с целью устранения воспаления в предстательной железе. Этиологическое лечение хронического простатита направлено на борьбу с инфекционными возбудителями воспалительного процесса в предстательной железе. Международные рекомендации наиболее эффективными средствами называют фторхинолоны, макролиды, тетрациклины, триметоприм. Эти препараты обладают широким спектром противомикробного действия и способностью накапливаться в простате в высоких концентрациях. Препаратами выбора при их неэффективности и/или обнаружении так называемой атипичной флоры могут быть липофильные тетрациклины, в частности доксициклина моногидрат и макролиды, среди которых наиболее высокой активностью в отношении атипичной флоры обладает джозамицин.
Пациентам с хроническим простатитом, ассоциированным с атипичными микроорганизмами, целесообразно проводить эмпирическое антибактериальное лечение джозамицином и доксициклина моногидратом.
При признаках нарушения дренажной функции дополнительных половых желез показаны альфа-1-адреноблокаторы сроком до 12 недель, при наличии боли – противовоспалительные средства (до шести недель). Применяются также различные физиотерапевтические методы, включая нейромодуляцию для устранения застоя и улучшения дренажа предстательной железы при простатитах невоспалительной природы. Хирургическое вмешательство показано при возникновении различных осложнений.
Подводя итоги выступления, докладчик подчеркнул необходимость дальнейших исследований, посвященных вопросам взаимосвязи внутриклеточных возбудителей хронического простатита и нарушений репродуктивной функции.
Заключение
Актуальность поиска эффективных методов терапии ИНМП обусловлена широкой распространенностью ИНМП, высокой частотой рецидивов, а также ростом резистентности уропатогенов. В этой связи, назначая антимикробный препарат пациентам с острой ИНМП, врач должен учитывать уровень чувствительности уропатогенов к антибиотикам в конкретном регионе.
Если цель лечения острого цистита – это полная эрадикация возбудителей, то терапия рецидивирующего цистита направлена на увеличение безрецидивного периода и улучшение качества жизни пациента. Стратегия ведения пациентов с рецидивирующими ИНМП предусматривает не только антибактериальную терапию, но и применение альтернативных методов. Эксперты подробно рассмотрели преимущества иммунопрофилактики препаратом Уро-Ваксом®, который представляет собой лиофилизат 18 штаммов кишечной палочки.
Применять Уро-Ваксом® можно одновременно с антибиотиками, что подтверждают результаты открытой проспективной многоцентровой наблюдательной программы FLORA. Пациенткам с рецидивирующими неосложненными ИНМП назначались антибактериальный препарат цефиксим (Супракс® Солютаб®) и Уро-Ваксом®. На фоне комбинированного лечения значительно снизились общее число и продолжительность рецидивов, а также средняя продолжительность приема антибиотиков.
В последнее время появляется все больше данных, подтверждающих вероятную роль хламидий, микоплазм и уреаплазм в развитии хронического простатита. К препаратам выбора для лечения хронического простатита, когда у пациента выявляются внутриклеточные возбудители или подозревается их наличие, относятся макролиды и тетрациклины. В рамках симпозиума были представлены результаты многоцентрового неинтервенционного исследования TAURUS, в котором оценивались эффективность и безопасность макролидов и тетрациклинов в терапии хронического простатита в рутинной клинической практике. Был сделан вывод о высокой клинической эффективности и безопасности макролидов (джозамицина) и тетрациклинов (доксициклина моногидрата) в лечении хронического простатита.
Благодаря фармакодинамическим и фармакокинетическим свойствам, высокой безопасности и хорошей переносимости джозамицин (Вильпрафен®) входит в число наиболее перспективных антибиотиков для лечения урогенитальной инфекции, вызванной хламидиями, микоплазмами и уреаплазмами, у разных категорий пациентов, включая беременных и детей.
В рамках симпозиума также обсуждался вопрос хронического простатита как одного из факторов риска мужского бесплодия. Было отмечено, что атипичная флора может не только вызывать воспаление в предстательной железе, но и влиять на фертильность. Есть данные, что антибактериальная терапия доксициклина моногидратом (Юнидокс Солютаб®) в течение трех недель повышает шансы на естественное зачатие у пациентов с лейкоцитоспермией. Доксициклина моногидрат (Юнидокс Солютаб®) – один из самых эффективных антибиотиков тетрациклинового ряда, при этом использование в качестве активного вещества доксициклина моногидрата и форма диспергируемых таблеток Солютаб® позволили минимизировать вероятность побочных эффектов, свойственных доксициклина гидрохлориду.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.