Неалкогольная жировая болезнь печени: новый взгляд на аспекты коморбидности
- Аннотация
- Статья
- Ссылки
- English
У больных сахарным диабетом (СД) 2 типа НАЖБП встречается намного чаще, чем в общей популяции. Ключевые патогенетические звенья этих нозологических форм во многом идентичны, в частности инсулинорезистентность и липотоксичность.
Ассоциация метаболической НАЖБП и СД 2 типа обоюдная. Не только СД 2 типа способствует развитию НАЖБП, но и стеатоз печени, особенно в сочетании с воспалением, влияет на прогрессирующее ухудшение функции β-клеток поджелудочной железы.
Немедикаментозные методы лечения метаболической НАЖБП, включающие гипокалорийную диету и динамические физические нагрузки, не всегда оказываются эффективными. Ипраглифлозин, представитель ингибиторов натрий-глюкозного котранспортера 2, может рассматриваться в качестве многообещающего препарата для терапии метаболической НАЖБП. Помимо уменьшения выраженности стеатоза печени и активности воспаления он способствует редукции печеночного фиброза, что подтверждается парными биопсиями.
У больных сахарным диабетом (СД) 2 типа НАЖБП встречается намного чаще, чем в общей популяции. Ключевые патогенетические звенья этих нозологических форм во многом идентичны, в частности инсулинорезистентность и липотоксичность.
Ассоциация метаболической НАЖБП и СД 2 типа обоюдная. Не только СД 2 типа способствует развитию НАЖБП, но и стеатоз печени, особенно в сочетании с воспалением, влияет на прогрессирующее ухудшение функции β-клеток поджелудочной железы.
Немедикаментозные методы лечения метаболической НАЖБП, включающие гипокалорийную диету и динамические физические нагрузки, не всегда оказываются эффективными. Ипраглифлозин, представитель ингибиторов натрий-глюкозного котранспортера 2, может рассматриваться в качестве многообещающего препарата для терапии метаболической НАЖБП. Помимо уменьшения выраженности стеатоза печени и активности воспаления он способствует редукции печеночного фиброза, что подтверждается парными биопсиями.

Неалкогольная жировая болезнь печени (НАЖБП) и сахарный диабет (СД) 2 типа – патологические состояния, ассоциированные друг с другом. В настоящее время их распространенность достигает размеров эпидемии. Являясь компонентами метаболического синдрома, оба заболевания имеют схожие механизмы развития и в равной мере повышают риск неблагоприятных исходов.
На сегодняшний день с учетом накопленных знаний НАЖБП рассматривается как наднозологическая группа, характеризующаяся гистологическими изменениями печени, аналогичными изменениям при алкогольной болезни печени, в отсутствие прямых либо косвенных указаний на употребление алкоголя в гепатотоксических дозах [1–3].
НАЖБП классифицируется по этиопатогенетическим факторам и по стадиям. По этиологии выделяют метаболическую, генетически детерминированную и вторичную НАЖБП, по стадиям – стеатоз, неалкогольный стеатогепатит (НАСГ) без фиброза и с фиброзом и цирроз печени. Целесообразно выделение метаболически-ассоциированной жировой болезни печени (метаболической НАЖБП, МАЖБП) в качестве отдельной нозологической формы [4–6].
Далее преимущественно будет представлена характеристика МАЖБП как наиболее часто встречающейся и клинически значимой формы НАЖБП.
НАЖБП – широко распространенное заболевание. В большинстве экономически развитых стран она диагностируется чаще, чем алкогольная болезнь печени и хронические вирусные гепатиты. В общей популяции распространенность НАЖБП достигает 23–40%, НАСГ – 3–10%. У пациентов с ожирением и СД 2 типа НАЖБП наблюдается в 50–100% случаев [7–9]. Наиболее характерна связь НАЖБП с ожирением – 39–100% случаев, причем вероятность развития стеатоза возрастает по мере увеличения индекса массы тела (критерий МАЖБП). Признаки стеатоза по результатам инструментальных методов исследования обнаруживаются более чем у 75% больных с ожирением, около половины из них имеют гистологические изменения, представленные воспалением или фиброзом. Сахарный диабет 2 типа и предиабет выявляются в 34–75% случаев, дислипидемия – в 20–80%. У 10–30% больных НАЖБП масса тела, уровень глюкозы и липидов в крови в пределах нормы, однако у них выше риск развития метаболического синдрома, чем в популяции [2, 10, 11]. Плейоморфность НАЖБП проявляется многообразием сопутствующих патологических состояний, которые объединены общими патофизиологическими механизмами – инсулинорезистентностью и избыточным накоплением липидов в печени [12–15].
В основе патогенеза НАЖБП лежит накопление избыточного количества триглицеридов и других производных холестерина в гепатоцитах, что является следствием нарушения баланса синтеза и утилизации этих органических молекул. Потенциальные патофизиологические механизмы липотоксичности при НАЖБП включают [16, 17]:
- повреждение митохондрий продуктами β-пероксисомного окисления свободных жирных кислот (СЖК);
- повышение синтеза эндогенных СЖК;
- снижение интенсивности утилизации СЖК в печени;
- нарушение высвобождения триглицеридов из клеток печени в форме липопротеинов очень низкой плотности.
Единого механизма развития НАЖБП не существует. Ее патогенез сложный и многофакториальный. В качестве ключевых звеньев рассматриваются инсулинорезистентность и изменение профиля гормонов – регуляторов жирового обмена: лептина, адипонектина, грелина и др. Доказана также роль кишечной микрофлоры, которая опосредованно за счет проникновения липополисахаридов (ЛПС) грамотрицательных бактерий в портальный кровоток активирует через Толл-подобный рецептор 4 иннатный иммунный ответ, что приводит к развитию воспаления и активации продукции фиброзного матрикса. В последние годы активно изучается проблема наследственной предрасположенности к формированию НАСГ у пациентов с НАЖБП, а также к ускоренным темпам прогрессирования фиброза печени. В частности, показано значение полиморфизма генов адипонутрина (PNPLA3), рецепторов пероксисомального пролифератора (PPAR), а также белков, участвующих в обмене липидов, инсулина, в реакциях окислительного стресса (например, циклооксигеназы 2) [9, 10, 17, 18].
Периферическая инсулинорезистентность сопровождается развитием гипергликемии и/или гиперинсулинемии. Гиперинсулинемия и часто наблюдаемая при ожирении активация симпатоадреналовой системы усиливают липолиз в жировой ткани с высвобождением повышенного количества СЖК, в то время как в печени снижается скорость их окисления. Повышенный приток СЖК к печени и замедленное их окисление приводят к избыточному накоплению триглицеридов в гепатоцитах и секреции большего количества липопротеинов очень низкой плотности. В условиях повышенного притока СЖК к печени возрастает роль β-пероксисомного и Ω-микросомального окисления, что сопровождается накоплением активных радикалов кислорода. Роль митохондриального окисления снижается, что способствует дефициту аденозинтрифосфата (АТФ) в клетке. На фоне имеющегося стеатоза это создает предпосылки к перекисному окислению липидов, накоплению высокотоксичного малонового диальдегида и развитию окислительного стресса. Дефицит АТФ, перекисное окисление, выработка Fas-лиганда, гиперпродукция фактора некроза опухоли α в печени и жировой ткани, высокая активность трансформирующего фактора роста β1 (TGF-β1) и интерлейкина 8 сопровождаются гибелью гепатоцитов по механизму апоптоза или некроза, нейтрофильной воспалительной инфильтрацией и ускоренным фиброгенезом [17, 19, 20].
Активация звездчатых клеток печени происходит под воздействием интерлейкинов 12 и 21, TGF-β1, хемокинов (моноцитарного хемоаттрактантного протеина, макрофагального воспалительного протеина 1), сосудистого эндотелиального фактора роста, тромбоцитарного фактора роста, рецепторов, активирующих пролиферацию пероксисом, белков острой фазы, каспаз, а также компонентов ренин-ангиотензин-альдостероновой системы, в частности ангиотензина II. Активированные звездчатые клетки трансформируются в миофибробласты, и запускается процесс печеночного фиброгенеза. Более того, перечисленные процессы играют важную роль в патогенезе сердечно-сосудистой патологии, риск развития и прогрессирования которой достоверно повышается у больных НАСГ, прямо коррелируя со стадией фиброза печени [21–23].
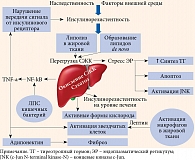
К середине 2010-х гг. стало понятно, что ассоциация метаболической НАЖБП и СД 2 типа обоюдная. Так, СД 2 типа способствует развитию НАЖБП, а стеатоз печени, особенно в сочетании с воспалением, может предшествовать развитию СД 2 типа, а также тесно связан с прогрессирующим ухудшением функции β-клеток поджелудочной железы [24, 25]. Высказано также предположение, что дисфункция β-клеток может рассматриваться в качестве нового предиктора НАЖБП [26]. Основные патогенетические звенья метаболической НАЖБП, во многом совпадающие с таковыми СД 2 типа, представлены на рис. 1.
Заболевание, как правило, развивается в возрасте 40–60 лет. Однако оно может диагностироваться и у молодых пациентов без явных факторов риска. У мужчин НАЖБП наблюдается чаще, при этом распределение заболеваемости в разных возрастных категориях приблизительно одинаковое. У женщин она нарастает с возрастом. У детей вне зависимости от пола встречаемость НАЖБП прогрессивно увеличивается с возрастом – 0,7% в 2–4 года и 17,3% в 15–19 лет, что во многом обусловлено избыточным потреблением легкоусваиваемой фруктозы и насыщенных жиров [8, 27, 28].
У большинства больных НАЖБП симптоматика отсутствует. Некоторые отмечают абдоминальный дискомфорт, тупую боль в правом верхнем квадранте живота, а также повышенную утомляемость. Последнюю жалобу пациенты предъявляют редко, однако при целенаправленном обследовании астенические проявления обнаруживаются у 30–50%. Обычно больные обращаются к врачам по другим поводам, таким как артериальная гипертензия, желчнокаменная болезнь, ишемическая болезнь сердца, застойная сердечная недостаточность, гипотиреоз, подагра, гинекологические заболевания. Патология печени обнаруживается у них случайно. Во многих случаях изменения ультразвуковой картины печени и/или биохимических параметров впервые выявляются при обращении по поводу СД 2 типа [7]. Чаще всего отмечается увеличение печени. Физикально определяемая спленомегалия обычно указывает на сформированный цирроз печени [1, 6, 7].
Установление диагноза НАЖБП требует сбора алкогольного анамнеза, однако следует учитывать возможность надежной (> 90%) диагностики алкогольной болезни печени на основании совокупности лабораторных признаков [29]. Не меньшее значение отводится оценке факторов риска первичной и вторичной НАЖБП. Необходимо также принимать во внимание возможность наличия у одного пациента нескольких этиопатогенетических факторов (метаболические плюс этанол, лекарства, гепатотропные вирусы), совокупность которых диктует проведение диагностики стеатогепатита смешанной этиологии. У пациентов с СД 2 типа и избыточной массой тела отклонение печеночных биохимических показателей в сочетании с ультразвуковыми признаками стеатоза печени с очень высокой степенью вероятности позволяет предположить МАЖБП.
Лабораторные признаки цитолиза выявляются у большинства больных НАСГ. Как правило, уровень сывороточных трансаминаз повышен незначительно – не более четырех норм, хотя наблюдаются и более высокие показатели. Соотношение активности аланинаминотрансферазы/аспартатаминотрансферазы (АЛТ/АСТ) < 1 (допускается < 1,3), значимое преобладание активности АСТ при исключении алкогольного фактора чаще всего указывают на выраженный фиброз ткани печени. Повышение уровня γ-глутамилтранспептидазы (ГГТП) до трех, реже до шести норм может быть изолированным. Возможно незначительное повышение уровней билирубина, щелочной фосфатазы, γ-глобулинов, антинуклеарных антител. Признаки снижения белково-синтетической функции печени развиваются лишь при формировании цирроза. У 90–98% пациентов с НАЖБП по данным различных тестов выявляется инсулинорезистентность [12, 13, 30].
С клинической позиции среди гистологических компонентов НАЖБП наиболее важным представляется фиброз, поэтому разработано несколько сывороточных диагностических панелей для определения активности фиброгенеза: FibroMax, FIB-4, шкала фиброза НАЖБП (Non-Alcoholic Fatty Liver Disease Fibrosis Score, NAFLD fibrosis score) и др. Несмотря на простой набор исследуемых параметров, FIB-4 и NAFLD fibrosis score в контролируемых исследованиях продемонстрировали высокую точность в подтверждении либо исключении септального фиброза/цирроза печени [31, 32].
Ультразвуковое исследование и компьютерная томография позволяют верифицировать гепатомегалии, косвенно оценить наличие стеатоза печени, выявить признаки формирования портальной гипертензии. Ультразвуковое исследование обладает высокой (> 80%) чувствительностью и почти абсолютной специфичностью в отношении диагностики стеатоза печени, однако не позволяет дифференцировать стеатоз и стеатогепатит, а также установить стадию фиброза. Эзофагогастродуоденоскопия позволяет обнаружить варикозное расширение вен пищевода при трансформации НАСГ в цирроз, реже – как проявление внепеченочной портальной гипертензии [33].
Инструментальные неинвазивные методы определения степени фиброза представлены ультразвуковой и магнитно-резонансной фиброэластографией. Следует отметить, что у пациентов с НАЖБП без ожирения их точность может быть выше, поскольку при индексе массы тела более 30 кг/м2 в 20% случаев ультразвуковая фиброэластография не позволяет получить валидный результат. С целью повышения точности инструментальных методов предложены методики контролированного параметра затухания (САР) и магнитно-резонансного определения протонной плотности фракции жира [34].
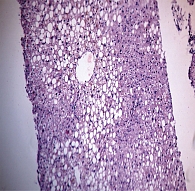
Гистологическая картина НАЖБП характеризуется наличием крупнокапельной жировой дистрофии гепатоцитов преимущественно в третьей зоне ацинуса, а также баллонной дистрофии. Воспалительная реакция при НАСГ преимущественно представлена внутридольковыми инфильтратами, состоящими из полиморфноядерных лейкоцитов, лимфоцитов и мононуклеарных фагоцитов (рис. 2). Тельца Маллори обнаруживаются не во всех случаях и в меньшем количестве, чем при алкогольном гепатите. Перисинусоидальный и перицеллюлярный фиброз на ранней стадии выявляется в третьей зоне ацинуса и может прогрессировать с формированием септ и цирроза. Менее значимые для диагностики морфологические особенности НАСГ включают жировые кисты, оптически пустые ядра гепатоцитов, липогранулемы, мегамитохондрии в гепатоцитах, небольшое отложение железа в первой зоне ацинуса [1, 33].
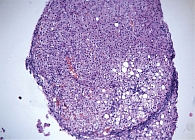
Цирротическая трансформация сопровождается значительным уменьшением содержания жира в гепатоцитах при сохранении баллонной дистрофии (рис. 3). Кроме того, возможно изменение соотношения «лобулярное/портальное воспаление», что затрудняет диагностику.
В ряде исследований показано, что пациенты с СД 2 типа и НАЖБП подвержены более высокому риску развития НАСГ и цирроза печени. Данные перекрестных исследований и продольных ретроспективных исследований с повторными биопсиями печени четко указывают на то, что СД 2 типа в значительной степени предопределяет тяжесть и прогрессирование фиброза у пациентов с НАЖБП, так же как плохой контроль гликемии связан с повышенным риском фиброза при НАСГ. В нескольких исследованиях сообщалось, что СД 2 типа является установленным фактором риска развития цирроза и гепатоцеллюлярной карциномы.
К факторам риска прогрессирования НАЖБП относятся:
- возраст старше 45 лет;
- ожирение (индекс массы тела более 30 кг/м2);
- сахарный диабет 2 типа;
- артериальная гипертензия;
- гипертриглицеридемия;
- АСТ/АЛТ более 1,3;
- гиперферритинемия;
- инфекция, вызванная вирусом гепатита С;
- холецистэктомия в анамнезе.
Чем больше факторов, тем выше вероятность прогрессирования воспалительных и фибротических изменений печени [1, 2, 17, 35]. Важно отметить, что наличие СД 2 типа более чем в два раза повышает вероятность развития тяжелых форм НАСГ [35].
Согласно современным рекомендациям, для предупреждения развития неблагоприятных исходов, в том числе со стороны сердечно-сосудистой системы, необходимо своевременное выявление и лечение НАЖБП с использованием препаратов с доказанным профилем безопасности, в том числе в отношении печени, а также с благоприятными эффектами как на печень, так и на факторы риска и патогенез сердечно-сосудистых осложнений [36].
С учетом прогностического эффекта как на печеночные, так и непеченочные неблагоприятные исходы фиброза и цирроза печени основной целью терапии НАЖБП является предупреждение развития и прогрессирования фиброза, а также уменьшение выраженности стеатоза печени.
Немедикаментозные методы лечения МАЖБП включают постепенное снижение массы тела, достигаемое гипокалорийной диетой и умеренными физическими нагрузками продолжительностью 30–60 минут в день. Уменьшение массы тела на 0,5–1,0 кг в неделю и нормализация углеводного обмена сопровождаются положительной динамикой клинико-лабораторных показателей и снижением индекса гистологической активности, а также степени фиброза печени [1, 37]. Вместе с тем эффективность диет ограничена, что во многом обусловлено трудностью постоянного их соблюдения [38]. У пациентов с морбидным ожирением рассматривается возможность выполнения бариатрических операций, хотя их отдаленные последствия требуют изучения [9, 37].
С учетом многокомпонентности патогенеза при лечении НАЖБП необходимо использовать междисциплинарный подход и препараты, действие которых потенциально может быть направлено на коррекцию множественных метаболических нарушений, характерных для НАЖБП, – уменьшение инсулинорезистентности, коррекцию атерогенной дислипидемии, уменьшение жира и восстановление морфологии и функции печени. При этом лишь в нескольких рандомизированных контролируемых исследованиях при оценке основных эффектов лечения использовали суррогатную конечную точку, включающую уменьшение/разрешение морфологических признаков, определяющих НАСГ (воспаление и/или фиброз).
Учитывая накопленные доказательства ведущей роли инсулинорезистентности в патогенезе НАЖБП, логичным представляется применение лекарственных средств, повышающих чувствительность клеток к инсулину, таких как метформин и тиазолидиндионы. Однако в рандомизированных клинических исследованиях не было продемонстрировано значимого влияния метформина на прогрессирование воспаления и фиброза. Вместе с тем целесообразность его назначения может определяться снижением массы тела за счет обозначенных выше механизмов, лечением и профилактикой СД 2 типа, канцеропревентивным эффектом в отношении гепатоцеллюлярного рака и других опухолей [39]. Применение пиоглитазона обусловливает достоверное снижение уровня трансаминаз, степени стеатоза и лобулярного воспаления без значимого влияния на фиброз. Витамин Е в дозе 800 мг/сут также оказывает положительное влияние на цитолиз, стеатоз и воспаление, несколько менее значимое по сравнению с пиоглитазоном [40].
Агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1) за счет ингибирующего действия на транзит нутриентов в пищеварительном тракте и ускорения наступления чувства насыщения продемонстрировали эффективность у пациентов с НАЖБП в отношении редукции веса, содержания жира в печени и активности трансаминаз, а также печеночной плотности [30, 41, 42].
В последние годы возрастает интерес ученых и практикующих врачей к ингибиторам натрий-глюкозного котранспортера 2 (иНГЛТ-2). Помимо влияния на углеводный обмен, сердечно-сосудистую систему и почки накоплены данные об их возможности способствовать регрессу МАЖБП [43–47].
В метаанализе результатов 12 рандомизированных клинических исследований, включивших в общей сложности 850 получавших иНГЛТ-2 пациентов с НАЖБП, продемонстрировано достоверное снижение активности АЛТ, ГГТП и содержания жира в печени по данным магнитно-резонансной томографии [46].
С учетом ряда класс-специфических эффектов иНГЛТ-2 имеются основания обратить особое внимание на ипраглифлозин. Так, в исследовании T. Ohki и соавт. у 130 больных СД 2 типа и НАЖБП на фоне терапии ипраглифлозином отмечены значимое снижение массы тела, улучшение липидного профиля, уменьшение активности АЛТ, АСТ и ГГТП, а также значения индекса FIB-4 [45].
В многоцентровом рандомизированном клиническом исследовании в параллельных группах длительностью 72 недели H. Takahashi и соавт. оценили влияние ипраглифлозина на массу тела, гликемию и динамику состояния печени у пациентов с СД 2 типа и НАЖБП. В основную группу были включены 72 пациента, получавших ипраглифлозин, в контрольную – 28, соблюдавших рекомендации по диете и режим физической активности, а также принимавших сахароснижающие препараты, за исключением иНГЛТ-2, арГПП-1 и пиоглитазона. В группе ипраглифлозина констатировано достоверное снижение уровней глюкозы плазмы натощак и гликированного гемоглобина, индекса массы тела, подкожного и висцерального жира. У пациентов основной группы значимо снизились сывороточная активность АЛТ, АСТ и ГГТП, а также уровень неинвазивного маркера фиброгенеза – гликозилированного изомера Mac-2-связывающего белка. С гепатологической точки зрения наиболее значимым результатом применения ипраглифлозина стало уменьшение фиброза печени в 57,1% случаев и баллонной дистрофии гепатоцитов в 52,4% случаев (по данным парных биопсий печени), а также уменьшение количества пациентов с признаками НАСГ и предупреждение новых случаев развития НАСГ (рис. 4) [47].
К другим препаратам, проходящим заключительные фазы клинических испытаний при МАЖБП, относятся субстанции с противовоспалительными, антифибротическими и инсулин-сенситизирующими свойствами, в частности агонисты фарнезоидного Х-рецептора, двойные агонисты рецепторов, активируемых пролифератором пероксисом, двойные антагонисты хемокиновых рецепторов CCR2/CCR5, конъюгаты жирных кислот/желчных кислот.
Таким образом, за последние годы спектр лекарственных средств для лечения МАЖБП и СД 2 типа не только расширился, но и пополнился принципиально новым классом препаратов – иНГЛТ-2, которые достоверно улучшают системный жизненный прогноз пациентов. Вероятно, ряд эффектов иНГЛТ-2 относятся к класс-специфическим. С точки зрения гепатолога наиболее интересным представляется влияние ипраглифлозина на регресс фиброза печени, доказанное парными биопсиями печени. Безусловно, эти многообещающие данные требуют подтверждения в многоцентровых рандомизированных клинических исследованиях. Однако накопленный к настоящему времени материал уже позволяет рекомендовать применение ипраглифлозина в гепатологической практике.
A.O. Buyeverov, MD, PhD, Prof., K.M. Roshchina, P.O. Bogomolov, PhD
I.M. Sechenov First Moscow State Medical University
Moscow Regional Research and Clinical Institute
Contact person: Aleksey O. Buyeverov, bcl72@yandex.ru
In the last ten years, non-alcoholic fatty liver disease (NAFLD) has been the subject of close attention of doctors of various specialties. NAFLD is recognized as the main component of the metabolic syndrome and an independent risk factor for the development of cardiovascular complications.
In patients with type 2 diabetes mellitus (DM), NAFLD is much more common than in the general population. The key pathogenetic links of these nosological forms are largely identical, in particular insulin resistance and lipotoxicity.
The association of metabolic NAFLD and type 2 diabetes is mutual. Not only type 2 diabetes contributes to the development of NAFLD, but also liver steatosis, especially in combination with inflammation, affects the progressive deterioration of the function of beta cells of the pancreas.
Non-drug methods of treatment of metabolic NAFLD, including a hypocaloric diet and dynamic physical activity, are not always effective. Ipragliflozin, a representative of the class of sodium-glucose cotransporter 2 inhibitors, can be considered as a promising drug for the treatment of metabolic NAFLD. In addition to reducing the severity of liver steatosis and the activity of inflammation, it contributes to the reduction of hepatic fibrosis, which is confirmed by paired biopsies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.