Неалкогольная жировая болезнь печени: современный взгляд на проблему
- Аннотация
- Статья
- Ссылки
- English
Приведены основные изменения терапевтических стратегий в рекомендациях европейских, американских ассоциаций по ведению пациентов с неалкогольной жировой болезнью печени. На основе доказательной базы рассмотрены подходы к терапии, роль немедикаментозных методов как терапии первой ступени, эффективность патогенетического лечения.
Приведены основные изменения терапевтических стратегий в рекомендациях европейских, американских ассоциаций по ведению пациентов с неалкогольной жировой болезнью печени. На основе доказательной базы рассмотрены подходы к терапии, роль немедикаментозных методов как терапии первой ступени, эффективность патогенетического лечения.
Неалкогольная жировая болезнь печени (НАЖБП) – самая частая причина хронических заболеваний печени в Европе [1]. НАЖБП ассоциирована с метаболическими расстройствами у лиц, не злоупотребляющих алкоголем, протекает от печеночного стеатоза до стеатогепатита и цирроза печени. Кроме того, НАЖБП – одна из причин развития гепатоцеллюлярного рака [2–4].
Неалкогольный стеатогепатит (НАСГ) – самостоятельная нозологическая единица, для которой характерны повышение активности печеночных ферментов в крови, морфологические изменения в биоптате печени, подобные изменениям при алкогольном гепатите, – жировая дистрофия и воспалительная реакция.
Последнее время появляется все больше доказательств, что НАЖБП – мультисистемное заболевание, повышающее риск сахарного диабета 2-го типа, сердечно-сосудистой патологии, хронической болезни почек, остеопороза и гипогонадизма [1]. Смертность при НАЖБП в пять раз выше, чем в популяции [3]. При стеатозе риск смерти от сердечно-сосудистых заболеваний составляет 8,6%, при НАСГ – 12,6–36% [5].
Историческая справка
В 1884 г. немецкий клиницист и патолог F.T. von Frerichs впервые описал поражение печени при сахарном диабете как диабетический жировой гепатоз. В 1949 г. появились работы А.Л. Мясникова о гепатодистрофии при сахарном диабете. В 1957 г. H. Thaler исследовал патологию печени при сахарном диабете, которую охарактеризовал как стеатоз с воспалительной реакцией. В 1952 г. S. Zelman описал изменения печени у пациентов с ожирением [6], а в 1958 г. J. Westwater и D. Fainer подтвердили, что у многих пациентов с ожирением выявляются отклонения печеночных тестов и морфологические изменения, уменьшающиеся после снижения веса [7]. В 1960–1970 гг. С.Д. Подымова выделила группу больных, у которых в биоптатах печени был выявлен стеатоз с мезенхимальной воспалительной реакцией, впоследствии ретроспективно оценeнный как стеатогепатит. И наконец, в 1980 г. J. Ludwig впервые предложил термин неалкогольного стеатогепатита, описал НАСГ как самостоятельное заболевание и обозначил его основные диагностические критерии: признаки жировой дистрофии печени с лобулярным гепатитом и отсутствие алкоголизма в анамнезе [8].
Эпидемиология
На долю НАЖБП в популяции приходится около 20–40%, на долю НАСГ – 5–8%, при этом у 15–20% пациентов отмечается цирротическая стадия [9–11]. Распространенность заболевания в США составляет 30% [12].
Согласно результатам первого эпидемиологического исследования в России DIREG L 01903 (n = 31 754), 26,1% пациентов, посещающих терапевта, имеют НАЖБП, а в районах Сибири встречаемость НАЖБП достигает 31,6% [13, 14]. Стеатоз печени выявлен у 80,3% пациентов, НАСГ – у 16,8%, цирроз – у 2,9%. При этом только у 1% больных в амбулаторной карте указан соответствующий диагноз [13]. В настоящее время продолжается исследование DIREG-2, в котором планируется обследовать 50 000 пациентов.
НАЖБП – медленно прогрессирующее заболевание, и у большинства пациентов цирроз не развивается. Однако у четверти пациентов со стеатозом печени возникает фиброз печени [15]. В исследованиях показано, что в 10% случаев стеатоз печени прогрессирует в НАСГ в течение десяти лет. В 5–25% случаев НАСГ трансформируется в цирроз. Развитие гепатоцеллюлярной карциномы (ГЦК) наблюдается приблизительно у 10% пациентов с цирротической стадией НАСГ в течение десяти лет [16]. Обратите внимание: 60–80% всех криптогенных циррозов являются исходами НАЖБП [17], и в 10% случаев направление на трансплантацию печени обусловлено цирротической стадией НАСГ.
Этиология
Ведущими этиологическими факторами НАЖБП являются метаболический синдром и его компоненты. НАЖБП – это результат сочетания в различных комбинациях метаболических риск-факторов: абдоминального ожирения, повышения уровня триглицеридов, снижения уровня липопротеинов высокой плотности (ЛПВП), повышения содержания мочевой кислоты, нарушения толерантности к глюкозе, развития сахарного диабета 2-го типа, артериальной гипертензии и самое главное – инсулинорезистентности [18, 19]. НАЖБП у пациентов с ожирением встречается в 40–90% случаев, при индексе массы тела (ИМТ) более 30 кг/м2 – более чем в 90% [20, 21], при сахарном диабете 2-го типа – более чем в 70% случаев [22].
Как показали результаты эпидемиологического исследования в России, у пациентов с НАЖБП частыми факторами риска являются артериальная гипертензия (69,9%), гиперхолестеринемия (68,8%), абдоминальное ожирение (56,2%) [13]. Частота случаев заболеваний печени возрастает с увеличением количества факторов риска метаболического синдрома. Важную роль в развитии и прогрессировании НАЖБП играет такой генетический фактор, как полиморфизм генов, отвечающих за развитие стеатоза, окисление жирных кислот, окислительный стресс, экспрессию фактора некроза опухоли (ФНО) альфа [23].
Патогенез
В настоящее время общепринятой считается теория двух толчков. Согласно данной теории стеатоз (первичный толчок) развивается в результате последовательных процессов: инсулинорезистентности, стимуляции липолиза и повышения транспорта свободных жирных кислот в печень, увеличения синтеза и угнетения их окисления в митохондриях с накоплением триглицеридов и снижением экскреции жиров гепатоцитами. Окислительный стресс (второй толчок) реализуется вследствие образования продуктов перекисного окисления липидов (ПОЛ) (свободные жирные кислоты служат субстратом для ПОЛ) и реактивных форм кислорода, цитокинов (ФНО-альфа, интерлейкин 6 и др.) [2, 4, 24, 25]. ПОЛ сопровождается набуханием митохондрий, нарушением их функции, истощением митохондриального аденозинтрифосфата, нарушением целостности клеточных мембран, повреждением гепатоцитов, стимуляцией звездчатых клеток, коллагенообразованием. При ожирении нарушается секреция адипоцитокинов – повышается уровень лептина, снижается протективный фактор адипонектин, что приводит к стеатозу, воспалению и фиброзу [26].
Патогенез НАЖБП представлен множеством сложных механизмов (multi-hits), которые запускают процессы воспаления и гибели гепатоцитов (некроз, апоптоз), формирования НАСГ, активации звездчатых клеток, фиброгенеза, фиброза, трансформации в цирроз [24].
Как уже отмечалось, огромную роль в формировании и прогрессировании НАЖБП играют генетические факторы, полиморфизм генов. Выявлена ассоциация полиморфизма I148M (Panatin-Like Phospholipase) с НАЖБП [27]. Это риск-фактор для стеатоза и цирроза, особенно при инсулинорезистентности, ожирении. Варианты полиморфизма PNPLA3 I148M и NCAN rs 2228603 ассоциированы с увеличенным риском ГЦК [28].
Важным звеном патогенеза НАЖБП является дисфункция эндотелия, нарушение микроциркуляции [29].
Клиническая картина
НАЖБП обычно формируется у пациентов в возрасте старше 45 лет. Согласно данным эпидемиологического исследования DIREG L 01903, НАЖБП чаще встречается в возрастной группе 50–59 лет [13]. Яркая клиническая картина для этого заболевания не характерна. Возможно наличие астенического синдрома, дискомфорта в правом подреберье, гепатомегалии примерно у 50–75% пациентов. На поздних стадиях НАСГ появляются клинические симптомы цирротического процесса с синдромом портальной гипертензии и печеночно-клеточной недостаточности.
Диагностика
Специфических жалоб нет. При наличии риск-факторов и проявлений метаболического синдрома следует подумать о диагнозе. Для диагностики НАСГ необходимо исключить злоупотребление алкоголем в анамнезе (анамнез, опросники CAGE, AUDIT), хронический вирусный гепатит, аутоиммунные болезни печени, лекарственный гепатит, более редкие заболевания печени – болезнь Вильсона, гемохроматоз, дефицит альфа-1-антитрипсина, а также другие причины стеатоза печени.
Диагноз НАСГ – диагноз исключения [30], но при этом важно учитывать, что в последние годы в клинической практике часто имеет место коморбидная патология печени – гепатиты смешанной этиологии, например НАСГ и вирусный гепатит, НАСГ и алкогольный гепатит, НАСГ и вирусно-алкогольный гепатит. Поэтому в любом случае целесообразно проводить полный скрининг заболеваний печени. Биохимические изменения носят неспецифический характер. Умеренный цитолиз регистрируется у части больных, соотношение аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ), как правило, менее 1. Билирубин в норме или умеренно повышен, не исключено умеренное повышение щелочной фосфатазы и гамма-глутамилтранспептидазы (ГГТП). Нередко одновременно определяются дислипопротеинемия и нарушения углеводного обмена.
Рядом специалистов используются различные индексы для определения риска НАСГ. Например, индекс HAIR (Нypertension, ALT > 40 U/L, Insulin Resistance) характеризуется 80%-ной чувствительностью и 89%-ной специфичностью для НАСГ [31]. Индекс ВААТ (BMI (> 28), Age (> 50 лет), ALT (> 2 норм), Triglycerides (повышение)) менее 1 означает 100%-ное отсутствие НАСГ [24, 32].
J.-H. Lee предложил использовать NAFDL-индекс, рассчитываемый следующим образом: 8 × АЛТ/АСТ + ИМТ. Если индекс менее 31, диагноз НАЖБП маловероятен, если более 36 – вероятность диагноза превышает 90%. Специфичность указанного индекса – 91,2% [33].
Инструментальная диагностика НАЖБП включает ультразвуковое исследование (УЗИ) брюшной полости на наличие гиперэхогенности печени и гепатомегалии, компьютерную и магнитно-резонансную томографию (МРТ) [34]. Чувствительность УЗИ и МРТ для диагностики НАЖБП – 45 и 90,9%, специфичность – 90 и 94% соответственно [35].
Неинвазивные методы оценки стеатоза печени, активности воспалительных изменений и фиброза печени также нашли практическое применение (фиброскан, фибромакс) [36]. Однако при стеатозе и ожирении, особенно при активности НАСГ, точность оценки фиброза печени с помощью эластографии значительно снижается.
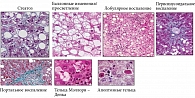
Биопсия печени остается золотым стандартом диагностики НАЖБП. Гистологическая картина печени при этом заболевании характеризуется крупнокапельной жировой дистрофией в 3-й зоне, центролобулярно. Позднее появляются признаки гепатита, фиброза, нередко – цирроза печени (рис. 1). При алкогольном и неалкогольном гепатите морфологическая картина идентична. Фиброз печени при НАЖБП прогрессирует по типу сentral-to-portal. Оценка гистологической активности и фиброза проводится согласно алгоритму, предложенному E. Brunt [37, 38].
В соответствии с алгоритмом FLIP и шкалой SAF для фиброза печени при НАЖБП предусмотрены следующие стадии: 0 – фиброз отсутствует, 1а – минимальный в 3-й зоне, перисинусоидальный, 1b – умеренный в 3-й зоне, перисинусоидальный, 1c – портальный-перипортальный, 2 – перисинусоидальный в 3-й зоне и портально-перипортальный, 3 – мостовидный, 4 – цирроз печени [39].
Тем не менее с учетом вариабельности результатов в пределах одной биопсии, инвазивности метода и риска осложнений при проведении биопсии печени, наличия неинвазивных методов диагностики вопрос о необходимости гистологического исследования решается индивидуально.
Лечение
Если в лечении хронических вирусных гепатитов прогресс достигнут, то в лечении НАЖБП – нет. Много лет НАЖБП не воспринималась как болезнь, вызывающая опасения. Казалось, это просто доброкачественные проявления ожирения и сахарного диабета. Кроме того, существовал миф о том, что фармакотерапия – основная составляющая при этом заболевании, и пациенты ждали назначения волшебной таблетки. Одна из трудностей лечения НАЖБП заключается в том, что многие пациенты не достигают цели в самом эффективном немедикаментозном лечении [40].
Стандартного метода лечения НАЖБП, основанного на доказательной базе, не существует [41]. Сегодня применяются различные рекомендации по ведению и лечению НАЖБП: EASL (European Association for the Study of the Liver – Европейская ассоциация по изучению болезней печени) (2009), APASL (Asian Pacific Associaton for the Study of the Liver – Азиатско-Тихоокеанская ассоциация по изучению печени) (2011) [42], AASLD (American Association for the Study of Liver Diseases – Американская ассоциация по изучению болезней печени), ACG (American College of Gastroenterology – Американская коллегия гастроэнтерологов) и AGA (American Gastroenterological Association – Американская ассоциация гастроэнтерологов) (2012) [43], WGO (World Gastroenterology Organisation – Всемирная гастроэнтерологическая организация) (2012) [5]. Российские медицинские стандарты в ближайшее время будут утверждены и опубликованы.
Заметим, что многие специалисты заблуждаются, думая, что самое главное в лечении НАЖБП – фармакотерапия без диеты и физических нагрузок. В настоящее время установлено с высоким уровнем доказательности, что ведение пациентов необходимо начинать с рекомендаций по режиму питания и физической активности, особенно на фоне ожирения и сахарного диабета. Гипокалорийная диета, режим питания, регулярные физические нагрузки (уровень доказательности 1В) приводят к целевому снижению веса для всех пациентов (1А), что уменьшает стеатоз печени [43].
Многочисленные клинические исследования доказывают, что физические нагрузки увеличивают чувствительность рецепторов к инсулину, а физические упражнения не менее 30–40 минут в день в сочетании с диетой способствуют достоверно значимому улучшению биохимических и гистологических параметров [21, 44–46]. Причем необходимый эффект достигается независимо от вида физических упражнений [47].
Немедикаментозные методы лечения НАЖБП должны включать гипокалорийную диету с достаточным количеством овощей, фруктов, богатую пищевыми волокнами, продуктами с низким гликемическим индексом. Средиземноморская диета с включением мононенасыщенных жирных кислот уменьшает стеатоз печени и инсулинорезистентность [48].
Постепенное снижение веса сопровождается положительной динамикой клинико-лабораторных показателей, уменьшением инсулинорезистентности, индекса гистологической активности и степени стеатоза [19, 30, 31, 49]. Потеря 3–5% массы тела способствует уменьшению стеатоза печени. Снижение веса на 10% в течение 6–12 месяцев позволяет уменьшить некровоспалительный процесс. Более быстрая и значительная потеря веса с применением низкокалорийной диеты или голодания приводит к прогрессированию заболевания и даже развитию печеночной недостаточности [43].
В европейских клиниках пациентам со стеатозом печени или НАСГ с минимальной активностью первоначально рекомендуют только немедикаментозные методы лечения. Вопрос о назначении медикаментозной терапии решается во время последующих визитов по достижении целевого веса.
Американские рекомендации по ведению пациентов с НАСГ в качестве первой ступени терапии также предусматривают только немедикаментозные мероприятия, направленные на изменение образа жизни, – диету, увеличение физической активности, снижение веса.
Если диета и физические упражнения не дают результата, можно рассмотреть вопрос о назначении препаратов для снижения веса. Орлистат, ингибитор панкреатической липазы, способствует уменьшению уровня холестерина и массы тела. Эффективность препарата подтверждена результатами плацебоконтролируемого слепого рандомизированного исследования. У пациентов с НАСГ, применявших орлистат в течение шести месяцев, наблюдалось уменьшение цитолиза, стеатоза и фиброза печени [49]. Возможна также бариатрическая хирургия.
Поскольку инсулинорезистентность – главное патогенетическое звено в развитии НАЖБП [20, 50], ее преодоление является основой патогенетического лечения данного заболевания [30]. С этой целью используют инсулиносенситайзеры: бигуаниды (метформин) и тиазолидиндионы (пиоглитазон, розиглитазон).
Как показали результаты клинических исследований эффективности метформина при НАСГ, использование препарата в дозе 1,5–2 г/кг/сут в течение 6–12 месяцев способствовало снижению инсулинорезистентности, аппетита, гликемии, синтеза липидов в печени, усилению окисления жирных кислот, уменьшению уровня триглицеридов, ФНО, улучшению биохимической и гистологической картины (снижение стеатоза и фиброза) [51, 52]. Применение метформина в дозе 1,5 г/кг/сут в течение четырех месяцев приводило к уменьшению инсулинорезистентности и цитолитического синдрома [53]. Повторная пункционная биопсия у пациентов, получавших метформин в дозе 2 г/сут в течение года в рамках рандомизированного исследования, продемонстрировала значительное уменьшение жировой инфильтрации, некровоспалительной активности, а также фиброзных изменений печени [51, 54, 55].
Тиазолидиндионы (агонисты PPAR-гамма (peroxisome proliferator-activated receptor)) – одни из наиболее изученных фармакологических агентов для НАСГ с хорошей доказательной базой [40]. Данные препараты снижают инсулинорезистентность, уровень триглицеридов, повышают уровень ЛПВП.
В ряде исследований, в частности в исследовании PIVENS, продемонстрированы противовоспалительный и метаболический эффекты пиоглитазона. Наблюдалось уменьшение инсулинорезистентности, синтеза жирных кислот в гепатоцитах, воспаления, а также улучшение гистологической картины печени [56–58].
В ряде случаев возможно развитие побочных эффектов: увеличение веса, остеопороз, сердечная недостаточность.
В рандомизированном плацебоконтролируемом исследовании FLIRT 2 на фоне применения розиглитазона зарегистрированы уменьшение инсулинорезистентности, уровня трансаминаз, улучшение гистологической картины печени [56, 59].
Бытует мнение, что инсулиносенситайзеры не показаны как специфическое лечение при НАЖБП (1А) [43], а применяются только при сочетании НАЖБП и сахарного диабета.
В исследовании PIVENS (247 пациентов без сахарного диабета) зафиксирован положительный эффект в отношении снижения стеатоза и воспаления на фоне применения витамина E у 43% пациентов, пиоглитазона – у 34%. В группе плацебо данный показатель составил 19% [60].
В крупном исследовании TONIC, посвященном оценке эффективности витамина E и метформина при НАЖБП, эффект получен только при использовании витамина E (снижение уровня АЛТ, улучшение гистологической картины) [61].
В настоящее время создаются новые инсулиносенситайзеры: полусинтетическая желчная кислота (обетихолевая кислота), агонист фарнезоидного Х-рецептора (Farnesoid-XR) – регулятор углеводного и липидного обмена, GFT505 – агонист ядерного PPAR, лираглутид (аналог человеческого глюкагоноподобного пептида-1, liraglutide – glucagon-like-P-1R).
В исследовании FLINT показано, что обетихолевая кислота уменьшает инсулинорезистентность, способствует снижению веса, уровня АЛТ, нормализации морфологической картины при НАСГ, уменьшая тем самым проявления воспалительной реакции и фиброза у 35% пациентов (в группе плацебо – 19%) [62]. В исследовании препарата GFT505 показано, что он уменьшает инсулинорезистентность, нормализует липидный спектр и печеночные тесты, способствует снижению веса, влияя на липогенез, инсулинорезистентности, уровня глюкозы, улучшает морфологическую картину печени (стеатоз и воспаление) [63].
Большинство специалистов считают антиоксиданты неотъемлемой частью лечения НАСГ [15, 20]. Согласно американским рекомендациям по лечению НАЖБП (2012), витамин E может быть назначен в дозе 800 МЕ/день пациентам с НАСГ как терапия первой линии. Показания базируются на результатах таких исследований, как PIVENS и TONIC. У пациентов с НАСГ, применявших витамин E в дозе 300–800 мг/сут в течение 12 месяцев, уменьшалась выраженность стеатоза, воспаления и фиброза печени [64].
Более значимый клинический эффект наблюдался при сочетании витамина E с пиоглитазоном (по сравнению с монотерапией витамином Е) [55]. Препарат не показан пациентам с сахарным диабетом, НАЖБП без биопсии, цирротической стадией НАСГ, криптогенным циррозом. Дискутируется вопрос о побочных эффектах витамина E (риск канцерогенеза и тромботических осложнений).
Важный момент в лечении НАЖБП – нормализация липидного обмена. Применение статинов рекомендовано только при наличии дислипопротеинемии у пациентов с НАСГ (1В) [5, 43].
В ряде плацебоконтролируемых слепых клинических исследований показаны безопасность и эффективность правастатина и аторвастатина, улучшение гистологической картины при НАЖБП [65–68].
Согласно данным Национальной ассоциации по безопасности статинов США (Statin National Lipid Assоciation Safety) (2012), при назначении статинов (оригинальных препаратов) поражение печени отмечается только в 0,5–2% случаев. При этом необходимы мониторинг печеночных тестов и назначение в ряде случаев гепатопротекторов. Исследование HPS с участием 20 000 пациентов, длительно принимавших симвастатин, показало, что значимое повышение уровня трансаминаз имело место только в 0,8% случаев [69].
При гипертриглицеридемии рекомендован прием препаратов омега-3 (1B) [43].
Определенный интерес для лечения НАСГ представляют препараты с противовоспалительным действием. Результаты ряда исследований продемонстрировали, что пентоксифиллин при НАСГ подавляет воспалительный процесс в печени, снижает уровень ФНО, интерлейкинов 6 и 8, темпы фиброгенеза и улучшает микроциркуляцию в печени [70].
Исследования эффективности инфликсимаба (моноклональные антитела к ФНО) не подтвердили его эффективность и безопасность при НАСГ.
На сегодняшний день накоплен клинический опыт применения ряда гепатопротекторов при НАСГ, в частности эссенциальных фосфолипидов, силимарина [50, 71]. К их основным эффектам относят мембраностабилизирующий, антиоксидантный и детоксицирующий.
Большинство клинических исследований эффективности гепатопротективных препаратов посвящено урсодезоксихолевой кислоте (УДХК). Как известно, УДХК обладает антиоксидантным, мембраностабилизирующим, цитопротективным, антиапоптотическим, антифибротическим действием и может успешно применяться при стеатогепатите [72]. На фоне лечения стандартными дозами УДХК у больных НАСГ достоверно улучшаются биохимические показатели, прежде всего холестаза [73].
Результаты плацебоконтролируемых мультицентровых исследований не продемонстрировали преимуществ высокодозового режима (23–28 мг/кг) перед стандартным [73, 74]. Одними авторами выявлены снижение N-терминального пептида коллагена 3-го типа и металлопротеиназ и улучшение гистологической картины печени при лечении УДХК [25, 75], другими четко не отмечен положительный эффект УДХК в отношении гистологической динамики [67, 76].
Получены данные о повышении эффективности УДХК в комбинации с другими препаратами: витамином E [72, 77], симвастатином [78], пентоксифиллином [25]. Однако данные ряда клинических исследований не подтвердили целесообразность назначения УДХК при НАСГ. В рекомендациях AGA 2012 г. препарат не показан при НАЖБП (1В) [43].
Клиническая эффективность препарата LOLA
Перспективным направлением терапии НАСГ является применение Л-орнитина-Л-аспартата (Гепа-Мерц). Гепа-Мерц (L-Ornithine-L-Aspartate – LOLA) – препарат, синтезированный в 1960-х гг. в Японии как средство детоксикации при отравлении аммиаком, впоследствии стали успешно использовать при печеночной энцефалопатии. LOLA способствует увеличению активности ферментов цикла обезвреживания аммиака в печени и мышцах и является одновременно донатором этих процессов. Существует достаточная доказательная база эффективности данного препарата при печеночной энцефалопатии, препарат включен в рекомендации EASL и AASLD 2014 г. по лечению печеночной энцефалопатии (1B, 2) [79]. Как детоксикант LOLA используется при эндотоксикозах различной этиологии (онкологические заболевания, ожоги, острый панкреатит и др.) [80–82]. Препарат применяется в ряде онкологических клиник с учетом не только детоксикации, но и гепатопротекции при развитии лекарственного гепатита на фоне химиотерапии [81]. Действительно, доказаны гепатопротективные свойства препарата, которые объясняют его успешное применение у пациентов с хроническими заболеваниями печени различной этиологии [41, 83, 84].
Данные многоцентрового нерандомизированного проспективного когортного исследования, проведенного в Германии, с участием 1167 пациентов с хроническими заболеваниями печени, в том числе 648 больных НАСГ, продемонстрировали эффективность и хорошую переносимость LOLA [84].
В 2010 г. мы участвовали в многоцентровом нерандомизированном клиническом исследовании эффективности и переносимости препарата LOLA у пациентов с НАСГ. Лечение 289 пациентов с использованием LOLA на протяжении трех месяцев способствовало значимому улучшению клинико-биохимических показателей, качества жизни. Пациенты хорошо переносили препарат [85].
В ряде других клинических исследований также показаны эффективность данного лекарственного средства и улучшение на фоне его применения биохимических показателей, прежде всего цитолитического синдрома, при НАСГ [41, 83, 86]. К его основным гепатопротективным свойствам относят способность улучшать энергетические процессы, синтез макроэргов в гепатоцитах за счет участия в цикле Кребса (орнитиновом цикле) и усиления бета-окисления жирных кислот в митохондриях, анаболический эффект и повышение синтеза белка, антиоксидантное действие [41, 83, 87–89].
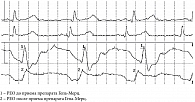
Наши исследования показали, что гепатопротективные свойства LOLA обусловлены в том числе положительным воздействием на портопеченочную гемодинамику. В нашей клинике оценка внутрипеченочной гемодинамики проводится методом полигепатографии (неинвазивный метод модифицированной импедансометрии печени, патент 2218070, 2003 г.) с выполнением функциональных тестов вазодилатации с нитропрепаратами, глубоким дыханием, позволяющим определять различные типы нарушений портопеченочного кровотока, локализацию гемодинамического блока (пресинусоидальный, синусоидальный и постсинусоидальный уровни). При обследовании пациентов с НАЖБП нарушения портопеченочного кровотока локализуются на синусоидальном уровне, как и при алкогольном поражении печени. С целью коррекции нарушений в зависимости от их типа применяются различные препараты. Установлено, что LOLA улучшает показатели внутрипеченочного кровотока у пациентов с разными типами нарушений портопеченочной гемодинамики, в том числе у больных НАЖБП (рис. 2) [90, 91]. В данном случае механизм улучшения гемодинамики скорее всего связан с участием LOLA в синтезе аргинина (донатора оксида азота) в процессе орнитинового цикла. LOLA – вазоактивный препарат, за счет стимуляции синтеза аргинина увеличивает продукцию NO и улучшает кровоток во многих органах (печень, мышцы, головной мозг). Коррекция нарушений портопеченочного кровотока является важным фактором для оптимизации патогенетической терапии хронических заболеваний печени. Улучшение портопеченочного кровотока способствует регенерации и функции гепатоцитов, препятствует прогрессированию фиброза печени. Регенерация гепатоцитов при применении LOLA может также оптимизироваться за счет усиления синтеза белка и улучшения энергетических процессов в поврежденных гепатоцитах [92].
Свойства LOLA (Гепа-Мерц), выявленные в ходе исследований, расширяют показания для его применения при хронических заболеваниях печени, включая НАСГ. Целесообразно дальнейшее проведение рандомизированных клинических исследований эффективности LOLA.
Таким образом, многочисленные клинические исследования, посвященные лечению НАЖБП, показали наибольшую эффективность немедикаментозных методов: снижения веса, диеты, физических нагрузок как первой ступени лечения. Гиполипидемические средства показаны только при дислипопротеинемии, инсулиносенситайзеры (пиоглитазон) – при сахарном диабете. Следующим шагом в лечении пациентов с НАСГ является назначение антиоксидантов и гепатопротекторов.
Перспективы
Продолжается изучение новых звеньев патогенеза стеатогепатита как новых терапевтических мишеней: открытие регуляторной молекулы microRNA, обнаруженной в периферической жировой ткани больных НАСГ [93], простеатотического фактора PPAR-гамма [94], митохондриального протеин-регулятора HINT2 [95], регулятора инсулинорезистентности KLF6 (Kruppel Like Factor) [64, 96]. Продолжаются клинические исследования селективных ингибиторов апоптоза (ингибиторы каспаз) GS-9450 и TRO 19622, антифибротического препарата GS-6624 (симтузумаб), лозартана, антиретровирусного препарата сенекривирок (Cenicriviroc) с противовоспалительным и антилипидным эффектом [40].
T.V. Yermolova, S.Yu. Yermolov, Ye.L. Belyayeva
North-Western State Medical University named after I.I. Mechnikov
Contact person: Tatyana Vladislavovna Yermolova, t.v.ermolova@mail.ru
Over the last years, nonalcoholic fatty liver disease becomes the most common among chronic liver diseases. Here we outline modern understanding regarding causes, mechanisms of its development, relationships with metabolic syndrome, and genetic factors.
The major modifications in therapeutic strategies shaped in recommendations of European and American associations on management of patients with nonalcoholic fatty liver disease are presented. A therapeutic approach, role of non-medicated methods to be used as a first line therapy, and efficacy of pathogenetic treatment are discussed by considering evidence-based data analysis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.