Неалкогольный стеатоз печени в практике интерниста
- Аннотация
- Статья
- Ссылки
Жировая инфильтрация печеночных клеток лежит в основе самостоятельного заболевания или синдрома, называемого стеатозом печени. Данный диагноз правомочен в том случае, если более 5-10% массы печени составляет жир, причем преимущественно в виде триглицеридов (ТГ) (2, 5, 9). При прогрессировании НАС в печени выявляются воспалительно-некротические изменения и происходит формирование фиброза, морфологически характерного для неалкогольного стеатогепатита (НАСГ). В некоторых случаях возможен переход НАСГ в цирроз с последующей необходимостью трансплантации печени (11).
Признанными факторами риска развития данной патологии являются ожирение, сахарный диабет типа 2, голодание (резкое снижение веса > 1,5 кг/нед), парентеральное питание, наличие илеоцекального анастомоза, избыточный бактериальный рост в кишечнике и др. (1, 3, 10).
Последние годы особое внимание клиницистов привлечено к проблеме метаболического синдрома (МС), который представляет собой комплекс многих взаимосвязанных факторов (инсулинорезистентность с гиперинсулинемией, НТГ/СД типа 2, висцеральное ожирение, артериальная гипертензия, атерогенная дислипидемия, микроальбуминурия, гиперкоагуляция, гиперурикемия или подагра, НАЖБ). Стеатоз печени может развиться не только вследствие нарушений метаболизма, но и при токсическом воздействии различных факторов на печень, в том числе гепатотоксических препаратов (кортикостероиды, антиаритмики и противоопухолевые препараты). Появляется все больше данных, свидетельствующих о том, что НАС, возможно, не вызывает значительного повышения печеночных ферментов. Так, если для НАС характерно соотношение АСТ/АЛТ в пределах меньше единицы, то при НАСГ уровень аминотрансфераз колеблется от нормальных до превышающих верхние границы нормы в 1,5-5 раз. К сожалению, не выявлена корреляция между повышением уровней печеночных ферментов и степенью стеатоза и воспаления, а также сроков перехода в НАСГ, который считается неблагоприятным вариантом развития НАЖБ. Для подтверждения диагноза НАСГ обычно необходима биопсия печени.
В связи с этим большинство исследователей сходятся во мнении, что НАЖБ является печеночной составляющей метаболического синдрома (МС). Снижение чувствительности к инсулину наиболее ощутимо в жировой, печеночной, мышечной тканях и надпочечниках. Инсулинорезистентность (ИР) жировой ткани проявляется угнетением антилиполитического действия инсулина, что приводит к накоплению свободных жирных кислот и глицерина, которые выделяются в портальный кровоток, поступают в печень и становятся источником формирования атерогенных липопротеинов низкой плотности (ЛПНП). Кроме этого, ИР гепатоцитов снижает синтез гликогена и активирует гликогенолиз и глюконеогенез (4).
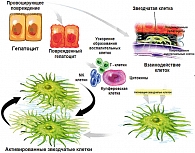
На рисунке 1 представлен механизм повреждения печени, включающий повреждение гепатоцита, активацию иммунной системы и противовоспалительный ответ. Противовоспалительные медиаторы – цитокины являются важнейшим стимулятором для активации звездчатых клеток с последующим формированием фиброгенеза. Они запускают механизм постоянного влияния через иммунную систему, включающую трансформирующий фактор роста β (TGF β-1), пластинообразующий фактор роста и эндотелий.
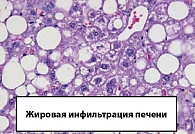
НАЖБ может развиться на фоне нарушения липидного обмена, при ожирении, голодании, чрезмерном употреблении углеводов и кортикостероидной терапии, а также при недостатке в пище белков (рисунок 2). Накопление жиров в печени может быть следствием либо избыточного поступления свободных жирных кислот, либо усиления синтеза свободных жирных кислот, пониженного уровня β окисления, снижения синтеза или секреции липопротеинов низкой плотности (ЛПНП). У пациентов с ожирением в ткани печени отмечено повышенное содержание свободных жирных кислот, что может быть причиной нарушения ее функции, поскольку жирные кислоты химически очень активны и могут повреждать биологические мембраны (рисунки 2, 3).
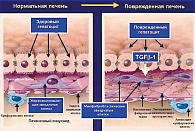
Механизм фиброгенеза происходит путем прогрессирования фиброза даже в отсутствии выраженного воспаления (рисунок 3). Важное звено фиброгенеза – активация цитокинов, среди которых особое место уделяется TGFβ-1, под воздействием которого происходит трансформация жиронакапливающих клеток Ито (печеночные звездчатые клетки) в фибробласты, продуцирующие коллаген. Васкуляризированные тяжи соединительной ткани (септы) могут развиваться со стороны портальных трактов или центральных вен, иметь различную протяженность и разделять паренхиму печени в различных направлениях. Как правило, септы появляются на месте массивной гибели клеток в виде ступенчатых, мостовидных или мультилобулярных некрозов. Нарастание септального фиброза возможно и через окислительный стресс. Если фиброзные септы не достигают близлежащих сосудистых структур, а слепо заканчиваются в дольке, их считают неполными. Септы могут соединять между собой центральные вены (центро-центральные септы) или портальные тракты (порто-портальные септы). Переломным моментом в формировании цирроза печени является появление порто-центральных септ, непосредственно соединяющих приносящие и выносящие сосуды печени. По этим шунтам часть крови минует дольки без контакта с метаболически активной паренхимой печени, в результате чего кровоснабжение паренхимы печени уменьшается. При развитии перисинусоидального фиброза соединительная ткань развивается в пространствах Диссе, что приводит к «капилляризации синусоидов». Перисинусоидальный фиброз препятствует обмену веществ между той порцией крови и паренхимой печени, которая протекает через синусоиды, а не через порто-венозные или артериовенозные шунты. Фиброз и изменение сосудистых структур печени ответственны за механический компонент в патогенезе портальной гипертензии.
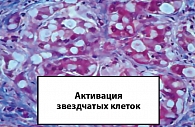
Связь между стеатозом, стеатогепатитом и развитием фиброза до сих пор не изучена. Перекисное окисление липидов может приводить к образованию потенциально токсичных промежуточных продуктов, которые могут вызвать воспалительные процессы в печени (1, 3). По-видимому, самый ранний признак развития фиброза – активация липотоцитов печени (известных как жиронакапливающие звездчатые клетки, или клетки Ито) в субэпителиальном пространстве Диссе (рисунки 1, 3, 4). Это приводит к пролиферации липотоцитов и запуску каскада процессов образования фиброзной ткани в печени (1, 5).
Развитие НАСГ и связанных с ним воспалительно-некротических изменений ткани печени частично связано с выявляемой у многих больных НАЖБ инсулинорезистентностью (ИР) (7). Это недавнее открытие убедило многих специалистов в необходимости проведения диетотерапии и физических упражнений для снижения веса у подобных больных, несмотря на то, что эффективность подобной терапии требует дальнейшего подтверждения путем проведения клинических исследований.
Клиническая симптоматика НАЖБ скудна и неспецифична. Заболевание может длительно протекать бессимптомно и патологические знаки со стороны печени (увеличение и уплотнение органа, изменения биохимических показателей) часто обнаруживаются случайно при обследовании по поводу другой патологии (сахарный диабет, артериальная гипертензия, эндокринные нарушения). Жалобы у большинства больных могут отсутствовать. У части пациентов проявляются астенический (повышенная утомляемость, слабость), диспепсический (метеоризм, тошнота, нарушения стула, тяжесть в правом подреберье), болевой (тупые боли в правом подреберье) синдромы. По данным литературы, подобные симптомы имели место у 30% обследованных лиц с данной патологией (2).
При физикальном обследовании у части пациентов пальпируется в различной степени увеличенная печень. Размеры и плотность печени отражают степень стеатоза и определяют характер прогрессирования. Размеры селезенки на стадии НАСГ обычно не изменены. При эхографическом обследовании выявляются жировая инфильтрация печени, в семиотику которой входят компактное расположение эхосигналов, повышение эхогенности ткани печени, обеднение сосудистого рисунка («белая печень»).
Биохимическая картина НАСГ характеризуется умеренно выраженным цитолитическим синдромом – повышением активности аланиновой (АЛТ) и аспарагиновой (АСТ) трансаминаз в достаточно широком диапазоне, у части пациентов отмечается повышение активности маркеров холестаза – щелочной фосфатазы (ЩФ), гамма-глутамилтранспептидазы (ГГТП), обычно не превышающих верхнюю границу нормы в 2-3 раза. Более высокая активность этих ферментов, означающих наличие внутрипеченочного холестаза, при этой патологии встречается редко, и в таком случае необходимо исключить другой или смешанный генез поражения печени (алкогольный, лекарственный и др.). Уровень билирубина у больных НАСГ обычно в пределах нормальных значений, белково-синтетическая функция печени сохранена, содержание альбумина и протромбина, как правило, в пределах нормы и снижается только при развитии цирроза печени. В связи с неспецифичностью клинико-биохимической картины заболевания диагностика НАСГ должна базироваться на данных морфологического исследования гепатобиоптата.
В ткани печени этих больных выявляются:
- жировая дистрофия печени (крупнокапельная, мелкокапельная, смешанная);
- центролобулярная (реже – портальная и перипортальная) воспалительная инфильтрация нейтрофилами, лимфоцитами, гистиоцитами;
- фиброз (перигепатоцеллюлярный, перисинусоидальный и перивенулярный) различной степени выраженности (рисунок 2).
Дифференциальную диагностику неалкогольного стеатогепатита необходимо проводить с вирусными гепатитами, гепатомой, первичным билиарным циррозом печени, алкогольным, лекарственными и токсическим гепатитами. Кроме того, важно исключить поражение печени вследствие тяжелого инфекционного заболевания, шока, сердечно-сосудистой недостаточности, глистных инвазий, заболеваний желчных путей.
К исследованиям, позволяющим проводить дифференциальную диагностику стеатогепатита, относятся биохимические исследования сыворотки крови (спектр печеночных ферментов), иммуноферментный анализ (маркеры вирусных гепатитов и опухолевого процесса) и инструментальные методы исследования (УЗИ, КТ, лапароскопия с биопсией печени, ЭРХПГ).
Выбор метода лечения
Оптимальные методы лечения НАЖБ до сих пор не определены. Но основными направлениями терапии являются улучшение периферической чувствительности к инсулину и ослабление воспалительно-некротической реакции ткани печени на хроническое повреждение, а также профилактика и устранение прогрессирующего фиброза.
Инсулинорезистентность
ИР – основная причина МС, одним из компонентов которого является сахарный диабет типа 2. Это патологическое состояние организма, которое может существовать в течение многих десятилетий прежде, чем диабет становится клинически очевидным из-за повышения уровня глюкозы. Стратегическим подходом в лечении диабета типа 2 является повышение чувствительности периферических тканей к инсулину.
Подтверждена гипотеза о том, что снижение веса и изменение образа жизни также улучшают состояние НАЖБ, особенно фиброз, и предотвращают прогрессирование заболевания. Однако мы не можем недооценить трудность в поддержании измененного образа жизни из-за физических или социальных барьеров, что подтверждает необходимость поиска новых эффективных методов лечения НАЖБ.
Гиполипидемические препараты
НАЖБ в большинстве случаев коррелирует с гиперлипидемией, особенно – с гиперхолестеринемией и гипертриглицеридемией. Ранее существовавший относительно неудачный подход к лечению заключался в снижении циркулирующих липидов в надежде на ответное снижение поглощения липидов печенью и, соответственно, снижение количества жира в печени. Для нормального функционирования печени необходимо наличие в крови небольшого количества циркулирующих триглицеридов, а липопротеиды низкой плотности (ЛПНП) используются в качестве «топлива» для мышц или откладываются в жировой ткани. Количество циркулирующих триглицеридов уменьшается. Таким образом, попытки уменьшить уровень циркулирующих в крови ТГ могут теоретически нанести вред секреции липидов печенью. Несмотря на это, препараты для лечения гиперлипидемии не были включены в список лекарственных средств, вызывающих НАЖБ, поэтому в настоящее время разрешено их использование при НСГ. Тем не менее, необходимо подвергнуть сомнению теорию, основанную на коррекции гиперлипидемии в качестве терапии болезни печени.
Также необходимо подвергнуть сомнению связь между гиперхолестеринемией и НСГ. Большая часть циркулирующего холестерина используется печенью для секреции липопротеинов. Препараты, снижающие синтез холестерина в печени, ингибиторы редуктазы 3-гидрокси-3-метил-глютарил-коэнзим А (ГМГ-КоА) или статины, могут приводить к повышению активности ферментов печени, вне зависимости от предшествующего заболевания печени (3, 4, 13). Наиболее часто возникающая проблема, с которой обычно сталкиваются специалисты, – это необходимость использования препаратов этого класса у больных с НАСГ или НАС. Поскольку не существует доказательств ухудшения повреждения печени, вызванного НСГ, статинами, большинство гепатологов допускают применение статинов у пациентов с повышенной активностью аминотрансфераз по жизненным показаниям только под контролем биохимических показателей. А в случае возникновения отрицательной динамики со стороны показателей печеночных ферментов на фоне терапии препарат следует отменить (8).
Рациональное использование статинов в качестве терапии НАЖБ сталкивается с некоторыми проблемами вследствие снижения уровня циркулирующего холестерина. Однако статины оказывают влияние на воспаление из-за снижения количества метаболитов холестерина, которые участвуют в регуляции внутриклеточной передачи сигналов. Сигнальным молекулам необходима предварительная стабилизация мембраны для активации процесса, а она в свою очередь требует наличия метаболитов холестерина. Таким образом, влияние на метаболизм холестерина оказывает разнообразное влияние на передачу противовоспалительных сигналов, которое, в свою очередь, может препятствовать развитию воспалительно-некротической реакции на избыток жира в гепатоцитах. Адекватность этого предположения рассматривается в проводимых на настоящий момент исследованиях (2, 6, 12).
Эссенциальные фосфолипиды (ЭФЛ)
При наличии клинико-биохимических признаков повреждения гепатоцитов (увеличение и уплотнение печени, цитолитический синдром) больным с НАСГ назначают лекарственную терапию. Размеры и консистенция паренхимы печени коррелируют со степенью стеатоза, а цитолиз – с повышением активности трансаминаз (АЛТ, АСТ), что является отражением повреждений клетки и, прежде всего, мембран, нарушения их проницаемости и целостности, сопровождающихся выходом ферментов в кровяное русло. Степень повышения активности трансаминаз коррелирует со степенью повреждения мембран гепатоцитов. Поскольку главная функция ЭФЛ – формирование двойного липидного слоя в мембранах клеток, путем введения ЭФЛ извне можно воздействовать на нарушенную функцию мембраны при повреждении гепатоцита и способствовать ее восстановлению. Молекулы ЭФЛ встраиваются в места непосредственного повреждения мембраны гепатоцита, замещая имеющиеся дефекты и защищая органеллы клетки. Ненасыщенные жирные кислоты, ЭФЛ повышают текучесть клеточных мембран, улучшают их эластичность и нормализуют проницаемость, уменьшают перекисное окисление липидов.
ЭФЛ, являющиеся основными элементами в структуре оболочки и органелл гепатоцитов, оказывают регулирующее действие на проницаемость биомембран, нормализуют функционирование липидзависимых ферментных транспортных систем печеночных клеток, обеспечивают нормальные процессы окислительного фосфорилирования, регулируют метаболизм липидов и белков. Таким образом, воздействуя на основные звенья патогенеза НАСГ, ЭФЛ способствуют нормализации важнейших функций гепатоцита и печени в целом.
Среди имеющихся на отечественном рынке лекарственных препаратов, содержащих ЭФЛ, заслуживает внимание Эссенциале Н, широко и длительно применяемый в России в качестве базисного препарата при лечении НАСГ, представленный в виде как раствора для внутривенного введения, так и капсул. В состав Эссенциале входят эссенциальные фосфолипиды – фосфатидилхолин 250 мг, дезоксихолевая кислота 115 мг, рибофлавина 0,5 мг, альфа-токоферол 0,75 мг и др. Причем его активная фракция (OLPC) содержится в наибольшем процентном соотношении по сравнению с другими гепатопротекторами на основе фосфолипидов. Использование дезоксисихолиевой кислоты способствует улучшению биохимических показателей, обратному развитию имевшихся ранее клинических проявлений и улучшению морфологической картины (5).
Суммируя вышесказанное, можно заключить, что изменение образа жизни со снижением массы тела в комплексе с проведением медикаментозной терапии является современной лечебной тактикой у пациентов с НАЖБ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.