Хроническая гипергликемия как фактор поддержания метаболического гомеостаза Helicobacter pylori при сахарном диабете
- Аннотация
- Статья
- Ссылки
- English
Прошло 40 лет с момента описания Helicobacter pylori в качестве патогена при развитии хронического активного и атрофического гастрита, язвенной болезни (ЯБ) и рака желудка [1–4]. Эта бактерия встречается практически у половины населения земного шара [4, 5]. В недавно опубликованном исследовании выявлено, что в России инфицировано около 40% населения, причем с возрастом распространенность H. pylori увеличивается [6]. В ряде исследований было показано, что у пациентов с сахарным диабетом (СД) H. pylori выявляется более часто, чем в общей популяции [7–9]. Это сопровождается значительным увеличением риска развития H. pylori-ассоциированных заболеваний [7, 9, 10]. Наряду с этим в научной литературе имеются работы, в которых рассмотрена обратная ситуация – частота встречаемости СД 2-го типа (СД2) у H. pylori-положительных пациентов [11, 12]. Однако связь между инфекцией H. pylori и риском развития СД2 остается спорной и неоднозначной. Так, в проспективном когортном исследовании, проведенном C.Y. Jeon и соавт., было показано, что инфекция H. pylori коррелирует с высоким риском развития СД2 [13]. Аналогично на основании проведенного метаанализа K. Mansori и соавт. высказывают предположение, что H. pylori может выступать в качестве одного из факторов риска развития СД2 [9]. Напротив, в других исследованиях сообщается, что H. pylori никак не связана ни с инсулинорезистентностью, ни с распространенностью СД2 [14, 15]. Данные Т. Tamura и соавт. свидетельствуют о том, что инфекция восточноазиатского CagA-позитивного H. pylori не является фактором риска развития СД2 [16]. При этом у пациентов с СД 1-го типа (СД1) и СД2 успешные показатели эрадикации H. pylori составляют 62 и 50% соответственно, что намного ниже, чем у лиц, не страдающих этими двумя формами заболевания [17–20]. Низкая эффективность эрадикационной терапии инфекции H. pylori у пациентов с СД представлена во многих работах [21–23].
Выявлена четкая взаимосвязь более высокой частоты выявляемости H. pylori у пациентов с СД и более низкой эффективности эрадикационной терапии у них с уровнем гипергликемии [8, 11, 23]. Неконтролируемый диабет с развитием хронической гипергликемии приводит к ряду метаболических изменений [24]. В свою очередь, хроническая гипергликемия приводит к повышенной восприимчивости пациентов с СД к инфекционным агентам [8, 24]. Точные механизмы, которые связывают хроническую гипергликемию с повышенной частотой выявляемости H. pylori, а также механизмы, которые способствуют улучшению выживаемости этой бактерии у пациентов с СД при проведении эрадикационных мероприятий, остаются неизвестными. Понимание того, как связаны хроническая гипергликемия и поддержание метаболического гомеостаза H. pylori для ее жизнедеятельности и размножения у пациентов с СД, имеет важное научное и практическое значение.
Предлагается рассмотреть один из возможных гипотетических механизмов влияния хронической гипергликемии на повышенную частоту выявляемости H. pylori; возможные метаболические изменения в бактериальной клетке в условиях хронической гипергликемии; значение контроля гипергликемии для результатов эрадикационной терапии.
Известно, что H. pylori колонизирует слизистую оболочку желудка. Чтобы установить долгосрочную колонизацию, бактерия должна адаптироваться к питательным условиям, которые существуют в месте ее обитания. Удивительно, но мало кто обращает внимание на предпочтительные источники питательных веществ и энергии для жизнедеятельности, роста и размножения H. pylori и никто не рассматривает изменения источников пищевых ингредиентов и энергии для H. pylori, которые могут возникать у пациентов с СД. Имеющиеся данные свидетельствуют о том, что для жизнедеятельности, роста и размножения H. pylori использует аминокислоты и карбоновые кислоты, которые в достаточном количестве образуются в желудке в результате гидролиза пищевых белков [25–27]. H. pylori катаболизирует большое количество аминокислот, наиболее существенными из которых являются аланин, аргинин, аспарагин, аспартат, глутамат, глутамин, пролин и серин [25, 28, 29]. H. pylori также может катаболизировать фумаровую, яблочную и молочную кислоты [28, 30]. Аминокислоты и карбоновые кислоты при этом выступают в качестве источников углерода, азота и энергии.
Бактерия H. pylori практически не зависит от сахаров, таких как глюкоза [25–27]. Однако известно, что глюкоза является одним из важнейших углеводов, который используется для жизнедеятельности многими микроорганизмами, в том числе и обитающими в пищеварительной системе. Более того, А. Wang и соавт. [31] считают, что глюкоза играет ключевую роль в исходе бактериальной инфекции у человека. Встает вопрос: а может ли H. pylori использовать глюкозу в качестве пластического и энергетического материала? Исследования, проведенные в 90-е гг. прошлого столетия и позже, указывают на то, что H. pylori имеет ферментные системы, способные утилизировать углеводы, в частности D-глюкозу [32, 33]. Эти данные свидетельствуют о том, что бактерия H. pylori в своем эволюционном, филогенетическом развитии и приспособлении к жизнедеятельности и размножению в желудке не только приобрела возможность перестроить свой метаболизм для использования аминокислот в качестве пластического и энергетического материала, но и, вероятнее всего, сохранила возможность использовать для своей жизнедеятельности и углеводы (как многие бактерии микробиома человека). Имеются экспериментальные данные, показывающие, что добавление глюкозы в питательную среду при выращивании H. pylori усиливает ее рост [23].
Хроническая гипергликемия у пациентов с СД включает компенсаторные механизмы, направленные на нормализацию уровня глюкозы крови. Для выведения избытка глюкозы у пациентов с СД и хронической гипергликемией, вероятнее всего, включается не пищеварительная (выделительная) функция слизистой оболочки желудка. Это приводит к тому, что у пациентов с СД и хронической гипергликемией H. pylori получает преимущества для своего роста, размножения и выживания, так как может использовать для своей жизнедеятельности не только аминокислоты, но и имеющуюся в избытке у пациентов с СД глюкозу. Высказанное предположение позволяет объяснить более частое, чем в общей популяции, выявление H. pylori у пациентов с СД.
Исходя из этого предположения (гипотезы), можно объяснить и данные по более низкой эффективности эрадикационной терапии у пациентов с СД. Схемы эрадикации H. pylori содержат антибактериальные препараты (кларитромицин, метронидазол, препараты висмута и др.) и препараты, снижающие выработку соляной кислоты. Применение антисекреторных препаратов направлено на создание оптимальных условий для кислотозависимых антибактериальных средств [34, 35]. Данные, представленные в недавних работах, свидетельствуют о том, что определение рН желудочного сока чрезвычайно важно при проведении эрадикации H. pylori [34, 35]. При этом антисекреторные препараты оказывают на H. pylori двойное воздействие с противоположным эффектом. Повышение рН в желудке является благоприятным фактором для жизнедеятельности H. pylori. Но при этом они лишают H. pylori питательных веществ. В желудке под воздействием соляной кислоты происходит денатурация пищевых белков и начинается их гидролиз ферментами желудочного сока пепсином и гастриксином. В результате образуются олигопептиды различной длины и определенное количество аминокислот, которые H. pylori и использует для своей жизнедеятельности. Прием ингибиторов протонной помпы приводит к резкому снижению денатурации пищевых белков. Как следствие, значительно снижается скорость гидролиза белков. В результате в желудке практически не образуются аминокислоты, необходимые для поддержания жизнедеятельности H. pylori. Отсутствие питательных веществ и прием пациентами антибактериальных препаратов приводят либо к гибели микроорганизма, либо к переходу его в покоящуюся (дормантную) форму [36]. Второе при мощной антибактериальной терапии встречается редко.
Хроническая гипергликемия при СД и развивающийся дефицит аминокислот при проведении эрадикационной терапии приводят к тому, что H. pylori может и начинает использовать в качестве энергетического и пластического материала глюкозу. Вероятно, такой механизм и позволяет этому микроорганизму успешно переживать экстремальные условия эрадикации. Но происходить это может только при наличии хронической гипергликемии. То есть выживаемость H. pylori в экстремальных условиях эрадикации должна зависеть от уровня и длительности гипергликемии. Чем дольше период гипергликемии с высоким ее уровнем, тем больше вероятность у H. pylori пережить экстремальные условия эрадикации.
Хроническую гипергликемию можно оценить с помощью уровня гликированного гемоглобина А (HbA1c) в крови. Уровень HbA1c является результатом неферментативного гликозилирования гемоглобина с образованием связи между глюкозой и свободной N-концевой аминогруппой пролина в β-цепи гемоглобина. Показатель играет важную роль в мониторинге динамики уровня глюкозы в крови у пациентов с СД и для оценки эффективности приема гипогликемических препаратов [37]. В 2011 г. Всемирная организация здравоохранения официально рекомендовала значения HbA1c ≥ 6,5% в качестве диагностической пороговой точки для СД [38]. Этот показатель отражает интегрированный уровень глюкозы в крови за последние три-четыре месяца [39]. Связь между инфекцией H. pylori и HbA1c у пациентов с СД была подтверждена во многих исследованиях [37, 40]. Уровни гликированного гемоглобина А были у пациентов с СД и инфекцией H. pylori достоверно выше, чем у пациентов с СД и без инфекции H. pylori (WMD = 0,50, 95%-ный доверительный интервал (ДИ) 0,28–0,72; p < 0,001) [37]. При анализе подгрупп по подтипу СД была выявлена корреляция между инфекцией H. pylori и повышенным уровнем HbA1c при СД1 (I2 = 74%, p < 0,001; WMD = 0,46; 95% ДИ 0,12–0,80) и при СД2 (I2 = 90%, p < 0,001; WMD = 0,59; 95% ДИ 0,28–0,90; p < 0,001) [37].
В диссертационной работе Л.Г. Бектемировой, выполненной под руководством академика РАН И.В. Маева и профессора А.М. Мкртумяна, уровень HbA1c использовали для оценки эффективности приема гипогликемических препаратов у 83 пациентов с СД2 и H. pylori-ассоциированными заболеваниями на фоне проведения эрадикационной терапии [41]. Было показано, что у 62 пациентов из 83 обследованных уровень HbA1c достиг целевого (< 6,5%), в то время как у 21 больного оставался повышенным. Это означает, что, несмотря на прием гипогликемических препаратов, уровень гипергликемии сохранялся у этих пациентов как минимум два-три месяца. Именно у этих пациентов, не достигших целевого уровня HbA1c, отмечалась достоверно (p < 0,017) более низкая эффективность эрадикационной терапии по сравнению с группой пациентов, у которых был достигнут целевой уровень гликированного гемоглобина А. Полученные Л.Г. Бектемировой данные косвенным образом указывают на то, что бактерия H. pylori, вероятнее всего, «воспользовалась» хронической гипергликемией для своего выживания в экстремальных условиях эрадикации.
По данным C.H. Tseng, использование инсулина для нормализации уровня глюкозы в крови у пациентов с СД2 значительно повышает частоту эрадикации H. pylori по сравнению с больными СД без инсулина [20]. Более высокая эффективность эрадикации H. pylori у пациентов с СД2 при использовании инсулина предполагает, что у этих пациентов на фоне инсулинотерапии, вероятнее всего, происходила нормализация уровня глюкозы в крови, что скорее всего и приводило к повышению эффективности эрадикации H. pylori.
Заключение
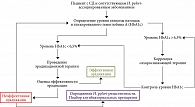
Имеющиеся литературные данные позволяют высказать следующую гипотезу: у пациентов с СД бактерия H. pylori, вероятнее всего, использует для своей жизнедеятельности как аминокислоты, так и глюкозу. Гипотеза позволяет объяснить высокую частоту выявляемости H. pylori у пациентов с СД, а также более низкую эффективность у них эрадикационной терапии. Безусловно, эта гипотеза требует дальнейших подтверждений с использованием биохимических, микробиологических, молекулярно-генетических и других методов исследования. Необходимо проведение дальнейших многоцентровых исследований, направленное на подтверждение высказанной гипотезы. Но если эта гипотеза верна, то, прежде чем проводить эрадикацию H. pylori у пациентов с СД, необходимы обязательное мониторирование и целенаправленная коррекция уровня глюкозы крови и HbA1c по алгоритму, представленному на схеме (рисунок). Следование данному алгоритму имеет важное практическое значение как для контроля гликемии, так и для достижения успеха эрадикационной терапии.
Авторы заявляют об отсутствии конфликта интересов.
I.V. Maev, PhD, Prof., Academician of the RAS, V.I. Reshetnyak, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Vasily I. Reshetnyak, vasiliy.reshetnyak@yandex.ru
Helicobacter pylori (H. pylori) occurs in almost half of the world's people. It has been shown that in patients with diabetes mellitus (DM), H. pylori is detected more often than in the general population, which is accompanied by a significant increase in the risk of developing H. pylori-associated diseases. Along with this, low efficacy of eradication therapy of H. pylori infection was revealed in patients with DM. In patients with DM, there is a correlation between a higher frequency of H. pylori detection and a lower efficacy of eradication therapy from the level of chronic hyperglycemia. The exact mechanisms of these phenomena are unknown. The authors make a hypothetical assumption that in patients with diabetes mellitus, the H. pylori bacterium most likely uses both amino acids and glucose for its vital activity. The hypothesis allows us to explain the relationship of chronic hyperglycemia with an increased frequency of H. pylori detection, as well as to understand the mechanisms that contribute to improving the survival of this bacterium in patients with DM during eradication therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.