Тиазолидиндионы: есть ли повод для нападок?
- Аннотация
- Статья
- Ссылки
Тиазолидиндионы (ТЗД) – новый класс противодиабетических препаратов, получивших образное название сенситайзеров (повышающих чувствительность), вошедший в клиническую практику в течение последнего десятилетия. Благодаря уникальному механизму действия – активации ядерного рецептора, активируемого пролифератором пероксисом (PPARγ) – ТЗД снижают резистентность клеток инсулинозависимых тканей к инсулину и таким образом воздействуют на одно из основных звеньев патогенеза СД типа 2. Неудивительно, что ТЗД (росиглитазон, пиоглитазон) нашли широкое применение в терапии СД 2 по всему миру, особенно в качестве препаратов второй и третьей линии. О нежелательных явлениях, связанных с использованием ТЗД, известно давно, и грамотное применение этих препаратов позволяет минимизировать вероятность их развития. Однако за последний год особенно актуализировалась тема нежелательных явлений со стороны сердечно-сосудистой системы на фоне приема ТЗД, причиной для чего послужила в первую очередь майская (2007) публикация Nissen и соавт. в «New England Journal of Medicine» (1). Эта работа уже неоднократно обсуждалась в международной и российской медицинской периодике, поэтому здесь мы лишь вкратце напомним, что она представляет собой мета-анализ данных 42 рандомизированных клинических исследований, в результате которого был сделан вывод, что применение одного из ТЗД – росиглитазона связано с повышенным риском инфаркта миокарда и кардиоваскулярной смерти. Статья Nissen вызвала буквально шквал ответных публикаций, по-видимому, вследствие того, что многие авторы сочли ее выводы слишком далеко идущими.
Здесь мы хотели бы сообщить российским врачам лишь о двух новых публикациях по той же теме, в которых содержатся более существенные и достаточно хорошо проверенные данные.
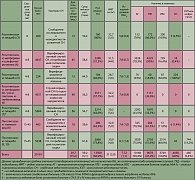
В сентябре 2007 г. в знаменитом британском «Lancet» была напечатана статья Lago и соавт. (2), сообщивших о результатах своего мета-аналитического исследования, задачей которого было оценить риск развития сердечной недостаточности (СН) и смерти вследствие сердечно-сосудистой патологии (СССП) у больных, принимающих ТЗД. Первичному скринингу было подвергнуто большое количество исследований – 3048, из которых на основе строгих критериев было отобрано семь. Согласно этим критериям, исследования должны были быть рандомизированными, двойными слепыми, с наличием контрольных групп пациентов и регистрацией данных по частоте СН и СССП и/или соотношениям риска в сравнении с контролем. Отбор публикаций осуществлялся двумя независимыми экспертами. При этом тщательно оценивалось наличие факторов предвзятости на всех этапах исследований. Данные об отобранных клинических исследованиях приведены в таблице 1.
В результате многопланового статистического анализа было установлено следующее. Во всех исследованиях с общим количеством участников 20191 человек, причем среди них были больные, как предиабетом, так и СД 2, было зарегистрировано 360 случаев СН, в том числе 214 случаев среди 9360 больных, получавших тиазолидиндионы, и 146 случаев СН среди 10831 больных, получавших препараты сравнения или плацебо. Гетерогенности результатов между исследованиями обнаружено не было, что свидетельствует о свойстве всего класса ТЗД повышать риск развития СН. Общая частота СН среди больных, получавших ТЗД, составила 2,4%, среди не получавших ТЗД – 1,4%. Соотношение риска развития СН по сравнению с контролем для всех исследований составило 1,72 (95% ДИ – 1,21-2,42), для росиглитазона – 2,18 (95% ДИ – 1,44-3,32), для пиоглитазона – 1,32 (95% ДИ – 1,04-1,68).
Между тем, достоверного повышения риска СССП в связи с применением ТЗД выявлено не было. Частота СССП среди принимавших и не принимавших ТЗД была одинаковой – 0,7%, а риск СССП при использовании росиглитазона или пиоглитазона по сравнению с контролем составил 0,93 (95% ДИ – 0,67-1,29, р=0,68).
Последовательное исключение каждого исследования из анализа не повлияло на результаты. Они были сходными независимо от того, анализировались ли больные только СД 2 или вместе с больными предиабетом и метаболическим синдромом, с наличием или отсутствием СН в анамнезе, не зависимо от того, получали ли больные в контрольной группе плацебо или другие противодиабетические препараты (не ТЗД).
Не имели статистической значимости по риску СН и СССП и различия между росиглитазоном и пиоглитазоном (соотношение риска СН: 1,74, 95% ДИ – 0,97-3,14; р=0,07; соотношение риска СССП: 1,01, 95% ДИ – 0,73-1,40; р=0,96).
Авторы сделали вывод о том, что по данным подвергнутых мета-анализу исследований больные, принимавшие тиазолидиндионы, имели повышенный риск развития СН по сравнению с больными из контрольных групп (получавших плацебо или другие противодиабетические препараты), но при этом риск СССП в связи с применением ТЗД не повышался. Интерпретируя эти данные, можно предположить, что повышение риска СН связано со способностью ТЗД задерживать жидкость в организме, хотя механизм этого феномена пока точностью не ясен. Отсутствие различий в риске СССП между больными, принимающими ТЗД, и контролем может быть объяснено тем, что задержка жидкости как причина СН, развивающейся на фоне приема ТЗД, связана с меньшей угрозой жизни и лучшим прогнозом, чем причины, которые обуславливают СН у больных, не принимающих ТЗД. Определенную роль здесь могут играть кардиопротективные свойства ТЗД.
Отличия результатов мета-анализа Lago и соавт. (2) от мета-анализа Nissen и соавт. (1) могут объясняться более строгим отбором исследований в первой работе, исключением мелкомасштабных исследований с короткими сроками наблюдения, недостаточными для надежной оценки риска СН и СССП.
Мета-аналитические исследования оказывают неоценимую помощь в охвате и анализе большого количества разноплановых данных, однако следует всегда учитывать, что результаты любого мета-анализа имеют лишь относительную достоверность и не могут сравниться с результатами проспективных крупномасштабных исследований. Основная роль мета-анализа – «поймать» проблему и обосновать актуальность дальнейших проспективных исследований.
В связи с этим особый интерес представляет публикация промежуточных результатов исследования RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) (11). Это долгосрочное многоцентровое международное рандомизированное открытое исследование, целью которого является сравнение сердечно-сосудистых исходов у больных СД 2, получающих росиглитазон в комбинации с метформином или сульфонилмочевиной, с сердечно-сосудистыми исходами у больных, получающих комбинацию метформина с сульфонилмочевиной. Набор больных проводился в 338 клиниках 23 стран Европы и Австралазии (Австралии с прилегающими регионами Океании) с апреля 2001 г. по апрель 2003 г. Планируемая медиана периода наблюдения должна составить 6 лет, однако в публикации промежуточных результатов приведены данные на 30.03.07, при этом медиана длительности наблюдения равна 3,75 года. В исследование включались больные СД 2 в соответствии с критериями ВОЗ, в возрасте 40-75 лет, с индексом массы тела (ИМТ) не более 25,0 кг/м2, уровнем гликозилированного гемоглобина (HbA1c) более 7,0%, но не более 9,0% на фоне терапии максимальными дозами метформина или препаратов сульфонилмочевины. Критериями исключения были прием других препаратов, снижающих гликемию, госпитализация по поводу серьезной сердечно-сосудистой патологии в течение предшествующих 3 мес., планируемое сердечно-сосудистое вмешательство, сердечная недостаточность, заболевание печени с клиническими проявлениями, нарушение функции почек и неконтролируемая артериальная гипертензия. После 4-недельного вводного периода больные, получавшие сульфонилмочевину, рандомизировались на 2 группы: в одной группе к сульфонилмочевине добавляли росиглитазон, в другой – метформин; больные, уже получавшие метформин, также рандомизировались на 2 группы: в одной группе к метформину добавлялся росиглитазон, в другой – сульфонилмочевина. Целевым уровнем HbA1c был уровень ниже 7,0%, начальная доза росиглитазона составляла 4 мг/сут., дозировки метформина и сульфонилмочевины (как и выбор препарата сульфонилмочевины) определялись практикой, принятой в каждой клинике. Если через 8 недель терапии уровень HbA1c превышал 7,0%, то дозировки увеличивались, причем максимальная доза росиглитазона составляла 8 мг/сут., метформина – 2250 мг, глибурида – 15 мг, гликлазида – 240 мг, глимепирида – 4 мг. Если уровень HbA1c превышал 8,5% на фоне максимальных дозировок, в группе росиглитазона в терапию добавлялся третий препарат, в группе контроля – инсулин. Если в группе росиглитазона на фоне трех препаратов сохранялся уровень HbA1c выше 8,5%, рекомендовалось отменить росиглитазон и назначить инсулин.
Первичным критерием оценки (первичной конечной точкой) был факт госпитализации (по поводу инфаркта миокарда, СН, инсульта, нестабильной стенокардии, транзиторного приступа ишемии, ампутации конечности или любой другой четко определенной сердечно-сосудистой патологии) или смерти вследствие сердечно-сосудистой патологии (СССП) (включая СН, острый инфаркт миокарда, внезапную смерть и смерть, вызванную острой сосудистой патологией, включая инсульт). Вторичными критериями оценки (вторичными конечными точками) были по отдельности факты СССП, смерти по любой причине, инфаркта миокарда (приведшего к госпитализации или/и смерти), СН (приведшей к госпитализации или/и смерти) и общая частота СССП+инфаркт миокарда+инсульт. Во время проведения анализа промежуточных результатов ряд случаев сердечно-сосудистых исходов ожидал верификации, поэтому были проведены отдельно анализ верифицированных случаев и совместный анализ верифицированных и неверифицированных случаев.
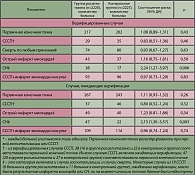
В исследование было включено 4458 больных, 11 из них не получили ни одной дозы исследуемых препаратов, с 10% больных связь была утеряна. Промежуточные результаты (медиана продолжительности наблюдения – 3,75 г) представлены в таблице 2.
Для верифицированных случаев первичная конечная точка была зарегистрирована в 217 случаях в группе росиглитазона и 202 – в контрольной группе (соотношение риска 1,08; 95%ДИ – 0,89-1,31). Еще 50 случаев в группе росиглитазона и 41 случай в контрольной группе ожидали верификации. Учет этих случаев дал следующие цифры: соотношение риска 1,11; 95% ДИ – 0,93-1,32. Таким образом, различия по первичной конечной точке не достигли статистической значимости, как без учета, так и с учетом неверифицированных случаев.
Также не было статистической достоверности у различий по следующим вторичным конечным точкам: острый инфаркт миокарда, смерть вследствие сердечно-сосудистой патологии или по любой другой причине, общая частота СССП+инфаркт миокарда+инсульт. Соотношение риска СССП в группе росиглитазона по сравнению с группой контроля с учетом случаев, ожидающих верификации, составило 0,80 (95% ДИ – 0,52-1,24).
Единственная конечная точка, по которой имелось достоверное нарастание риска в группе росиглитазона по сравнению с контролем, – это сердечная недостаточность: соотношение риска для верифицированных случаев – 2,24 (95% ДИ – 1,27-3,97); для всех случаев – 2,15 (95% ДИ – 1,30-3,57).
Итак, общий вывод, который можно сделать из промежуточных результатов исследования RECORD, в целом подкрепляет данные мета-анализа Lago и соавт.: тиазолидиндионы, в частности росиглитазон, действительно повышают риск развития сердечной недостаточности, при этом, что весьма существенно, риск смерти в связи с сердечно-сосудистой патологией не нарастает. Данные по сердечной недостаточности не являются новыми и отражены в европейской инструкции по применению препарата. Авторы указывают, что причина повышения частоты сердечной недостаточности может быть связанна со свойством класса тиазолидиндионов – повышением задержки жидкости. Заключительные данные будут получены по окончанию исследования RECORD.
Международные агентства (FDA и EMEA) рекомендовали продолжить пациентам проводимую терапию тиазолидиндионами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.