Эффективность нутритивной поддержки в диетотерапии больных ожирением
- Аннотация
- Статья
- Ссылки
- English

Введение
Несмотря на достижения современной клинической нутрициологии, проблема лечебного питания больных в стационаре остается актуальной для медицинских учреждений большинства развитых стран. Известно, что нормальное или даже избыточное потребление пищевых продуктов далеко не всегда обеспечивает сбалансированное поступление основных макронутриентов и большинства микронутриентов. Это приводит к нарушению функционирования организма и развитию целого ряда заболеваний [1–3]. Сбалансированный рацион человека должен включать макронутриенты (белки, углеводы, в том числе пищевые волокна, жиры), минеральные соли, воду, микронутриенты (витамины и витаминоподобные соединения, микроэлементы) исходя из его индивидуальных физиологических потребностей, рассчитанных с учетом основного заболевания и особенностей метаболического статуса [4, 5].
Опыт лечения ожирения свидетельствует о том, что в основе его эффективной диетотерапии лежит редукция энергетической ценности рациона питания и нутритивная коррекция нарушений обмена веществ при обязательном адекватном обеспечении пластических потребностей организма. В условиях практического здравоохранения этого можно достичь с помощью нутритивной поддержки в виде применения смесей для энтерального питания (ЭП) [6–9].
В клинической практике смеси для ЭП продемонстрировали высокую эффективность в лечении пациентов с травмой, ожогами, печеночной, почечной, легочной и сердечной недостаточностью, онкологическими заболеваниями и другими патологическими состояниями [10–12].
Энтеральное питание в виде сипинга (напитки, кремы и другие продукты с повышенными вкусовыми качествами для приема через рот) широко используется в ситуациях, когда обычный прием даже усиленной калориями и питательными веществами пищи не обеспечивает возросших потребностей организма, в частности при потере 5% тощей массы тела (ТМТ) (массы тела (МТ) без учета жировой ткани) за последние три месяца или 10% ТМТ – за шесть месяцев.
Включение специализированных пищевых смесей, сбалансированных по микронутриентному составу и обладающих направленным лечебным эффектом, в стандартные схемы диетотерапии ожирения считается перспективным направлением, хотя и недостаточно изученным.
Исходя из вышеизложенного целью настоящего исследования стала оценка влияния диетотерапии с включением смесей для ЭП на основные показатели нутритивного статуса больных ожирением.
Материал и методы
В отделении сердечно-сосудистой патологии ФГБУН «Федеральный исследовательский центр питания, биотехнологии и безопасности пищи» проведено изучение показателей нутритивного статуса у пациентов с ожирением первой – третьей степени в возрасте от 18 до 69 лет.
В результате скрининга в основное клиническое исследование был включен 81 пациент, в том числе 41 (51%) мужчина и 40 (49%) женщин, с ожирением и патологией сердечно-сосудистой системы (артериальной гипертензией и/или ишемической болезнью сердца и др.).
Всем пациентам на этапе рандомизации и в процессе наблюдения проведено комплексное исследование метаболического статуса, включавшее оценку показателей антропометрии и композиционного состава тела, а также энергетического обмена.
Антропометрические параметры включали МТ (кг), индекс массы тела (ИМТ) (кг/м2), окружность талии (ОТ) (см), окружности бедер (ОБ) (см), отношение окружности талии к окружности бедер (ОТ/ОБ). Для расчета ИМТ использовали формулу Кетле: масса тела (кг)/рост (м2).
Композиционный состав тела (общую жидкость (кг), мышечную массу (кг), жировую массу (кг), тощую массу (кг)) оценивали методом биоимпедансного анализа с помощью анализатора InBody 720i (Biospace Co., Ltd., Южная Корея).
Исследование энергетического обмена проводили методом непрямой респираторной калориметрии с использованием метаболографа CORTEX Biophysik MetaMax® 3B portable CPX system (Cortex, Германия). Полученные данные обрабатывали с помощью программного обеспечения CORTEX Biophysik MetaSoft® CPX testingsoftware (Cortex, Германия). Определяли показатель энерготрат покоя (ккал/сут), скорость окисления основных макронутриентов (белков, жиров, углеводов). Скорость окисления белков (СОБ) (г/сут), скорость окисления жиров (СОЖ) (г/сут) и скорость окисления углеводов (СОУ) (г/сут) рассчитывали по формуле Вейра. Полученные данные сравнили с ожидаемыми, определяемыми по формуле Харриса – Бенедикта.
Переносимость проводимой диетотерапии оценивали анкетно-опросным методом по пятибалльной шкале.
Обследование пациентов проводили дважды – до и после традиционного курса лечения, включавшего диетотерапию, симптоматическую лекарственную терапию, лечебную физкультуру и физиопроцедуры.
Статистическая обработка результатов проводилась согласно общепринятым методам с использованием пакетов прикладных программ Statistica 10 и SAS JMP 11. После проверки данных на нормальность распределения с помощью критерия Шапиро – Уилка их анализировали с использованием параметрических критериев. Данные представлялись как среднее значение и стандартное отклонение (M ± SD). Достоверность различий между исследуемыми группами определяли с помощью t-критерия Стьюдента. Статистически значимыми считали различия при р < 0,05.
Исходя из целей исследования при проведении курса диетотерапии все пациенты были разделены на три группы: первую группу, вторую группу и контрольную группу.
Пациенты контрольной группы (10 мужчин и 13 женщин) в течение всего курса диетотерапии (14 дней) получали базисный рацион редуцированной (пониженной) калорийности с энергетической ценностью 1700 ккал/сут.
Пациенты первой группы (8 мужчин и 13 женщин) дополнительно к базисному рациону получали смесь Impact® Oral (Nestle, Швейцария) для ЭП в количестве 237 мл/сут во время второго завтрака.
Пациенты второй группы (23 мужчины и 14 женщин) дополнительно к базисному рациону получали смесь Resource® 2.0 + Fibre (Nestle, Швейцария) для ЭП в количестве 200 мл/сут также во время второго завтрака.
Impact® Oral – полноценная сбалансированная питательная смесь, обогащенная аргинином, полиненасыщенными жирными кислотами (ПНЖК) омега-3 и нуклеотидами, а также содержащая жизненно необходимые витамины и микроэлементы. Иммунопитание Impact® предназначено для коррекции клинического, метаболического и иммунологического статуса пациентов и представляет собой готовую к употреблению жидкость в жестких пакетиках по 237 мл.
Resource® 2.0 + Fibre – сбалансированная питательная смесь с высоким содержанием белка и витаминов. Это специализированный продукт диетического питания для людей с повышенными потребностями в белке, энергии, витаминах и микроэлементах. Выпускается в бутылках по 200 мл.
Выбор смеси для ЭП проводился на основании анализа количественного состава белка, качественного и количественного состава жира, качественного и количественного состава витаминно-минерального комплекса и незаменимых микронутриентов, а также удобства применения.
Модификация базового питания с помощью смесей для ЭП осуществлялась с целью обеспечения рациона физиологической нормой потребления белка (1,0 г/кг массы тела пациента), восполнения в редуцированном по калорийности рационе уровня потребления незаменимых микронутриентов (витаминов и микроэлементов).
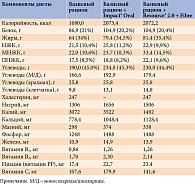
Химический состав применяемых рационов представлен в табл. 1.
Как видно из таблицы 1, обогащение базового рациона, редуцированного по калорийности, смесями для ЭП позволило увеличить количественное содержание белка, оптимизировать жирнокислотный состав (уменьшить содержание насыщенных жирных кислот (НЖК) и увеличить содержание мононенасыщенных жирных кислот (МНЖК) и полиненасыщенных жирных кислот), обогатить рацион питания пищевыми волокнами и незаменимыми микронутриентами.
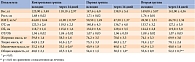
Анализируемые группы были сопоставимы по всем исходным характеристикам. Не было выявлено статистически значимых различий между группами по возрасту, антропометрическим данным, показателям биоимпедансометрии и др. Участники исследования не принимали лекарственную терапию, которая могла бы повлиять на результаты исследования, в том числе биологически активные добавки к пище и витамины. Клиническая характеристика больных, включенных в исследование, представлена в табл. 2.
Базовая фармакотерапия пациентов включала ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II, β-блокаторы, периферические антагонисты кальция пролонгированного действия, антагонисты альдостерона, аспирин.
Результаты и их обсуждение
Результаты проведенного исследования показали, что пациенты хорошо переносили проводимую диетотерапию, каких-либо побочных явлений и аллергических реакций не отмечено.
Независимо от варианта диетотерапии практически у всех больных как в первой и второй группах, так и в контрольной группе наблюдалась положительная динамика клинической симптоматики: уменьшение слабости, сердцебиения, одышки, частоты возникновения и продолжительности кардиалгий. Повысилась толерантность к физической нагрузке.
Во всех группах отмечена одинаковая удовлетворительная редукция МТ. Так, за 14-дневный курс лечения у пациентов первой и второй групп масса тела снизилась на 6,0 и 5,3%, у пациентов контрольной группы – на 6,0%. Индекс массы тела уменьшился на 6,0, 5,3 и 6,0% соответственно.
На фоне снижения МТ у значительного большинства больных отмечено изменение антропометрических показателей, при этом более выраженное во второй группе (табл. 3). В частности, ОТ у пациентов второй группы уменьшилась на 5,0%, а у пациентов первой группы и контрольной группы – на 3,0%. Динамика изучаемых показателей в силу недостаточно большой выборки не была достоверной, но оказалась достаточно значимой и согласовалась с результатами международных наблюдений за данной категорией пациентов.
Анализ композиционного состава тела также свидетельствовал о положительной динамике показателей во всех наблюдаемых группах, при этом значительно более выраженной у пациентов первой и второй групп. В частности, редукция жировой массы тела у пациентов первой и второй групп составила 6%, а у пациентов контрольной группы – 2,5%. Редукция тощей (безжировой) массы тела – 7, 6 и 5% соответственно.
При проведении первичной биоимпедансометрии у значительного большинства больных выявлено избыточное содержание общей жидкости. Согласно данным литературы и данным собственных исследований, назначение рациона пониженной калорийности сопровождается умеренным дегидратационным эффектом. Результаты настоящего исследования также подтвердили результаты вышеуказанного наблюдения. При этом степень выраженности дегидратационного эффекта диетотерапии была больше у получавших рационы, обогащенные смесями для ЭП. Так, в результате проведенного курса диетотерапии у пациентов первой группы количество общей жидкости организма статистически значимо уменьшилось на 7,4%, (р < 0,05), у пациентов второй группы – достоверно на 6,0% (р < 0,01), у пациентов контрольной группы – на 5,0%.
На фоне диетотерапии пониженной калорийности часто наблюдается редукция мышечной массы тела, обусловленная преимущественно недостаточным количеством белка в применяемых рационах. Это является прогностически неблагоприятным фактом, ассоциированным с высоким риском рецидива ожирения, и требует поиска решений данной проблемы. Одним из вариантов может быть восполнение необходимой (физиологической) квоты белка в рационе с помощью дополнительного его обогащения смесью для ЭП в качестве источника легкодоступного белка с высокой биологической ценностью.
Результаты проведенного нами исследования показали, что диетотерапия с включением смесей для ЭП сопровождалась редукцией мышечной массы у пациентов первой группы на 2%, у пациентов второй группы на 4%, а у пациентов контрольной группы – статистически значимо на 6% (р < 0,05). Таким образом, дополнительное применение смесей для ЭП способствовало заметно меньшей редукции мышечной массы по сравнению с традиционной диетотерапией, применяемой для коррекции массы тела у пациентов с ожирением.
Известно также, что использование рационов пониженной калорийности у больных ожирением часто приводит к уменьшению активности энергетического обмена – снижению величины энерготрат покоя (основного обмена (ОО)), скорости окисления макронутриентов (белков, жиров и углеводов), что имеет прогностически неблагоприятные последствия и повышает риск нивелирования позитивных результатов коррекции (редукции) массы тела в ближайший постстационарный период.
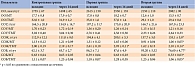
Анализ энергетического обмена методом непрямой респираторной калориметрии показал, что обогащение базисного рациона смесями для ЭП привело к повышению активности энергетического обмена, особенно рассчитанного в условных единицах – отношение основного обмена к массе тела (ОО/МТ) и отношение основного обмена к тощей массе тела (ОО/ТМТ) (табл. 4). Так, у пациентов контрольной группы в результате диетотерапии ОО уменьшился на 3%, а его удельные показатели (ОО/МТ и ОО/ТМТ) остались практически неизменными.
В первой группе ОО снизился на 3%, а его удельные величины повысились на 2,2 и 3,4% соответственно. Во второй группе ОО также уменьшился на 3%, удельный ОО по отношению к ТМТ остался практически неизменным, а удельный ОО по отношению к МТ повысился на 7%.
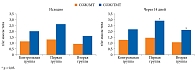
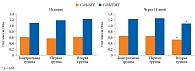
Аналогичная тенденция выявлена при анализе скорости окисления макронутриентов, при этом в наибольшей степени в отношении динамики СОЖ. В частности, у пациентов контрольной группы в результате проведенного курса диетотерапии СОЖ снизилась на 2%, а ее удельные показатели (СОЖ/МТ и СОЖ/ТМТ) повысились на 7 и 10% соответственно. У пациентов первой группы СОЖ повысилась на 3%, СОЖ/МТ и СОЖ/ТМТ – на 11 и 13% соответственно (р < 0,05). У пациентов второй группы СОЖ статистически значимо повысилась на 12% (р < 0,05), СОЖ/МТ – на 17% (р < 0,05), СОЖ/ТМТ – на 30% (р < 0,05) (рис. 1).
Повышение СОЖ и ее удельных величин свидетельствует об активации процессов липолиза, направлено на редукцию жировой массы тела пациента с ожирением, а также на лечение ожирения как такового и профилактику развития возможных осложнений. Дополнительное применение смесей для ЭП способствовало существенной активации данных процессов у больных ожирением и стало крайне благоприятным фактом проведенного курса диетотерапии.
Особо необходимо отметить тенденцию, выявленную при анализе СОБ и ее удельных величин (СОБ/МТ, СОБ/ТМТ). Так, в результате проведенного курса диетотерапии в первой группе и контрольной группе СОБ увеличилась на 2,0 и 2,5%, удельные величины также увеличились на 7 и 3%, 9 и 13% соответственно. У пациентов второй группы диетотерапия способствовала статистически значимому снижению СОБ на 18% (р < 0,05), а СОБ/МТ и СОБ/ТМТ – на 14% (р < 0,05) и 15% (р < 0,05) соответственно (рис. 2). Это свидетельствует о торможении окисления белка, то есть о повышении активности анаболизма белка, и является прогностически благоприятным фактом, направленным на последующее увеличение объема мышечной массы и энерготрат покоя.
Заключение
Результаты проведенного исследования показали, что при диетотерапии ожирения подход, основанный на обогащении лечебного рациона питания энтеральными смесями, имеет значимые преимущества перед тактикой применения стандартных диет. У больных, получавших диету с включением смесей для ЭП, удалось добиться более выраженной положительной динамики показателей антропометрии (соотношения окружности талии и окружности бедер) и композиционного состава тела (более выраженная редукция жировой массы тела, жидкости при менее выраженной редукции мышечной массы), а также существенной активации энергетического обмена в виде повышения энерготрат покоя, скорости окисления жиров и снижения скорости окисления белков (р < 0,05).
Конфликт интересов. Автор заявляет об отсутствии возможных конфликтов интересов.
Финансирование. Источник финансирования – федеральный бюджет. Публикация подготовлена в рамках выполнения фундаментальной научно-исследовательской работы ФГБУН «Федеральный исследовательский центр питания, биотехнологии и безопасности пищи».
S.A. Derbeneva, PhD
Federal Research Centre for Nutrition, Biotechnology and Food Safety
Contact person: Svetlana A. Derbeneva, sderbeneva@yandex.ru
In obese patients, enteral nutrition mixtures were additionally included in the reduced-calorie diet therapy as part of traditional treatment measures in order to replenish physiological needs for protein and micronutrients. The use of this nutritional support has contributed to a favorable change in the metabolic status, manifested in a marked improvement in anthropometric parameters and body composition (statistically significantly greater reduction in total fluid (p < 0.01) and lesser reduction in muscle mass (p < 0.05)), as well as significant activation of energy metabolism manifested in an increase in resting energy expenditure, a statistically significant increase in the rate of fat oxidation (p < 0.05) and a decrease in the rate of protein oxidation (p < 0.05).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.