Баета – патофизиологический подход в лечении сахарного диабета типа 2
- Аннотация
- Статья
- Ссылки
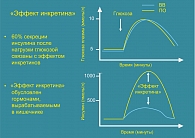

Показано, что после приема глюкозы внутрь наблюдается более выраженное увеличение секреции инсулина по сравнению с тем, которое наблюдается после внутривенной инфузии глюкозы, сопровождающейся идентичным повышением уровня гликемии. Этот эффект, названный «эффектом инкретина», свидетельствует о большой значимости сигналов ЖКТ в гормональной регуляции гомеостаза глюкозы (рисунок 1).
Инкретины относятся к семейству гормонов, стимулирующих секрецию инсулина в ответ на прием пищи. До 70% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов, который значительно снижен у больных СД типа 2 и НТГ.
Двумя самыми важными гормонами-инкретинами являются:
- глюкозозависимый инсулинотропный полипептид (GIP), прежде известный как желудочный ингибиторный полипептид;
- глюкагон подобный пептид (GLP-1).
Глюкозозависимый инсулинотропный гормон (ГИП)
ГИП – принадлежит к семье пептидов глюкагон-секретин. ГИП секретируется клетками K, с самой высокой плотностью в двенадцатиперстной кишке, однако они обнаружены в слизистой всего тонкого кишечника. Секреция полипептида стимулируется поглощаемыми углеводами и жирами. Обычно наблюдается 10-20-кратное повышение его плазменной концентрации в ответ на прием пищи.
Глюкагон подобный пептид (ГПП-1)
У здоровых людей ГПП-1 является одним из самых сильных стимуляторов секреции инсулина. ГПП-1 принадлежит к суперсемейству пептидных гормонов «глюкагон-секретин», которых объединяет схожесть аминокислотной последовательности с молекулой глюкагона, составляющая от 21% до 48%. Несмотря на то, что эти пептиды происходят из одного предшественника – проглюкагона, они существенно различаются по их влиянию на основные метаболические процессы.
В L-клетках, которые в основном располагаются в дистальной части ЖКТ – подвздошной и толстой кишке, проглюкагон расщепляется не с образованием глюкагона, как в β-клетках, а с отщеплением от С-конца двух глюкагоноподобных пептидов. Эти пептиды, ГПП-1 и ГПП-2 характеризуются практически 50% гомологией по аминокислотной последовательности с глюкагоном.
ГПП-1 имеет короткий период полужизни, который составляет всего 60-90 секунд. Его быстрая инактивация, с образованием неактивных метаболитов происходит под влиянием дипептидил пептидазы ΙV (ДПП-IV).
Секреция ГПП-1 дистальными отделами ЖКТ контролируется нервными и эндокринными сигналами, которые инициируются как поступлением пищи в проксимальные отделы ЖКТ, так и прямым воздействием пищевых нутриентов на L-клетки. С этим связан двухфазный механизм секреции ГПП-1. Первая фаза секреции (15-30 мин.) – это фаза раннего выделения ГПП-1 под совместным влиянием гормональных и нервных факторов, вторая поздняя фаза секреции (30-60 мин.) – это фаза, которую инициирует прямой контакт пищевых нутриентов с L-клетками.
Физиологические эффекты ГПП-1
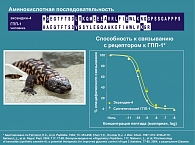
Физиологические эффекты ГПП-1 реализуются после его взаимодействия со специфическими рецепторами, которые экспрессируются во многих органах и тканях, включая поджелудочную железу, желудок, тонкий кишечник, мозг, гипофиз, легкие, почки, сердце. Основным органом-мишенью для ГПП-1 являются островки Лангерганса. Инсулинотропная активность ГПП-1, которая четко зависит от уровня гликемии, реализуется путем взаимодействия ГПП-1 со специфическими рецепторами, расположенными на мембране β-клетки. Необходимо отметить, что ГПП-1 активирует ген глюкокиназы и ген, кодирующий транспортер глюкозы GLUT 2, которые ответственны за внутриклеточный механизм секреции инсулина.
Инфузия ГПП-1 вызывает снижение концентрации глюкозы крови до уровня гликемии натощак. Как только уровень гликемии снижается и приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается.
Таким образом, клинически важным следствием зависимости эффектов ГПП-1 от уровня глюкозы крови является то, что ГПП-1 не может вызывать выраженную гипогликемию. Действие ГПП-1 способствует адекватному секреторному ответу β-клеток в ответ на глюкозу. Это важное свойство ГПП-1 может улучшить способность β-клеток к восприятию глюкозы и их секреторный ответ на глюкозу у пациентов с НТГ. Существует обратная зависимость между пищевой секрецией ГПП-1 и ростом инсулинорезистентности.
Другим важным физиологическим эффектом ГПП-1 является его влияние на секрецию глюкагона. ГПП-1 глюкозозависимым механизмом подавляет секрецию глюкагона панкреатическими α-клетками.
Таким образом, ГПП-1 регулирует концентрацию глюкозы плазмы в основном, модулируя секрецию, как инсулина, так и глюкагона, то есть, он необходим, как для нормальной толерантности к глюкозе, так и для адекватной постпрандиальной секреции инсулина.
Последние исследования выявили следующие эффекты ГПП-1:
- потенцирует глюкозозависимую секрецию инсулина;
- усиливает биосинтез инсулина;
- повышает экспрессию гена инсулина;
- повышает экспрессию генов, важных для функции бета-клеток глюкокиназы, Глют 2 и др);
- оказывает митотическое действие на бета-клетки и способствует дифференцировке клеток-предшественников протоков;
- подавляет апоптоз бета-клеток;
- подавляет секрецию глюкагона.
Хорошо известно, что в регуляции работы желудка принимает участие дистальная часть тонкого кишечника. ГПП-1 контролирует скорость опорожнения желудка, связываясь с рецепторами в мозге и стимулируя парасимпатические нервы. Это замедляет опорожнение желудка, снижает желудочную (стимулированную пентагастрином и пищевыми стимулами) и панкреатическую секрецию. Замедление опорожнения желудка ГПП-1, является перспективным в плане такого аспекта терапии СД типа 2, как снижение экскурсии глюкозы в постпрандиальном периоде.
По-видимому, наиболее неожиданным действием ГПП-1 является подавление им поглощения пищи и воды. Согласно последним данным, ГПП-1 является сильным анорексигенным гормоном, схожим по действию с лептином, и антагонистом таких орексигенных гормонов, как нейропептид Y и кортиколиберин. ГПП-1 участвует в процессах регуляции пищевого поведения, действуя через центральные механизмы, и способствует развитию чувства насыщения.
Крайне важны в клиническом плане β-цитотрофические эффекты ГПП-1, которые были выявлены у животных. В исследованиях in vitro и in vivo на животных моделях показан цитопротективный эффект ГПП-1, включающий увеличение массы β-клеток, стимуляцию неогенеза островков, усиление дифференцировки новых β-клеток из клеток-предшественниц эпителия панкреатического протока. Кроме того, ГПП-1 способствует трансформации неинсулинпродуцирующих клеток в инсулинсекреторные клетки. Нормальное количество β-клеток поддерживается равновесием процессов пролиферации и апоптоза. Недавно было показано, что один из механизмов увеличения массы β-клеток обусловлен именно антиапоптозным действием ГПП-1.
При СД типа 2 нарушенный «эффект инкретина» является одним из патофизиологических механизмов, приводящих к неадекватной секреции инсулина. При проведении тестов с пероральной и внутривенной нагрузкой глюкозы, у пациентов СД типа 2 «эффект инкретина» практически полностью отсутствовал или был значительно снижен. Поэтому вероятно, что недостаточная функция инкретина играет существенную роль в патогенезе заболевания.
Механизмы, лежащие в основе снижения инкретинового эффекта при диабете типа 2 различны. Теоретически, инкретиновый дефект может произойти из-за нарушения секреции или ускоренного метаболизма гормонов или снижения чувствительности к ним.
Исследования обнаружили у пациентов с СД типа 2, в ответ на прием пищи, очень существенное нарушение секреции ГПП-1.
Введение экзогенного ГПП-1 восстанавливает нормальный инсулиновый ответ на глюкозу у пациентов СД типа 2. Крайне важно заметить, что физиологические эффекты ГПП-1 включают воздействие на практически все хорошо известные патофизиологические нарушения при СД типа 2, а именно: на дисфункцию β-клеток, сниженный «эффект инкретина»; гиперсекрецию глюкагона, ускоренное опорожнение желудка; повышенный аппетит и избыточную массу тела; прогрессивное снижение β-клеточной массы.
Инкретины в терапии сахарного диабета типа 2
Имеющиеся данные, свидетельствующие о дефиците инкретинов при СД типа 2, являются основанием для того, чтобы считать усиливающие инкреторный эффект препараты новым терапевтическим принципом в лечении диабета. В недавно проведенном исследовании было продемонстрировано, что введение ГПП-1 пациентам СД типа 2 может полностью нормализовать у них чувствительность β-клеток к глюкозе, а также частично восстанавливать утраченную первую фазу секреции инсулина и полностью восстанавливать вторую фазу секреции инсулина в условиях гипергликемического «клэмп» теста.
В настоящее время новые терапевтические подходы в лечении СД типа 2 связывают с модуляцией активности и уровня ГПП-1 посредством назначения аналогов и миметиков ГПП-1 (эксенатид, лираглютид, CJC-1131). Эксенатид (Баета) – миметик ГПП-1, синтетическая форма гормона рептилий экзентида-4 (рисунок 3), является наиболее изученным препаратом из этой группы (5, 6). Экзентид-4 – пептид, выделенный из слюнных желез ящерицы Gila monster (Heloderma suspectum), имеющий 53% гомологию с человеческим ГПП-1. В отличие от ГПП-1 препарат устойчив к ДПП-IV из-за особенностей аминокислотной последовательности (глицин в 2-ой позиции) (10, 11, 12).
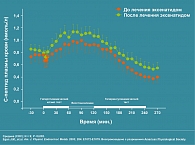
В различных клинических исследованиях было показано, что эффекты Баеты независимы от продолжительности и тяжести сахарного диабета (3, 6). Подкожное введение Баеты сопровождается достижением метаболического контроля и увеличением чувствительности к инсулину (рисунок 4), уменьшением аппетита, снижением массы тела, снижением уровня глюкагона и СЖК (2, 4, 5).
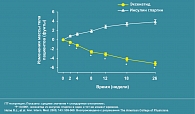
В недавно проведенном исследовании у пациентов с СД типа 2, в группе больных, получавших п/к 10 мкг Баеты было получено снижение уровня HbA1c на 0,9% и на 0,6% – у получавших 5 мкг Баеты. Уровень HbA1c менее 7% был достигнут у 34,2% больных, получавших 10 мкг Баеты, и у 26,7% больных, получавших 5 мкг Баеты. Кроме того, в группе больных, получавших 10 мкг Баеты, на 30 неделе терапии отмечено достоверное снижение веса на 1,9 кг (рисунок 5).
В 26-недельном исследовании проводилась сравнительная оценка клинической эффективности Баеты и инсулина гларгина (10). В исследовании приняли участие 551 пациент СД типа 2 и неэффективным контролем гликемии.
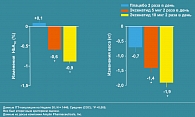
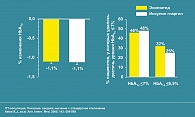
Через 26 недель у всех больных наблюдалось улучшение контроля гликемии, одинаковое снижение показателей HbA1c как в группе Баеты, так и инсулина гларгин (рисунок 6).
Вместе с тем, дополнительным, положительным эффектом лечения Баетой являлось снижение массы тела больных, в то время как, на фоне лечения инсулином гларгин больные прибавили в весе (рисунок 7).
Гипогликемия натощак достоверно реже возникала у больных, получавших терапию Баетой.
Неадекватно повышенный уровень глюкагона как натощак, так и постпрандиально, характерен для пациентов СД типа 2 (1, 8, 10). В исследованиях Kolterman, было продемонстрировано снижение уровня глюкагона на фоне терапии эксенатидом, что является значительным преимуществом Баеты по сравнению с другими сахароснижающими препаратами (9). Основным не желательным явлением является тошнота легкой или умеренной степени, проходящая через одну, две недели и не вызывающая существенного дискомфорта.
Таким образом, Баета (Эксенатид) открывает новую эру в лечении сахарного диабета типа 2, которую можно смело назвать патофизиологически обоснованным. Легкость в применении препарата, эффективность в отношении снижения как натощаковой, так и постпрандиальной гликемии, гликированного гемоглобина и прогрессирующее снижение веса выгодно отличают Баету от существующих антидиабетических препаратов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.