Некоторые клинико-фармакологические аспекты терапии внебольничной пневмонии
- Аннотация
- Статья
- Ссылки
- English




Под внебольничной пневмонией (ВП) понимают острое инфекционное заболевание, которое развивается во внебольничных условиях либо в первые 48 часов с момента госпитализации и проявляется поражением нижних дыхательных путей и рентгенологическими признаками свежих очаговых и/или инфильтративных изменений в легких в отсутствие очевидной диагностической альтернативы.
Тяжелая внебольничная пневмония – особая форма заболевания, сопровождающаяся выраженной дыхательной недостаточностью и/или синдромом системного воспалительного ответа, характеризующаяся плохим прогнозом и требующая интенсивной терапии.
Объективная оценка тяжести состояния позволяет выявить риски неблагоприятных исходов, а также свести к минимуму случаи необоснованной госпитализации. Иными словами, такая оценка необходима для принятия решения о тактике ведения пациента и об оптимальном месте проведения лечения (в домашних условиях, отделении общего профиля, отделении интенсивной терапии).
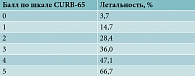
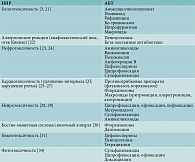
Распространенная шкала PORT (Pneumonia Outcomes Research Team), или PSI (Pneumonia Severity Index), предусматривает 20 критериев, на основании которых прогнозируют вероятность летального исхода, формируют рекомендации о выборе места лечения и приоритетных направлениях эмпирической антимикробной терапии (АМТ). Шкала PSI достаточно громоздка и трудоемка, позволяет оценить демографические параметры, наличие сопутствующих заболеваний, физикальные характеристики и спектр биохимических показателей, определение которых весьма затруднительно в амбулаторно-поликлинических учреждениях. Более простыми и доступными для рутинного использования считаются шкалы CURB-65/CRB-65 (рис. 1). На основании суммы набранных баллов решается вопрос о госпитализации пациента. Между тем шкалы CURB-65/CRB-65 не учитывают показатели, характеризующие дыхательную недостаточность (например, уровень сатурации), коморбидность, социальные факторы, тяжесть состояния пациентов в возрасте до 65 лет с сопутствующими заболеваниями.
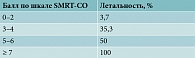
Шкала SMART-COP предусматривает балльную оценку клинических, лабораторных, физических и рентгенологических признаков с определением вероятностной потребности в указанных выше интенсивных методах лечения (табл. 1) [1, 2]. Взаимосвязь тяжести состояния по шкалам CURB-65 и SMRT-CO и летальности отражена в табл. 2 и 3 [3].
Независимо от того, какая система используется, в каждом конкретном случае следует учитывать факторы риска, наличие сопутствующих заболеваний, приверженность пациента лечению и медицинские ресурсы, доступные вне стационара [2, 4, 5]. Для решения вопроса о госпитализации в отделение реанимации и интенсивной терапии (ОРИТ) целесообразно исходить из критериев, предложенных экспертами Американского общества инфекционных заболеваний (Infectious Diseases Society of America – IDSA) и Американского торакального общества (American Thoracic Society – ATS): наличие одного большого критерия – выраженной дыхательной недостаточности, требующей проведения искусственной вентиляции легких, или септического шока с необходимостью введения вазопрессоров либо трех малых критериев – частоты дыхательных движений ≥ 30 в минуту, РаО2/FiO2 ≤ 250, мультилобарной инфильтрации, нарушения сознания, уремии (остаточный азот мочевины ≥ 20 мг/дл), лейкопении (лейкоциты < 4 × 109/л), тромбоцитопении (тромбоциты < 100 × 1012/л), гипотермии (< 36 °С), артериальной гипотензии, требующей интенсивной инфузионной терапии [2, 4].
Согласно обновленной концепции «Сепсис-3» (2016 г.), для выявления пациентов с подозрением на сепсис и возникшую угрозу жизни вне ОРИТ следует использовать шкалу Quick SOFA (Sepsis-related Organ Failure). Она помогает оценить полиорганную недостаточность у больных с септическим синдромом, получающих интенсивную терапию, без прогнозирования летальности.
Потенциальная польза от внедрения новых критериев заключается в обосновании выбора места оказания помощи в стационаре исходя из степени риска развития неблагоприятного исхода и проведении целенаправленного мониторинга за состоянием пациентов.
Факторы, влияющие на этиологию и риск заболеваемости ВП
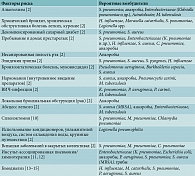
Определившись с местом лечения, необходимо в кратчайший срок назначить антимикробные препараты (АМП). Значение имеют такие факторы, как пожилой/старческий возраст, наличие сопутствующих заболеваний, предшествующая антибактериальная терапия (АБТ) (последние три месяца) и/или обращения за медицинской помощью в течение предыдущих шести месяцев до индексного события. Именно эти факторы способны повлиять на структуру этиологически значимых возбудителей, а следовательно, на эмпирический выбор стартовой АМТ (табл. 4) [2, 4].
Среди больных ВП модифицированного подхода к диагностике и лечению требуют [6]:
- лица пожилого и старческого возраста;
- пациенты, имеющие особенности образа жизни (курение, профессиональные вредности, злоупотребление алкоголем, наркомания и проч.);
- коморбидные больные;
- пациенты с высоким риском антибиотикорезистентности.
Уровни распространенности ВП и летальности у пожилых пациентов выше, чем у более молодых. С учетом старения населения данные показатели в большинстве стран будут возрастать.
У лиц старше 60 лет пневмония обычно развивается на фоне измененной легочной ткани, нарушенной вентиляции и перфузии, что обусловлено не только возрастной инволюцией, но и коморбидностью, нередко в стадии декомпенсации. Часто скудная или атипичная клиническая картина затрудняет своевременную диагностику, что способствует позднему назначению АМП и ухудшению прогноза. Разумеется, у любого пациента, в большей степени у лиц преклонного возраста, маскировать клинические проявления пневмонии способна фоновая патология. Наибольшее значение имеют бронхообструктивные заболевания (хроническая обструктивная болезнь легких и бронхиальная астма), бронхоэктазы, хроническая сердечная недостаточность, заболевания гепатобилиарной системы и поджелудочной железы, дорсопатия, злокачественные новообразования, декомпенсированный сахарный диабет. К развитию пневмонии приводят хроническая ишемия головного мозга, острое нарушение мозгового кровообращения, когнитивные расстройства, сенильная деменция, аспирация желудочного содержимого на фоне угнетения кашлевого рефлекса, гастроэзофагеальная рефлюксная болезнь, прием препаратов, способствующих микроаспирации (седативные средства, миорелаксанты, ингибиторы протонной помпы, препараты для анестезии), вызывающих иммуносупрессию (глюкокортикостероиды, цитостатики, ряд моноклональных антител и др.), злоупотребление алкоголем. Дополнительным фактором инфицирования нижних дыхательных путей является аспирация из полости рта измененного видового состава микробной флоры при пародонтозе, кариесе, когда начинают преобладать аэробные грамотрицательные энтеробактерии и золотистый стафилококк [7]. Частые госпитализации, предыдущее использование АМП повышают риск появления полирезистентных микроорганизмов.
С одной стороны, риск возникновения ВП увеличивается в случае коморбидности, с другой – пневмония, как и любой иной инфекционный процесс, способна отягощать и декомпенсировать сопутствующие заболевания, что еще больше увеличивает летальность (табл. 5 и 6) [2, 8–15]. Способ реализации этих патогенетических событий обусловлен влиянием инфекционных токсинов, повышением уровня воспалительных цитокинов, усилением перекисного окисления липидов, интоксикацией, приводящей к прогрессированию эндотелиальной дисфункции и повышению агрегации тромбоцитов [16–18]. Взаимосвязь между сопутствующими заболеваниями и риском ВП отражена практически во всех руководствах по лечению пневмонии.
Таким образом, пневмония и фоновая патология являются взаимоотягощающими факторами. Поэтому тактика ведения пациентов направлена на решение двух стратегических задач – адекватное применение АМП и коррекцию декомпенсированных сопутствующих заболеваний.
Оценка эффективности и безопасности антимикробных препаратов при ВП
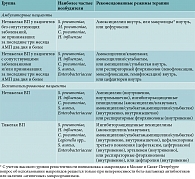
Выбирая стартовую антибактериальную терапию, врачи руководствуются международными и национальными рекомендациями, в основе которых лежат эпидемиологический анализ и результаты рандомизированных клинических исследований. Вместе с тем однородность групп в таких исследованиях ограничивает участие пациентов с сопутствующей патологией. Кроме того, региональные и локальные особенности резистентности инфекционных агентов в совокупности могут существенно повлиять на эффективность АМТ. Как следствие – более частое использование комбинаций антибиотиков, смена АМП, увеличение дозы и длительности приема в рамках рекомендаций (табл. 7) [2, 19].
Российские национальные рекомендации по Стратегии Контроля Антимикробной Терапии (СКАТ) в стационарах России, впервые изданные в 2012 г., были пересмотрены и усовершенствованы в 2016 и 2018 гг. В данных рекомендациях предусмотрено, что особое значение при выборе АМП имеет стратификация больных по риску наличия резистентных возбудителей:
- внебольничные инфекции без факторов риска полирезистентных возбудителей – тип I;
- внебольничные инфекции с факторами риска полирезистентных возбудителей – тип II;
- нозокомиальные инфекции – тип III (в 2016 г. разделены на подтипы – IIIa – вне ОРИТ без предшествующего применения АБТ, IIIb – длительная госпитализация (свыше семи дней), и/или нахождение в ОРИТ (более трех дней), и/или предшествующее применение АБТ;
- нозокомиальные инфекции с риском инвазивного кандидоза – тип IV.
В целях реализации проекта СКАТ изучают распространенность возбудителей инфекций в отделениях многопрофильного стационара и выявляют резистентность к АМП. Стратификация пациентов по группам риска в зависимости от возраста, сопутствующих заболеваний, предшествующей АМТ, контакта с лечебными учреждениями вместе с определением эпидемиологической ситуации для каждого отделения позволяет формировать локальные протоколы стартовой эмпирической антимикробной терапии не только на госпитальном, но и на амбулаторном этапе. Таким образом, решение вопроса о назначении АБТ невозможно без учета локальной эпидемиологической ситуации.
Обратная сторона терапевтической эффективности АМТ – нежелательные побочные реакции (НПР) и межлекарственное взаимодействие. Согласно российской статистике, при анализе 1000 спонтанных сообщений о НПР 25% приходится на АМП [20]. Вероятность развития побочных эффектов АМП возрастает вследствие недооценки анамнеза (непереносимость антибиотиков), нарушения элиминации АМП (функциональные нарушения почек у пожилых лиц или хроническая болезнь почек), лекарственного взаимодействия у больных, получающих лекарственные препараты по поводу сопутствующей патологии (табл. 8) [3, 21–34].
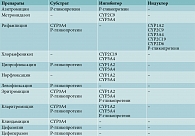
При проведении любой терапии, в том числе антимикробной, необходимо учитывать фармакокинетические характеристики применяемых препаратов и возможность межлекарственного взаимодействия с участием цитохрома Р450 и Р-гликопротеина (табл. 9) [35, 36]. Для некоторых АМП изоферменты цитохрома Р450 служат субстратом и сами способны либо ингибировать, либо индуцировать те же изоферменты. В кишечнике Р-гликопротеин выполняет роль насоса, отвечающего за эффлюкс (выброс) лекарственных препаратов в просвет кишечника, в почках и желчных путях способствует их экскреции. Ингибиторы Р-гликопротеина при их совместном применении с препаратами – субстратами этого белка усиливают всасывание, ограничивают распределение и замедляют экскрецию последних, что приводит к увеличению плазменных концентраций. Обратный эффект оказывают индукторы Р-гликопротеина. Ингибирование микросомальных ферментов и Р-гликопротеина обычно носит конкурентный характер и является дозозависимым быстро развивающимся (практически после первого приема ингибитора) процессом. Поэтому ошибочно полагать, что короткий курс приема АМП позволит избежать межлекарственного взаимодействия. Для предотвращения НПР, обусловленных межлекарственным взаимодействием, необходимо уменьшить дозу метаболизируемого лекарственного средства либо увеличить интервал его введения. Прогнозирование межлекарственного взаимодействия АМП с другими лекарственными средствами клинически значимо, особенно у пациентов с сопутствующей патологией, нуждающихся в терапии антикоагулянтами, приеме сердечных гликозидов, ингибиторов протонной помпы, противоопухолевых, психотропных, противогрибковых препаратов и т.д. [37, 38].
Необходимо учитывать, что одновременное применение макролидов и антикоагулянтов (варфарина) способно увеличить риск кровотечения (ингибирующее влияние макролидов на CYP3A4). Эти же механизмы действуют и в отношении новых пероральных антикоагулянтов. Ингибирующее влияние макролидов на Р-гликопротеин приводит к увеличению концентрации дигоксина.
Еще один пример – рифампицин, который хорошо известен как мощный индуктор большинства цитохромов, ответственных за метаболизм лекарственных средств.
Участниками межлекарственного взаимодействия с не меньшим потенциалом активности, чем у синтезированных лекарственных препаратов, являются некоторые растения (зверобой продырявленный, гинкго билоба, эхинацея, женьшень). При одновременном применении дигоксина и экстракта зверобоя продырявленного – индуктора Р-гликопротеина отмечается снижение концентрации препарата [39]. Кроме того, зверобой индуцирует CYP3A. Было показано клинически значимое снижение концентрации мидазолама на фоне приема зверобоя [40] и уменьшение концентрации этинилэстрадиола и дезогестрела, содержащихся в пероральных контрацептивах [34].
Информация о межлекарственном взаимодействии представлена в специальных справочниках, а также на интернет-ресурсах [35, 36].
Исследование межлекарственного взаимодействия левофлоксацина и сухого экстракта травы зверобоя
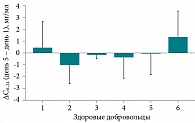
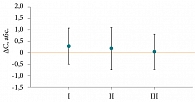
Нами проведено фармакокинетическое исследование концентрации воспроизведенного левофлоксацина. Исследование одобрено локальным этическим комитетом Городской клинической больницы им. И.В. Давыдовского. Исследование выполнено в два этапа. На первом этапе у добровольцев (шесть пациентов) изучали фармакокинетику левофлоксацина 500 мг, назначавшегося до и после восьмидневного приема сухого экстракта зверобоя. На втором этапе фармакокинетическое исследование левофлоксацина проводилось у десяти пациентов (средний возраст – 42 ± 14,2 года) с клинико-рентгенологической картиной ВП нетяжелого течения в первые сутки пребывания в стационаре и в конце лечения. Участники исследования были разделены на две группы. Пациенты первой группы получали только левофлоксацин 500 мг/сут, пациенты второй – левофлоксацин 500 мг/сут в сочетании с сухим экстрактом зверобоя продырявленного 850 мг/сут. Продолжительность исследования составила восемь дней. Сухой экстракт зверобоя назначали по поводу субклинической депрессии. Концентрацию левофлоксацина в плазме крови определяли методом высокоэффективной жидкостной хроматографии. Разрешение ВП было достигнуто в одинаковые сроки у всех пациентов. Осложнений ВП, НПР, необходимости в смене АМП не наблюдалось. Для оценки статистических различий средних значений двух и более независимых или зависимых выборок использовали критерий Стьюдента (t-test) или его парный аналог с предварительной оценкой нормальности распределения выборочных значений с помощью критерия Шапиро – Вилка. Для выборок с ненормальным распределением использовали непараметрический критерий суммы рангов Манна – Уитни или U-test (в качестве двухвыборочного критерия для независимых выборок), а также критерий знаков и критерий Вилкоксона для анализа двух зависимых выборок (критерий Фридмана для трех и более выборок). Обработку, моделирование и визуализацию экспериментальных данных проводили с помощью статистических программ Statgraphics Centurion и SigmaPlot.
Обсуждение
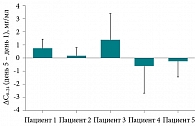
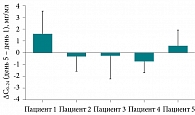
Проведенный анализ данных продемонстрировал, что индивидуальные различия в изменении среднесуточных концентраций левофлоксацина несущественны на фоне приема сухого экстракта зверобоя, как и при использовании левофлоксацина (р > 0,05). Межгрупповые различия также не достигли статистической значимости (рис. 2–5).
Таким образом, у добровольцев и пациентов с ВП прием сухого экстракта зверобоя не влиял на фармакокинетику антибиотика. Это очень важный вывод, особенно при наличии свидетельств, демонстрирующих, что левофлоксацин является субстратом для Р-гликопротеина и в условиях индукции гиперецином, содержащимся в зверобое, следует ожидать снижения фармакокинетических параметров антибиотика [41].
Полученные данные не могут быть экстраполированы на весь класс фторхинолонов, поскольку некоторые представители данной группы характеризуются более выраженной зависимостью фармакокинетических параметров от метаболизма по сравнению с левофлоксацином. Необходимо также отметить, что зверобой – безрецептурный препарат для терапии легкой депрессии, применяемый практически во всех странах мира. Сухой экстракт зверобоя представлен на фармацевтическом рынке не только в качестве лекарственного средства, но и в качестве биологически активной добавки. В инструкции по применению может отсутствовать информация о риске межлекарственного взаимодействия.
Заключение
Во всех рекомендациях упоминаются клинические ситуации, когда изменяется обычный спектр возбудителей пневмонии и возникает необходимость модификации подходов к эмпирической терапии. С учетом ряда факторов (локальные особенности микробного пейзажа, тяжесть инфекционного процесса, наличие или отсутствие коморбидности) антибиотик можно назначать более прицельно. Стратификация по факторам риска считается наиболее рациональной с микробиологической и клинической точек зрения. Назначая любой лекарственный препарат, в том числе антибиотик, важно учитывать клинически значимое межлекарственное взаимодействие, которое может стать причиной развития НПР и полностью нивелировать ожидаемый терапевтический эффект.
D.V. Tsiganko, N.G. Berdnikova, PhD, L.M. Krasnikh, V.A. Menshov, S.N. Politkina, Yu.A. Antonovsky
City Clinical Hospital I.V. Davidovsky, Moscow
I.M. Sechenov First Moscow State Medical University
Scientific Centre for Expert Evaluation of Medicinal Products
N.M. Emanuel Institute of Biochemical Physics RAS
Contact person: Nadezhda G. Berdnikova, berdnad@mail.ru
In clinical practice, the physicians in the treatment of infectious diseases use clinical guidelines. Unfortunately, them don’t some account take some factors that influence the choice of antimicrobial drug in a particular event. It is necessary to account the regional and local characteristics of the microbiological characteristics, allergies, age and associated diseases, and taken medications. Polyparmacy and drug interactions can be the cause of iatrogeny, the development of side effects and loss of the clinical efficacy of therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.