Неврологические проявления дефицита витамина В12
- Аннотация
- Статья
- Ссылки
- English
Витамин B12 – водорастворимый витамин, который в природе вырабатывается микроорганизмами, а в организме человека не синтезируется. Средняя суточная потребность в витамине B12 составляет 2,4 мкг для мужчин и небеременных женщин, 2,6 мкг для беременных, 2,8 мкг – для кормящих [1].
Основной источник витамина B12 – белки животного происхождения (мясо, печень, почки, рыба, молочные продукты, яичные желтки). Запасы витамина В12 в организме взрослого человека составляют примерно 2000–5000 мкг. Витамин B12 депонируется в основном в печени (1 мкг в 1 г ткани печени), в меньшем количестве – в почках и скелетных мышцах. В12 выделяется с желчью и калом, в сутки теряется 0,1% общего количества депонированного витамина. Существует кишечно-печеночный кругооборот витамина В12 – около 3/4 выделенного с желчью витамина вновь реабсорбируется в кишечнике через систему воротной вены печени (энтерогепатическая циркуляция). Этим объясняется развитие клинических проявлений дефицита В12 через 1–3 года после полного прекращения его поступления в организм [2].
В продуктах питания В12 обычно содержится в форме кофермента дезоксиаденозилкобаламина или метилкобаламина и связан с белками. На первом этапе метаболизма витамина В12 происходит его протеолиз в желудке при низком pH, в результате чего он высвобождается из пищевого белка и связывается с белком R желудочного сока. Париетальные клетки желудка вырабатывают внутренний фактор Касла – гликопротеид, который вместе с белковым комплексом «кобаламин – R» поступает в двенадцатиперстную кишку. Комплекс внутреннего фактора Касла и кобаламина в подвздошной кишке связывается с рецепторами внутреннего фактора кобаламина, расположенными на микроворсинках клеток слизистой оболочки подвздошной кишки. При нейтральном рН и в присутствии ионов кальция комплекс «кобаламин – фактор Касла» распадется, кобаламин попадает в энтероцит, переносится на транскобаламин II (голотранскобаламин) и в комплексе с ним попадает в кровоток. При наличии большого количества витамина В12 около 1% может проникать в кровь за счет пассивной диффузии [1, 2].
B12 участвует во многих ключевых процессах метаболизма липидов, углеводов и белков, играет центральную роль в гемопоэзе. В организме человека витамин В12 служит кофактором для работы двух ферментов – метилмалонил-коэнзим A (CoA)-мутазы в митохондриях и метионинсинтетазы (MeCbl) в цитоплазме. Витамин В12 участвует в синтезе нуклеиновых кислот: связанный с MeCbl, он облегчает удаление метильной группы из метилфолата с образованием гомоцистеина (HCYS), который превращается в метионин. Витамин B12 необходим для клеточного дыхания и поддержания энергии, поскольку задействован в цикле Кребса. B12 участвует в процессах миелинизации и нормального формирования нервной трубки на этапе эмбриогенеза, синтезе нуклеиновых кислот, белковых и липидных структур миелиновой оболочки нервного волокна, холина и нейротрансмиттеров [2, 3].
Причины развития дефицита витамина В12
Причин развития дефицита витамина В12 много. Их можно разделить на несколько групп.
Недостаточное поступление витамина В12 с пищей
К дефициту В12 может привести недостаточное употребление белков животного происхождения в силу различных причин (пожилой возраст, низкий социальный статус, в частности у лиц, страдающих хроническим алкоголизмом). Большинство вегетарианцев получают только 0,25–0,5 мкг кобаламина в день. Не случайно распространенность дефицита витамина B12 среди них достигает 40–80% [3].
Нарушение всасывания и метаболизма витамина В12 в желудочно-кишечном тракте
Подобные состояния имеют место у пациентов после операций на желудке или тонком кишечнике, в том числе после бариатрических операций по поводу патологического ожирения, лиц, страдающих атрофическим гастритом (чаще пожилых людей), пациентов с заболеваниями тонкой кишки, недостаточностью поджелудочной железы и синдромом мальабсорбции, целиакией, глистными инвазиями, дивертикулярной болезнью. Дефицит В12 нередко развивается при ожоговой болезни или тяжелых травмах на фоне заместительной почечной терапии, а также при хроническом воздействии токсигенной плесени и микотоксинов (чаще встречаются в поврежденных водой зданиях). К нарушению всасывания и метаболизма витамина В12 могут приводить генетические дефекты, при которых нарушается синтез переносчиков кобаламина [2, 4].
Повышенная потребность в витамине В12
Беременные, кормящие женщины, дети раннего возраста, пациенты с ВИЧ/СПИДом, гемолитической анемией испытывают повышенную потребность в витамине B12.
Снижение содержания витамина B12 относится к этиологическим факторам ряда врожденных пороков. Речь прежде всего идет о дефектах формирования нервной трубки.
Низкие концентрации витамина В12 (< 148 пмоль/л) в крови беременной считаются фактором риска невынашивания беременности и преждевременных родов [2, 3].
Побочное действие ряда лекарственных препаратов и химических веществ
Развитие дефицита витамина B12 ассоциируется с применением ингибиторов протонной помпы и Н2-блокаторов, снижающих кислотность желудочного сока, метформина, леводопы, ингибиторов ангиотензинпревращающего фермента, колхицина, холестирамина, закиси азота [5–7].
Клинические проявления дефицита витамина B12
К основным клиническим проявлениям дефицита витамина В12 относятся мегалобластная анемия и поражение нервной системы, обусловленные демиелинизацией в веществе головного и спинного мозга, а также периферических нервах.
Мегалобластная анемия
Мегалобластная анемия – заболевание, характеризующееся наличием в костном мозге и периферической крови мегалобластов (измененные эритробласты, свойственные эмбриональному типу кроветворения). Частота встречаемости заболевания у взрослых 2:10 000, чаще наблюдается у женщин в возрасте старше 60 лет.
Дефицит витамина В12 и фолиевой кислоты – основная причина развития мегалобластной анемии. Классическая пернициозная (злокачественная) анемия чаще встречается у пожилых людей и обусловлена образованием антител к H+, K+-ATФазе париетальных клеток желудка, в результате чего снижаются выработка внутреннего фактора Касла и всасывание витамина В12. При этом четкая корреляция между уровнем витамина В12 в крови, наличием и степенью тяжести анемии отсутствует.
При дефиците B12 фермент метионинсинтетаза становится неактивным, нарушается синтез нуклеиновых кислот, ДНК, в меньшей степени РНК и белка. Сбой в делении клеток приводит к росту клетки без деления, что проявляется макроцитозом. В мазке периферической крови обнаруживаются гиперсегментированные нейтрофилы, «осколки» ядер в эритроцитах (тельца Жолли и кольца Кебота) и гиперхромия эритроцитов. Измененные эритроциты быстро разрушаются ретикулоэндотелиальной системой (экстрамедуллярный гемолиз), что приводит к развитию анемии, тромбоцитопении или панцитопении [2, 8, 9].
В12-дефицитное состояние может стать причиной поражения как центральной, так и периферической нервной системы. Примерно в 15% случаев неврологические нарушения не сопровождаются характерными гематологическими изменениями [10, 11].
Поражение головного мозга
Разрушение миелина при дефиците витамина В12 происходит в белом веществе головного мозга. При этом имеют место разнообразные клинические проявления энцефалопатии.
Во многих случаях дефицит витамина В12 дебютирует психоэмоциональными нарушениями (утомляемость, сонливость, апатия, депрессия, эмоциональная лабильность, агрессивность, зрительные и слуховые галлюцинации, острые психотические реакции). Очаговые изменения белого вещества, обычно выявляемые в лобных и теменных долях головного мозга, мозолистом теле, могут приводить к снижению памяти и нарушению высших мозговых функций вплоть до развития деменции [10, 11]. Когнитивные нарушения, достигающие степени деменции, отмечаются у 4–16% пациентов со злокачественной анемией [11].
Среди научных трудов последних лет можно найти множество публикаций, посвященных изучению деменции и потенциальной роли в ее патогенезе гомоцистеина, фолиевой кислоты и витамина В12.
Деменция, обусловленная дефицитом витамина В12, не имеет специфических клинических проявлений. В большинстве случаев отмечается быстрое прогрессирование когнитивных нарушений с преходящими эпизодами спутанности сознания, деменция сопровождается эмоциональными нарушениями, в основном депрессией. Редко регистрируются стволовые и мозжечковые расстройства [11–13].
В ряде случаев при обследовании пациентов с когнитивными и психическими нарушениями, предположительно развившимися на фоне дефицита витамина В12, в цереброспинальной жидкости регистрируется незначительное увеличение уровня белка. На электроэнцефалограмме может выявляться диффузная медленноволновая активность, на магнитно-резонансной томограмме – атрофия вещества больших полушарий, очаговые изменения в белом веществе – чаще полушарий, реже ствола головного мозга и мозжечка [11, 14].
Данные о возможной обратимости когнитивных нарушений, связанных с дефицитом витамина В12, различны. В литературе описаны случаи практически полного восстановления когнитивных функций и регресса эмоциональных нарушений (депрессии) при негрубой выраженности дефекта и продолжительности заболевания не более года. Вместе с тем в ряде случаев даже нормализация уровня витамина В12 в крови не улучшает когнитивных функций. Как правило, это наблюдается при значительной продолжительности заболевания, наличии нейродегенеративного заболевания (болезнь Альцгеймера и др.) [11, 15].
В настоящее время установлено, что дефицит В12 можно считать одним из факторов риска развития острой цереброваскулярной и сердечно-сосудистой патологии атеротромботического генеза. Метаболизм витамина В12 тесно связан с метаболизмом аминокислоты гомоцистеина. Дефицит В12 и фолиевой кислоты является основным фактором риска развития приобретенной гипергомоцистеинемии [16].
За последние годы было проведено множество исследований, результаты которых подтвердили, что гипергомоцистеинемия служит независимым фактором риска венозного тромбоза и ассоциируется с более быстрым прогрессированием атеросклеротического поражения крупных артерий, а значит, с повышением риска ишемического инсульта [17, 18].
При проведении магнитно-резонансной томографии (МРТ) головного мозга у пациентов с повышенным уровнем гомоцистеина в сыворотке крови выявляются более значительная церебральная атрофия и атрофия гиппокампа [11, 14].
В ряде исследований показано, что гипергомоцистеинемия увеличивает риск развития как сосудистой деменции, так и болезни Альцгеймера, что может свидетельствовать об общих патогенетических механизмах данных заболеваний.
В основе развития когнитивных нарушений при гипергомоцистеинемии лежит несколько патологических процессов: церебральная микроангиопатия, эндотелиальная дисфункция, окислительный стресс, увеличение нейротоксичности бета-амилоида и апоптоз [11].
В литературе также обсуждается роль дефицита витаминов группы В, фолиевой кислоты и гипергомоцистеинемии в патогенезе самой частой болезни движения – болезни Паркинсона.
Согласно результатам исследования LiangShen, уровень витамина В12 у пациентов с болезнью Паркинсона достоверно ниже, чем у пациентов контрольной группы. При этом доказательств, что употребление в пищу добавок, содержащих витамин В12 и фолиевую кислоту, способно снизить риск развития болезни Паркинсона, не получено. В отношении витамина В6 имеется противоположная информация: употребление в пищу более высоких концентраций витамина В6 может ассоциироваться со снижением риска развития болезни Паркинсона. Предполагается, что витамин В6 снижает подобный риск не за счет влияния на метаболизм гомоцистеина, а за счет уменьшения окислительного стресса. Между тем для проверки этой гипотезы и уточнения патогенетических механизмов протективного эффекта витамина В6 в отношении риска развития болезни Паркинсона требуются дополнительные исследования.
В ряде исследований показано, что B12 ингибирует фибриллогенез альфа-синуклеина и модулирует работу фермента киназы 2 (LRRK2), участвующего в патогенезе болезни Паркинсона [5].
Кроме того, в ряде исследований продемонстрирована высокая частота развития полинейропатического синдрома у пациентов с болезнью Паркинсона. Согласно данным литературы, его частота варьируется от 19 до 55%, в то время как у здоровых лиц, сопоставимых по возрасту, полинейропатия развивается только в 8–9% случаев. Поражение периферических нервов при болезни Паркинсона проявляется преимущественно аксональной сенсорно-моторной полинейропатией. Степень тяжести коррелирует со стадией заболевания по шкале Hoehn – Yahr.
Учитывая приведенные данные о риске развития дефицита витамина В12 у пациентов, получающих лечение леводопой, можно предположить, что более высокая распространенность полинейропатии у пациентов с болезнью Паркинсона обусловлена именно дефицитом витамина В12 [5].
Подострая комбинированная дегенерация спинного мозга (фуникулярный миелоз)
Дефицит витамина B12 приводит к поражению вещества спинного мозга с развитием клинической картины фуникулярного миелоза. Поражение миелина связано с токсическим действием метилмалоновой кислоты, образуемой при распаде жирных кислот и некоторых аминокислот. При дефиците витамина В12 нарушается работа фермента метилмалонил-КоА-мутазы, разрушающей метилмалоновую кислоту, происходят ее накопление, ацидоз с последующим повреждением миелиновой оболочки и вторичной аксонопатией, главным образом нервных волокон задних столбов и боковых канатиков спинного мозга. Кроме того, демиелинизация может быть обусловлена нарушением синтеза холина, лецитина и сфингомиелина из-за недостатка метионина при дефиците В12, встраиванием в миелиновую оболочку аномальных жирных кислот [2, 19, 20].
Выделяют три формы фуникулярного миелоза: заднестолбовую (в основном поражаются задние канатики), пирамидную (преимущественно поражаются боковые столбы) и комбинированную (сочетанное поражение боковых и задних столбов).
Заболевание может начинаться с появления неспецифических жалоб, обусловленных развитием анемии. Пациенты могут жаловаться на покалывание и изменение цвета языка (ярко-малиновый, «лакированный»). Позже присоединяются парестезии в конечностях в виде ощущения ползания мурашек, покалывания, жжения, более выраженные в пальцах ног, затем двигательные нарушения (преимущественно слабость в ногах) и сенситивная атаксия. Парезы в ногах могут носить спастический, вялый или смешанный характер в зависимости от степени вовлечения пирамидных путей в боковых канатиках спинного мозга. Верхние конечности поражаются значительно реже и в меньшей степени. Часто встречается симптом Лермитта – ощущение прохождения электрического тока сверху вниз по спине при наклоне головы вперед из-за поражения задних канатиков спинного мозга. Чувствительным и двигательным расстройствам нередко сопутствуют нарушения функций тазовых органов (императивные позывы на мочеиспускание или задержка мочеиспускания).
В литературе описано как медленное, так и быстрое прогрессирование фуникулярного миелоза, при котором в течение двух-трех недель может сформироваться картина поперечного миелита с нижней параплегией и тазовыми расстройствами [2, 20].
Диагноз фуникулярного миелоза не вызывает затруднений при наличии клинической картины поражения задних и боковых канатиков спинного мозга в сочетании с макроцитарной анемией. Но иногда тяжелые неврологические нарушения развиваются и при нормальном уровне гемоглобина и отсутствии гематологических лабораторных изменений. Кроме того, вследствие широкого применения препаратов витаминов группы В фуникулярный миелоз часто протекает с атипичной клинической картиной. Диагноз подтверждается результатами исследования концентрации витамина В12 в крови с выявлением его дефицита, повышением уровня гомоцистеина и метилмалоновой кислоты в крови, стернальной пункцией с исследованием микроскопической картины костного мозга, а также МРТ, главным образом шейного и грудного отделов позвоночника, в ходе которой выявлен гиперинтенсивный сигнал на Т2-взвешенных изображениях от задних и боковых столбов спинного мозга [19].
На прогноз заболевания влияет продолжительность периода проявления неврологических симптомов до начала лечения независимо от наличия и тяжести анемии. При начале лечения через несколько недель или месяцев после появления симптомов поражения спинного мозга можно ожидать значительного улучшения состояния больных или даже полного регресса неврологической симптоматики. На поздних стадиях болезни удается лишь незначительно улучшить или стабилизировать процесс [19, 20].
Поражение периферической нервной системы
Кроме поражения головного и спинного мозга, дефицит витамина В12 часто сопровождается поражением периферической нервной системы, что обычно проявляется дистальной сенсорной полинейропатией. Полинейропатия носит смешанный характер (аксонопатия и миелинопатия). Клиническая картина В12-дефицитной полинейропатии неспецифична: одними из первых возникают парестезии в конечностях (обычно в ногах), затем присоединяются нарушение болевой и температурной чувствительности по типу «перчаток и носков», ослабление вибрационной чувствительности, выпадение ахилловых рефлексов, неустойчивость при ходьбе. Нередко B12-дефицитная полинейропатия сочетается с фуникулярным миелозом.
Примерно в 5% случаев при дефиците витамина В12 наблюдается атрофия зрительных нервов с появлением центральных скотом и снижением остроты зрения. Миоз при сохраненных зрачковых реакциях встречается редко. Иногда имеют место нарушения вкуса и обоняния. В ряде случаев поражается вегетативная нервная система, что сопровождается ортостатической гипотензией и обмороками, импотенцией, недержанием кала и мочи, учащенными позывами к мочеиспусканию.
В большинстве случаев для поражения периферической нервной системы характерно медленно прогрессирующее на протяжении недель или месяцев течение [11, 21].
Диагностика дефицита витамина В12
При неврологических заболеваниях, обусловленных дефицитом витамина В12, чрезвычайно важны ранняя диагностика дефицитарного состояния и соответственно раннее начало этиотропной и патогенетической терапии. Только при начале лечения на ранних стадиях неврологический дефицит может быть предотвращен.
Как уже отмечалось, диагноз дефицита витамина В12 основан на клинической картине и результатах лабораторного исследования. Некоторые симптомы дефицита витамина В12 можно распознать при внешнем осмотре пациента. Речь идет об акрогипергидрозе, глоссите Хантера («лакированном» языке), стоматите, хейлите, ксеростомии, гипопигментации и витилиго, а также гиперпигментации в местах сгибов конечностей, на подошвах и ладонях [2, 22].
При лабораторном обследовании в типичных случаях в общем анализе крови обнаруживаются панцитопения и макроцитарная анемия, а при исследовании пунктата костного мозга – мегалобластное кроветворение. Однако неврологическая симптоматика может опережать развитие мегалобластной анемии и не сопровождаться отклонениями в анализе крови [22, 23].
В последние годы появилась возможность количественного определения уровня витамина В12 в сыворотке крови. У пациента с клиническими и лабораторными признаками, соответствующими дефициту витамина B12, измерение общего уровня витамина B12 в плазме методом хемилюминесценции считается тестом первой линии. При дефиците витамина B12 (менее 148 пмоль/л) чувствительность метода достигает 90–95%, специфичность – 80%. При субклиническом дефиците (менее 220 пмоль/л) чувствительность метода варьируется от 40 до 80% [23, 24].
В настоящее время комбинированные препараты витаминов группы В в нашей стране весьма популярны и назначаются многим больным. На этом фоне лабораторно обнаружить дефицит цианокобаламина сложно. К более чувствительным лабораторным признакам В12-дефицита относятся повышенные уровни суррогатных маркеров дефицита витамина В12: метилмалоновой кислоты (ММК) и общего HCYS. Дефицит витамина B12 ассоциируется с повышенными концентрациями в плазме HCYS > 12 мкмоль/л и MMК > 0,4 мкмоль/л. Однако ориентироваться только на эти показатели не следует, поскольку повышенный уровень HCYS имеет место при дефиците фолатов, витамина В6, гипотиреозе, а повышенный уровень ММК – при печеночной и почечной недостаточности [22, 24].
Еще одним методом диагностики дефицита В12 является определение уровня холотранскобаламина в сыворотке крови. В норме концентрация холотранскобаламина составляет от 19–42 до 134–157 пмоль/л. К преимуществу метода определения концентрации холотранскобаламина относится то, что его уровень в крови достаточно стабилен и практически не подвержен колебаниям при различных физиологических состояниях организма (беременность, прием некоторых лекарственных препаратов) [22].
Таким образом, на текущий момент золотого стандарта лабораторной диагностики дефицита витамина В12 не существует. Для точной постановки диагноза его дефицита необходима комплексная оценка клинических проявлений и лабораторных данных (общий уровень В12 в плазме и ликворе, уровень сывороточного холотранскобаламина, гомоцистеина и ММК).
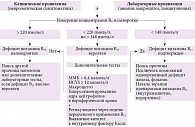
На рисунке представлен возможный алгоритм диагностики дефицита витамина В12 у взрослых [25].
Терапия неврологических проявлений дефицита витамина В12
Целями терапии В12-дефицитных состояний являются нормализация лабораторных показателей крови и постепенный регресс неврологического дефицита. Одновременно с медикаментозным восполнением дефицита витамина В12 необходимы обследование, тщательный сбор анамнеза для выявления причины развития дефицитарного состояния и ее устранения или коррекции. Прогноз функционального восстановления зависит от исходной степени поражения нервной системы: при легких нарушениях и раннем начале лечения возможно полное или практически полное восстановление, при более тяжелых остаточный неврологический дефицит неизбежен.
Пациенты с доказанным дефицитом витамина В12 могут получать терапию в виде пероральных форм витамина, а также парентерально (главным образом внутримышечно), что зависит от тяжести неврологических проявлений, остроты развития заболевания и причины дефицита.
Как правило, пациентам в отсутствие нарушений всасывания в желудочно-кишечном тракте (ЖКТ) в случае постепенного развития неврологического дефекта и легкой или средней тяжести его выраженности показан прием пероральных препаратов, содержащих 1 мг кобаламина, ежедневно. При тяжелой степени неврологического дефекта и остром развитии заболевания, а также при состояниях, потенциально способных нарушать всасывание витамина В12 в ЖКТ, целесообразно начинать терапию с парентеральных форм витамина и его внутримышечного введения в дозе 1 мг [26, 27].
Единого мнения об оптимальных дозах витамина В12, направленных на коррекцию неврологических и гематологических проявлений дефицита, не существует.
В исследовании сравнивали эффективность лечения различными дозами перорального витамина B12 у пожилых больных с дефицитом В12. Установлено, что оптимальная доза перорального витамина B12, необходимая для снижения уровня ММК на 80–90%, составляет 647–1032 мкг/сут [28].
Начальные схемы лечения и продолжительность витаминотерапии в разных исследованиях, медицинских учреждениях и странах различаются.
Одна из предлагаемых схем лечения предполагает внутримышечные инъекции кобаламина – 8–10 инъекций в течение двух месяцев с последующими ежемесячными инъекциями по 1 мг препарата. Другие схемы включают пероральное введение кобаламина ежедневно в течение десяти дней, затем еженедельно в течение четырех недель с последующим ежемесячным приемом препарата внутрь. Британский национальный формуляр рекомендует использовать 1 мг витамина B12 внутримышечно три раза в неделю в течение двух недель, а затем один раз каждые три месяца для пациентов с мегалобластной анемией без неврологических синдромов. При наличии неврологических симптомов целесообразно внутримышечное введение 1 мг В12 через день в течение трех недель. Лечение может быть продолжено в зависимости от клинической ситуации. Пациентам с дефицитом витамина В12, причины которого невозможно устранить, как правило, требуется пожизненное лечение для предотвращения рецидива заболевания [26].
В руководстве по гематологии [27] для лечения В12-дефицитной анемии предложена следующая схема: цианокобаламин 1000 мкг внутримышечно ежедневно в течение 4–6 недель, после нормализации показателей крови 1000 мкг внутримышечно один раз в неделю, затем пожизненно 1000 мкг один раз в месяц, если устранить причину дефицита витамина В12 невозможно. Подобная схема применима и при тяжелых неврологических нарушениях, обусловленных дефицитом витамина В12. Пациенты, получающие лечение по поводу дефицита витамина B12, каждые несколько месяцев проходят лабораторный контроль уровня гемоглобина и витамина В12 [27].
При приеме цианокобаламина перорально в высоких дозах (1000–2000 мкг) возможно пассивное (за счет диффузии) всасывание 1% потребляемой дозы. В ряде исследований показано, что прием препаратов витамина В12 внутрь в высоких дозах по эффективности не уступает внутримышечному введению [24, 28]. В руководстве по гематологии также предложена альтернативная внутримышечному введению витамина В12 схема лечения: ежедневный прием препарата в дозе 2000–4000 мкг в течение 4–6 недель, затем 1000 мкг цианокобаламина один раз в месяц пожизненно [27].
В России единственной лечебной формой витамина В12 является цианокобаламин, который входит в состав комбинированных поливитаминных препаратов в таблетированной форме в дозах 200–500 мкг. Неинъекционных средств для специфического лечения дефицита витамина В12 в настоящее время нет.
Среди препаратов, содержащих витамин В12, следует отметить Нейробион (Австрия), который более 50 лет применяется в разных странах для лечения пациентов с заболеваниями нервной системы. Нейробион представляет собой комбинацию нейротропных витаминов: тиамина (витамин В1), цианокобаламина (витамин В12) и пиридоксина (витамин В6). Препарат выпускается в двух лекарственных формах – пероральной (таблетки) и парентеральной (раствор для инъекций). Одна таблетка Нейробиона содержит тиамина дисульфид 100 мг, пиридоксина гидрохлорид 200 мг и цианокобаламин 240 мкг. Одна ампула Нейробиона также содержит три витамина группы B: тиамин 100 мг, пиридоксин 100 мг и цианокобаламин 1 мг.
Как правило, лечение тяжелых форм поражения центральной и периферической нервной систем начинается с парентерального введения комплекса витаминов группы В. Инъекции Нейробиона проводят глубоко внутримышечно по 3 мл (одна ампула) один раз в сутки в течение десяти дней. Затем в качестве поддерживающей терапии Нейробион применяется в таблетированной форме. Стандартный лечебный курс для взрослых и детей старше 15 лет предполагает прием одной таблетки три раза в сутки на протяжении 1–3 месяцев в зависимости от тяжести клинических проявлений [29].
Пациенты с неврологическими нарушениями, обусловленными дефицитом витамина В12, помимо восполнения его дефицита в зависимости от конкретной патологии нуждаются в ноотропной и метаболической терапии, антиоксидантах (препараты альфа-липоевой кислоты). Им также назначаются реабилитационные мероприятия (массаж, лечебная физкультура, физиопроцедуры). Описана эффективность ритмической транскраниальной магнитной стимуляции при поражении спинного мозга на фоне фуникулярного миелоза [20].
Заключение
Скорее всего распространенность дефицита витамина В12 в популяции значительно выше, чем принято считать. Это обусловлено увеличением продолжительности жизни и соответственно доли лиц пожилого и старческого возраста, высокой популярностью различных видов диет и вегетарианства, широким применением препаратов, способных нарушать всасывание и метаболизм витамина В12, и рядом других причин. Клинические проявления дефицита витамина В12 весьма разнообразны и включают в себя широкий спектр нарушений – от классической макроцитарной анемии до выраженных когнитивных и психических расстройств. Из-за отсутствия четких схем диагностики и недоступности в ряде случаев лабораторных исследований дефицит витамина В12 часто остается недиагностированным.
Ранняя диагностика неврологических проявлений дефицита витамина В12 и своевременное начало терапии крайне важны, поскольку позволяют сделать процесс неврологического дефицита обратимым.
Таким образом, проблема дефицита В12 требует дальнейшего изучения. Необходимо разработать четкие алгоритмы диагностики и лечения данной патологии.
O.Ye. Zinovyeva, PhD, Prof., A.Yu. Yemelyanova, A.I. Kozhev, A.A. Olkhovskaya, M.D. Nikolayev
I.M. Sechenov First Moscow State Medical University
Central District Hospital, Ramenskoye
Contact person: Olga Ye. Zinovyeva, zinovyevaolga@yandex.ru
Based on the analysis of domestic and foreign literature, the prevalence in the population and the reasons for the development of vitamin B12 deficiency, pathogenetic mechanisms and clinical manifestations of the pathology of the nervous system caused by B12 deficiency are considered. The most informative diagnostic methods and treatment regimens for neurological disorders in vitamin B12 deficiency are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.