Новое в терапии меланомы кожи: обзор материалов конференций 2017 г.
- Аннотация
- Статья
- Ссылки
- English
1 Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015.
2 Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 году. М.: МНИОИ
им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2016.
1 Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015.
2 Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 году. М.: МНИОИ
им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2016.



Адъювантная терапия
Основной задачей адъювантной терапии является снижение риска прогрессирования заболевания и летального исхода у пациентов, перенесших радикальное хирургическое лечение. Долгое время адъювантная терапия меланомы кожи (МК) высокого риска на основе препаратов рекомбинантного интерферона (ИФН) альфа оставалась единственным методом, позволявшим увеличивать медиану выживаемости без прогрессирования (ВБП).
Арсенал лекарственных средств при метастатической МК (мМК) расширился за счет BRAF- и MEK-ингибиторов (таргетная терапия), а также анти-CTLA4- и анти-PD1-моноклональных антител (иммуноонкологическая терапия). Препараты таргетной и иммуноонкологической терапии способны увеличивать общую выживаемость (ОВ). Не случайно эти два терапевтических направления рассматриваются в качестве возможных опций для адъювантного лечения больных МК высокого риска.
Первые результаты исследования BRIM8 были представлены на ежегодном конгрессе Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO). В рандомизированном двойном слепом плацебоконтролируемом исследовании пациенты с полностью удаленной меланомой кожи высокого риска с мутацией BRAF V600 в качестве адъювантной терапии получали вемурафениб. 498 участников исследования были рандомизированы на две группы. В первую вошли 314 пациентов со стадиями IIC, IIIA и IIIB, во вторую – 184 пациента со стадией IIIC. Пациенты обеих групп в соотношении 1:1 были разделены для получения вемурафениба или плацебо. Терапию вемурафенибом/плацебо пациенты получали в течение 52 недель (год лечения) либо до прогрессирования заболевания (если таковое случалось раньше) или непереносимости терапии. Авторы сделали следующие выводы:
- терапия вемурафенибом в течение года имеет преимущество (снижение риска на 46%) перед плацебо в отношении ВБП у пациентов с удаленной МК с мутацией BRAF V600 (стадии IIC–IIIB) (р = 0,001);
- у пациентов с МК стадии IIIC с мутацией BRAF V600 адъювантная терапия вемурафенибом увеличивает медиану ВБП по сравнению с плацебо (23,1 против 15,4 месяца), оказывает биологический эффект, но статистически незначимо снижает риск прогрессирования (95%-ный доверительный интервал (ДИ); относительный риск (ОР) 0,8; р = 0,2598);
- вемурафениб характеризуется переносимостью и управляемым профилем безопасности, аналогичным установленному в ходе предыдущих клинических исследований.
Наблюдение продолжается, данные общей выживаемости будут представлены позднее [1].
В рандомизированном двойном слепом исследовании COMBI-AD сравнивали комбинацию дабрафениба и траметиниба с плацебо в качестве адъювантной терапии у пациентов с полностью удаленной меланомой кожи высокого риска с мутацией BRAF V600. 870 участников исследования были рандомизированы на группу дабрафениба 150 мг внутрь два раза в день и траметиниба 2 мг внутрь ежедневно и группу плацебо. Лечение продолжалось 12 месяцев или до признаков прогрессирования (если таковое случалось раньше), непереносимости терапии или отказа от нее пациента. Основной целью исследования была оценка безрецидивной выживаемости (БРВ), вторичной – оценка общей выживаемости и токсичности. На момент проведения анализа минимальный срок наблюдения за больными составил 2,5 года. По мнению авторов, комбинированная терапия дабрафенибом и траметинибом достоверно снижает риск прогрессирования заболевания на 53% (95% ДИ; ОР 0,47; p < 0,001). В группе дабрафениба и траметиниба 12-месячная БРВ составила 88%, 24-месячная – 67%, 36-месячная – 58%, в группе плацебо – 56, 44 и 39% соответственно. Медиана БРВ не была достигнута в группе комбинированной терапии, в группе плацебо она составила 16,6 месяца. В группе дабрафениба и траметиниба 12-месячная ОВ составила 97%, 24-месячная – 91%, 36-месячная – 86%, в группе плацебо – 94, 83 и 77% соответственно (95% ДИ; ОР 0,574; р = 0,0006). Показано, что по сравнению с плацебо дабрафениб и траметиниб достоверно снижают риск рецидива заболевания у пациентов с МК стадии III с мутацией BRAF V600E/K (ОР БРВ 0,47; 95% ДИ 0,39–0,58; p < 0,001) после хирургического лечения. Причем такое преимущество в БРВ наблюдалось во всех подгруппах пациентов [2, 3].
В рандомизированном двойном слепом исследовании III фазы CA209-238/CheckMate-238 пациенты высокого риска после радикального хирургического лечения меланомы стадии IIIB/IIIC или IV получали иммуноонкологическую терапию (ипилимумаб vs ниволумаб). 906 пациентов были поровну рандомизированы на две группы:
- ниволумаба 3 мг/кг внутривенно каждые две недели и ипилимумаба/плацебо внутривенно четыре введения каждые три недели и далее каждые 12 недель с 24-й недели;
- ипилимумаба 10 мг/кг внутривенно каждые три недели четыре введения, далее каждые 12 недель с 24-й недели и ниволумаба/плацебо внутривенно каждые две недели.
Минимальный срок наблюдения составил 18 месяцев. Распределение пациентов по стадиям было следующим: 34% больных имели стадию IIIB, 47% – IIIC, 19% – стадию IV. Среднее количество введений ниволумаба – 24 (от 1 до 26), ипилимумаба – 4 (от 1 до 7). При этом запланированное годовое лечение завершили 61% пациентов. На момент анализа медиана ВБП не достигнута. 12- и 18-месячная БРВ в группе ниволумаба составила 70,5 и 66,4% соответственно, в группе ипилимумаба – 60,8 и 52,7%. При этом относительный риск прогрессирования или летального исхода снизился на 35% (ОР 0,65; p < 0,001). Эффективность ниволумаба и ипилимумаба была выше у пациентов с экспрессией PD-L1 (уровень экспрессии ≥ 5%). По сравнению с ипилимумабом ниволумаб снижал относительный риск прогрессирования заболевания и летального исхода у пациентов со стадией III и IV на 35 и 30% соответственно. Кроме того, по сравнению с ипилимумабом ниволумаб уменьшал относительный риск прогрессирования и летального исхода у больных с наличием и отсутствием мутации гена BRAF на 28 и 42% соответственно. Нежелательные явления отмечались у 96,9% пациентов группы ниволумаба и 98,5% – группы ипилимумаба. Частота нежелательных явлений 3–4-й степени составила 14,4% в группе ниволумаба и 45,9% в группе ипилимумаба. Из-за токсичности досрочно прекратили лечение 9,7% пациентов группы ниволумаба и 42,6% – группы ипилимумаба. Таким образом, несмотря на короткий период наблюдения, у больных меланомой стадий III/IV после радикального хирургического удаления ниволумаб в качестве адъювантной терапии был эффективнее ипилимумаба [4–6].
Как видим, новые препараты (ингибиторы BRAF/MEK и анти-PD1) исследовались у пациентов с различными стадиями и подстадиями. Например, монотерапия ингибитором BRAF вемурафенибом может быть эффективна у пациентов со стадией IIC заболевания. Комбинированная терапия анти-BRAF дабрафенибом и анти-MEK траметинибом эффективна у пациентов с заболеванием III стадии и наличием BRAF V600E/K-мутации независимо от подстадии. Обратите внимание: анти-PD1 ниволумаб эффективен у пациентов не только с III стадией заболевания, но и с IV стадией после радикального хирургического удаления метастатических образований. Ранее в подгруппе пациентов со стадией IV и полностью хирургически удаленными метастатическими образованиями эффективность адъювантной терапии не была доказана. Как правило, эти пациенты находились под динамическим наблюдением без лечения. В ряде случаев они могли получать адъювантную терапию препаратами ИФН в отсутствие убедительных данных о его эффективности в данной подгруппе.
Лечение метастатической меланомы кожи
Таргетная терапия
Необходимость проведения молекулярно-генетического исследования статуса гена BRAF для решения вопроса о тактике лечения пациентов с мМК сомнений не вызывает. При наличии мутации BRAF V600 возможно проведение таргетной терапии: монотерапии ингибитором BRAF (вемурафениб или дабрафениб) или комбинацией ингибиторов BRAF и MEK (дабрафениб плюс траметиниб и вемурафениб плюс кобиметиниб).
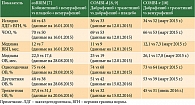
Наиболее интересные с точки зрения эффективности результаты были получены при использовании комбинированных режимов терапии: дабрафениб и траметиниб либо вемурафениб и кобиметиниб. В таблице 1 приведена информация о трех основных исследованиях III фазы: coBRIM (вемурафениб + кобиметиниб vs вемурафениб + плацебо), COMBI-d (дабрафениб + траметиниб vs дабрафениб), COMBI-v (дабрафениб + траметиниб vs вемурафениб) [7–10].
В исследовании COMBI-v 704 пациента были поровну рандомизированы в две группы – группу комбинированного режима дабрафениба и траметиниба (COMBI) и группу монотерапии вемурафенибом (v). Первичной целью данного исследования была оценка ВБП, вторичной – оценка частоты объективного ответа (ЧОО), длительности ответа (ДО), а также безопасности.
В исследование COMBI-d было включено 423 пациента: 212 составили группу дабрафениба (d), 211 – группу COMBI. Первичной целью была оценка ВБП исследователями, вторичной – оценка ОВ, ЧОО, ДО, безопасности.
В исследовании coBRIM участвовали 495 пациентов. В группу вемурафениба и плацебо вошли 248 пациентов, в группу вемурафениба и кобиметиниба – 247. Первичной целью исследования стала оценка ВБП исследователями, вторичной – оценка независимым комитетом ОВ, ЧОО, ДО, ВБП, а также безопасности и качества жизни.
Результаты, приведенные в табл. 1, не являются прямым сравнением, а лишь отражают данные, полученные в каждом исследовании.
Результаты исследований послужили основанием для регистрации комбинированных режимов таргетной терапии в мире. В России также все указанные комбинированные режимы зарегистрированы и доступны для применения. Эти режимы признаны оптимальными для лечения пациентов с BRAF-мутацией и включены в рекомендации 2016 г. Российского общества клинической онкологии по лечению меланомы (табл. 2) [11].
Эффективность таргетной терапии подтверждена и в ходе исследований II фазы с более длительным периодом наблюдения за пациентами, а также у пациентов с неблагоприятным прогнозом – метастазами в головном мозге. На конгрессе ASCO в 2017 г. была представлена обновленная информация о пятилетней ОВ пациентов с метастатической меланомой с мутацией BRAF V600, получавших комбинацию дабрафениба и траметиниба в открытом исследовании II фазы. Медиана наблюдения составила 66,5 месяца [12]. 54 пациента первой группы получали комбинацию дабрафениба 150 мг два раза в сутки per os и траметиниба 2 мг однократно per os. Из них 22 (41%) пациента имели исходно повышенный уровень лактатдегидрогеназы (ЛДГ), у 28 (52%) больных метастазы наблюдались в трех и более органах. При этом пятилетняя ОВ у всех пациентов данной группы составила 28% (95% ДИ 17–41). В группе пациентов с исходно нормальным уровнем ЛДГ и при наличии метастазов в трех и менее органах пятилетняя ОВ достигла 51% (95% ДИ 27–71). После прогрессирования заболевания на фоне применения комбинации дабрафениба и траметиниба 29 (54%) пациентов получили последующую терапию (химиотерапия, лучевая терапия, таргетная терапия, хирургическое вмешательство, биологическая терапия, иммунотерапия), причем девять пациентов принимали анти-PD1/PDL-1. На сегодняшний день это единственное исследование комбинированной терапии с таким длительным периодом наблюдения. Результаты исследования показали, что часть пациентов может получить долговременную пользу от комбинированной таргетной терапии при удовлетворительной переносимости.
Кроме того, на конгрессе ASCO были представлены промежуточные результаты исследования II фазы комбинации дабрафениба и траметиниба у пациентов с мМК с мутацией BRAF V600 и метастазами в головном мозге – COMBI-MB. Это первые результаты исследования II фазы по оценке комбинации ингибитора BRAF и MEK у пациентов с метастазами в головном мозге (рисунок). ЧОО интракраниально составила 58% (95% ДИ 46–69) у пациентов когорты А, первичная конечная точка была достигнута. Медиана продолжительности объективного ответа (например, 6,5 месяца в когорте А) была в целом меньше, чем у пациентов без метастазов в головном мозге (12–14 месяцев) [8, 13, 14]. Результаты исследования еще раз подтвердили эффективность комбинированной таргетной терапии даже у наиболее неблагоприятной категории пациентов с метастазами в головном мозге.
Иммуноонкологическая терапия
Иммуноонкологическая терапия для лечения мМК сегодня представлена несколькими препаратами: анти-CTLA4 – полностью человеческим моноклональным IgG1-антителом ипилимумабом, анти-PD1 – человеческим моноклональным IgG4-антителом ниволумабом и пембролизумабом (табл. 3). Результаты, приведенные в табл. 3, не являются прямым сравнением, они отражают данные каждого исследования в отдельности.
К настоящему моменту накоплен солидный опыт применения ипилимумаба как за рубежом, так и в России. В объединенный анализ данных вошли 4846 пациентов, получавших ипилимумаб в рамках клинических исследований и программ расширенного доступа [15]. Согласно полученным данным, трехлетняя общая выживаемость больных, получавших ипилимумаб, достигла 20% и после трех лет наблюдения кривая ОВ вышла на плато. На текущий момент показатель десятилетней ОВ составляет 17%.
В клиническом исследовании ниволумаба I фазы участвовали пациенты с мМК, которые ранее получали системную терапию (допускалось до пяти линий лечения, но не терапия ипилимумабом). 107 пациентов принимали ниволумаб в различных дозах (0,1, 0,3, 1, 3 и 10 мг/кг). В таблице 3 приведены данные для режима 3 мг/кг, который и был выбран в исследованиях фаз II и III. Годичная ОВ среди пациентов, получавших ниволумаб 3 мг/кг, составила 64,7%. Впоследствии 24-, 36- и 48-месячная ОВ снизилась до 47,1, 41,2 и 35,3% соответственно, после чего вышла на плато. Медиана ОВ у пациентов, получавших 3 мг/кг, достигла 20,3 месяца по сравнению со всеми 107 пациентами, у которых этот показатель составил 17,3 месяца. При этом пятилетняя ОВ у всех пациентов составила 34% и вышла на плато на 48-м месяце [16].
В исследование ChekMate-067 было включено 945 пациентов, которые ранее не получали системную терапию по поводу мМК. Все пациенты были случайным образом распределены в соотношении 1:1:1 на три группы:
- ниволумаба 1 мг/кг + ипилимумаб 3 мг/кг каждые три недели четыре дозы с последующим введением ниволумаба 3 мг/кг каждые две недели;
- ниволумаба 3 мг/кг каждые две недели + плацебо;
- ипилимумаба 3 мг/кг каждые три недели четыре дозы + плацебо.
Лечение проводили до прогрессирования заболевания или развития неприемлемой токсичности. При минимальном периоде наблюдения (28 месяцев) медиана ОВ была достигнута только для ипилимумаба (третья группа) – 20,0 месяца (ОР: ниволумаб + ипилимумаб vs ипилимумаб 0,55; p < 0,0001; ниволумаб vs ипилимумаб 0,63; p < 0,0001). При этом двухлетняя ОВ составила 64, 59 и 45% в первой, второй и третьей группе соответственно [17].
В исследовании I фазы KEYNOTE-001 пациенты, ранее получавшие системное лечение по поводу мМК (также ранее допускалась терапия ипилимумабом), были рандомизированы на три группы:
- пембролизумаба 2 мг/кг каждые три недели;
- пембролизумаба 10 мг/кг каждые три недели;
- пембролизумаба 10 мг/кг каждые две недели.
Из 655 пациентов, включенных в исследование, 342 ранее получали ипилимумаб (IPI-T), 313 не получали его (IPI-N). ЧОО составила 34% (29% для IPI-T, 38% для IPI-N), включая 6% полных ответов. Показатель двухлетней ОВ достиг 50% (46% для IPI-T, 53% для IPI-N) [18]. Согласно обновленным результатам 2016 г., показатель трехлетней ОВ составил 40% [19]. В 2017 г. C. Robert представила данные четырехлетней ОВ – 37,3% для всех пациентов, включенных в исследование, а также 48% – для пациентов, ранее не получавших терапии [20].
В исследовании III фазы (KEYNOTE-006) участвовали 834 пациента, которые случайным образом в соотношении 1:1:1 были распределены на группы:
- пембролизумаба 10 мг/кг каждые три недели в течение двух лет;
- пембролизумаба 10 мг/кг каждые две недели;
- ипилимумаба 3 мг/кг каждые три недели четыре введения.
На момент проведения анализа (декабрь 2015 г.) медиана продолжительности наблюдения составила 22,9 месяца, зарегистрировано 383 летальных исхода. На фоне применения пембролизумаба медиана ОВ не была достигнута, в то время как при использовании ипилимумаба она составила 16,0 месяца. Двухлетняя ОВ достигла 55% для пембролизумаба и 43% для ипилимумаба [21]. Обновленные результаты были представлены на конгрессе ASCO в 2017 г. На момент проведения анализа (3 ноября 2016 г.) медиана наблюдения за пациентами составила 33,9 (32,1–37,6) месяца. 33-месячная ОВ достигнута у 556 (50%) пациентов группы пембролизумаба и 278 (39%) – группы ипилимумаба, 33-месячная ВБП – в 31 и 14% случаев соответственно. ЧОО в группе пембролизумаба составила 42%, в группе ипилимумаба – 16% [22].
Заключение
Последние годы ознаменовались появлением новых эффективных препаратов для лечения меланомы кожи, которые пришли на смену химиотерапии. Сегодня изменения коснулись лечения не только пациентов с распространенными формами заболевания, но и больных с высоким риском после радикальных хирургических вмешательств.
В настоящее время проводится множество исследований, появляются новые данные, которые обновляются ежегодно или несколько раз в год.
Препараты, рассмотренные в данной статье и зарегистрированные в России, могут быть использованы для лечения пациентов с меланомой кожи. Надо признать, что высокая стоимость подобного лечения является ограничивающим фактором. Но мы надеемся, что решающим фактором при выборе варианта терапии для пациентов с меланомой станет высокая эффективность.
K.V. Orlova, L.V. Demidov
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Kristina Vyacheslavovna Orlova, krisman03@gmail.com
The incidence of melanoma has been constantly increasing. If in 2013 in Russia, there were registered 8974 new case, that in 2015 – 9384. In the treatment of metastatic melanoma the significant changes have taken place.
In particular, both abroad and in Russia new drugs have been appeared and registered which can increase the overall life expectancy of patients with this disease. At the same time, the algorithm for the adjuvant treatment of patients with high risk melanoma remains unchanged for a long time. This article provides the current data on adjuvant therapy of high risk melanoma and treatment of metastatic melanoma presented at congresses in 2017.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.