Внутриопухолевая анти-PD-1-терапия у больных меланомой кожи III–IVM1a стадии. Пилотное исследование
- Аннотация
- Статья
- Ссылки
- English
Результаты показали клиническую частоту ответов на лечение в 67,7% случаев, включая полные клинические ответы у 16,1% пациентов. Полный патоморфологический ответ был достигнут у 22,6% пациентов. Медиана выживаемости без прогрессирования составила 11 месяцев, при этом медиана общей выживаемости превысила 50 месяцев и не была достигнута на момент анализа.
Несмотря на небольшой объем выборки, результаты данного исследования демонстрируют потенциал внутриопухолевого введения анти-PD-1-препаратов как эффективного и перспективного метода лечения меланомы кожи в неоадъювантной настройке. Такой подход может стать альтернативой традиционным методам лечения, предлагая более целенаправленное воздействие на опухоль и возможность сокращения продолжительности курса лечения, а также снижение риска системных побочных эффектов. Однако для подтверждения эффективности и безопасности данной методики необходимы дальнейшие исследования с участием большего числа пациентов.
Результаты показали клиническую частоту ответов на лечение в 67,7% случаев, включая полные клинические ответы у 16,1% пациентов. Полный патоморфологический ответ был достигнут у 22,6% пациентов. Медиана выживаемости без прогрессирования составила 11 месяцев, при этом медиана общей выживаемости превысила 50 месяцев и не была достигнута на момент анализа.
Несмотря на небольшой объем выборки, результаты данного исследования демонстрируют потенциал внутриопухолевого введения анти-PD-1-препаратов как эффективного и перспективного метода лечения меланомы кожи в неоадъювантной настройке. Такой подход может стать альтернативой традиционным методам лечения, предлагая более целенаправленное воздействие на опухоль и возможность сокращения продолжительности курса лечения, а также снижение риска системных побочных эффектов. Однако для подтверждения эффективности и безопасности данной методики необходимы дальнейшие исследования с участием большего числа пациентов.



Введение
В настоящее время блокаторы PD-1 широко вошли в практику лечения нерезектабельной меланомы кожи, а также в качестве адъювантной терапии после радикального хирургического лечения. Адъювантное применение блокаторов PD-1 позволяет снизить относительный риск прогрессирования меланомы кожи III стадии приблизительно на 50% в сравнении с плацебо [1] или приблизительно на 25–30% в сравнении с ипилимумабом или интерфероном [2, 3]. Тем не менее снижение абсолютного риска не выглядит таким уж значительным. Так, в случае проведения хирургического лечения у пациентов с меланомой III стадии на первом этапе не менее 35–40% больных будут вылечены только хирургической операцией, в то время как приблизительно у 40–45% возникнет рецидив болезни, несмотря на проводимое адъювантное лечение [1], то есть пользу от применения адъювантной терапии блокатором PD-1 при системном его введении получают не более 15–20% пациентов из тех, кому оно было назначено.
Кроме того, проведение адъювантной терапии сопряжено с достаточно длительным курсом (до 12 месяцев), на протяжении которого у 37–40% больных будут отмечены те или иные иммуноопосредованные нежелательные явления (НЯ) [4]. Можем ли мы аккуратнее выбирать показания для терапии и назначать ее пациентам, которые точно получат пользу от иммунотерапии при меланоме III стадии, или хотя бы сделать такой курс короче?
Конечно, последние годы ознаменовались разработкой нескольких прогностических систем, основанных на определении различных молекулярных маркеров в опухолевой ткани для пациентов с меланомой II стадии [5–7] и моделей, предсказывающих резистентность к терапии анти-PD-1-препаратами (aPD-1) при метастатической меланоме [8–14], которые тем не менее все еще нуждаются в тестировании в рамках рандомизированных клинических испытаний.
Неоадъювантный подход, с нашей точки зрения, позволяет определить биологическую чувствительность опухоли и иммунной системы пациента к проводимой иммунотерапии в достаточно короткие сроки (до 12 недель) и при отсутствии признаков такой чувствительности предложить альтернативный адъювантный подход.
В настоящее время уже опубликованы результаты нескольких небольших нерандомизированных исследований, в которых изучали различные подходы к неоадъювантной терапии, как системной иммунотерапии (комбинированной или монотерапии aPD-1) [15–20], так и внутриопухолевой терапии онколитическими вирусами [21].
Системная неоадъювантная терапия наряду с преимуществами (удобством привычного пути введения и предсказуемым характером НЯ) характеризуется определенными недостатками: лекарственный препарат – моноклональные антитела, блокирующие контрольные точки иммунитета, – распределяется в большом объеме и может активировать в том числе опухоль-неспецифические лимфоциты, тем самым вызывая хорошо предсказуемые иммуноопосредованные нежелательные реакции.
Наше предположение состояло в том, что внутриопухолевое введение существенно меньших доз моноклональных антител – блокаторов иммунных чекпойнтов непосредственно в пораженный опухолью лимфатический узел или мягкотканный узел позволит заблокировать иммунные чекпойнты в основном на опухоль-инфильтрирующих лимфоцитах, которые, как известно, значительно обогащены популяциями лимфоцитов с репертуарами Т-клеточных рецепторов, специфичных к опухолевым антигенам [22].
В случае успеха именно опухоль-специфические Т-лимфоциты подвергнутся экспансии в наибольшей степени, в то время как другие субклоны, в частности те, что населяют другие периферические лимфатические органы, в значительной степени могут остаться интактными.
Материал и методы
Проспективное одногрупповое исследование включало пациентов обоих полов старше 18 лет с гистологически подтвержденным диагнозом меланомы и общим состоянием по шкале ECOG 0–1. Пациенты не должны были ранее получать блокаторы PD-1. В исследовании были выделены две когорты пациентов: с неоперабельной и операбельной опухолью стадии IIIC/D/IVM1a-c. При этом в обеих когортах у пациентов до начала лечения должны были определяться не менее одного подкожного, внутрикожного метастаза ≥ 10 мм или поверхностно определяемого лимфатического узла с диаметром короткой оси не менее 15 мм.
Исходное распространение опухолевого процесса, а также оценку радиологического ответа на лечение выполняли в соответствии с рутинной клинической практикой учреждения не ранее чем за четыре недели до начала терапии, далее на 12-й неделе терапии и затем каждые 12 недель до наступления прогрессирования или смерти.
Пациентам проводилась внутриопухолевая неоадъювантная иммунотерапия с последующим хирургическим лечением в случае резектабельной опухоли и последующей повторной биопсией в случае нерезектабельной опухоли.
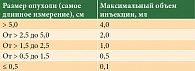
В течение 12 недель один раз в 14 дней пациентам в опухоль под контролем ультразвукового исследования (УЗИ) вводился аPD-1 (ниволумаб или пембролизумаб) с оценкой размера метастатического очага. Концентрация препаратов составляла 10 мг/1 мл (ниволумаб) и 25 мг/1 мл (пембролизумаб). Доза вводилась в зависимости от размера опухоли (табл. 1).
Пациентам планировалось проведение шести курсов внутриопухолевой иммунотерапии.
Образцы опухоли для оценки биомаркеров и полного патологического ответа взяты до лечения и после лечения на 13–18-й неделе (кор-биопсия/резекция). Оценка лейкоцитарного инфильтрата (TILs) перед лечением и после проводилась при помощи проточной цитометрии и иммуногистохимии.
Первичной конечной точкой являлась частота системных объективных ответов на лечение, вторичной конечной точкой – выживаемость без прогрессирования (ВБП), общая выживаемость (ОВ). Для выявления системного объективного ответа в 50% с чувствительностью 80% и ошибкой типа альфа необходимо включить не менее 25 пациентов. Ответ на лечение определялся по критериям RECIST 1.1. Промежуточный анализ запланирован при включении 25% пациентов и был представлен ранее [23].
Все пациенты дали письменное информированное согласие на участие в исследовании, а само исследование одобрено этическим комитетом Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина.
Результаты
С марта 2016 г. по март 2019 г. в исследование включен 31 пациент: с неоперабельной опухолью стадии IIIC/D/IVM1a-d (первая когорта, n = 12) и операбельной опухолью стадии IIIC/D/IVM1a (вторая когорта, n = 19) (рис. 1).
Период наблюдения за пациентами – с марта 2016 г. по март 2021 г.
Медиана наблюдения – 42,7 месяца.
Исходные характеристики приведены в табл. 2. Средний возраст пациентов – 61 год. Мужчины – 32,2% от всех пациентов. Статус ECOG 0 – у 51,6%. На момент включения в исследование с меланомой III стадии – 24 (77,4%) пациента, IV стадии – семь пациентов (М1а – 6 (19,4%), М1d – 1 (3,2%)). Мутация в гене BRAF выявлена у 10 (32%) пациентов. У 6 (19,3%) пациентов данные по мутации не получены. У 1 (3,3%) пациента выявлена мутация CKIT и у 2 (6,4%) – мутация NRAS.
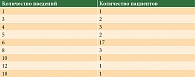
Из запланированных шести введений все введения получили 23 пациента из 31 (74%), из них шести (19%) пациентам лечение продолжено после завершения 12-недельного курса терапии ввиду убедительного клинического эффекта и/или отказа пациента от хирургической операции (табл. 3). Средняя доза на введение препарата составила 44,6 мг (с учетом различной концентрации ниволумаба и пембролизумаба). Медиана кумулятивной дозы aPD-1 за неоадъювантный курс – 180 мг. Минимальный размер метастатического узла до лечения – около 10 мм, максимальный – 84 мм, медиана максимального размера индексного очага – 35,8 мм.
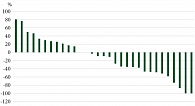
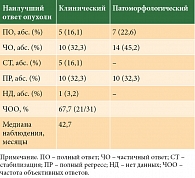
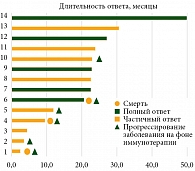
Клиническая частота ответов на лечение (cОRR) составила 67,7% (21/31), при этом полные клинические ответы на лечение наблюдались у 5 (16,1%) пациентов. Глубина ответа на лечение представлена на рис. 2.
После проведения неоадъювантной иммунотерапии запланировано 19 операций, однако проведено 17. Один пациент отказался от операции, так как метастатический очаг регрессировал (кор-биопсия подтвердила отсутствие остаточной опухоли). У второго пациента на фоне терапии, несмотря на уменьшение метастатического очага, в который вводился препарат, появился отдаленный новый метастатический очаг, пациент был переведен на дальнейшее системное введение в/в капельно.
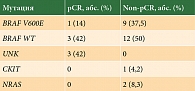
Полный патоморфологический ответ (pОRR), по данным гистологического исследования, наблюдался у 7 (22,6%) пациентов) (табл. 4). Прогрессирование болезни на фоне терапии отмечалось у 9 (29%) пациентов, стабилизация – у 7 (22,6%).
На рис. 3 представлены пациенты с полным ответом (ПО) или частичным ответом (ЧО) на лечение. Самый длительный ответ – 50 месяцев, самый короткий – 3. У шести пациентов из 14 отмечено прогрессирование, несмотря на зарегистрированный ранее ответ на лечение. Один пациент умер от прогрессирования заболевания, несмотря на развившийся ранее ПО на лечение.
При этом у 13 пациентов не отмечается прогрессирование заболевания, а у 18 наблюдается. Причиной смерти у большинства умерших являлось прогрессирование меланомы (табл. 5).
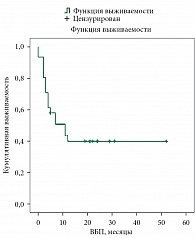
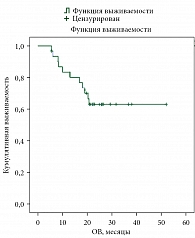
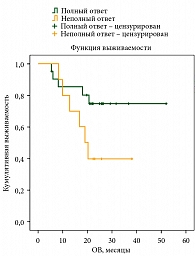
Медиана ВБП составила 11 месяцев (рис. 4). Медиана ОВ – более 50 месяцев и не достигнута (рис. 5).
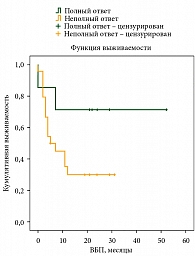
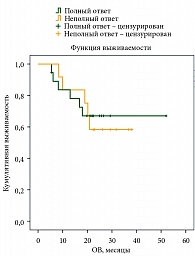
Медиана ВБП у пациентов с ПО – 48 месяцев, у пациентов без ПО – 4 месяца (рис. 6). Медиана ОВ у пациентов с ПО не достигнута, у пациентов без ПО на лечение – 19 месяцев (рис. 7).
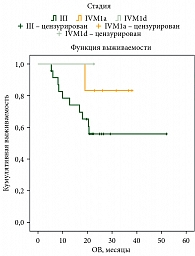
В настоящей серии наблюдений не получено различий в ОВ между пациентами с меланомой III и IVM1a стадии, вероятно, вследствие недостаточного количества пациентов в группах (рис. 8). ОВ представлена в зависимости от резектабельности процесса (рис. 9). Медиана ОВ у пациентов с резектабельными метастазами – 47 месяцев, с нерезектабельными – 35 месяцев.
Биомаркеры, изученные в данной работе, включали в себя молекулярно-генетические свойства опухоли и состав иммунного инфильтрата опухоли. Результаты молекулярно-генетического исследования представлены в табл. 6.
Не установлено связи между молекулярно-генетическим статусом и ответом на внутриопухолевую иммунотерапию. Иммунный инфильтрат опухоли у большинства пациентов исследовать не удалось.
На фоне иммунотерапии у нескольких пациентов развились НЯ. У одного пациента – колит 4-й степени (пациент без ПО на лечение). Аутоиммунный тиреоидит – у одной пациентки 4-й степени и у трех – 1-й степени, среди них у троих ПО на лечение. Также к НЯ можно отнести болезненность в месте инъекции при введении препарата у всех пациентов.
Выводы
Таким образом, в данном пилотном исследовании продемонстрировано, что большинство пациентов, ответивших на лечение в неоадъювантном режиме, продолжали отвечать и на условно-адъювантную терапию.
Также можно отметить, что и на небольших дозах препарата у пациентов наблюдался ПО. Можно предположить, что у PD-1-ингибиторов нет дозозависимости. Однако, несмотря на дозы, у некоторых пациентов наблюдались аутоиммунные реакции, а это означает, что введение препарата непосредственно в опухоль не является более безопасным по сравнению с внутривенным введением.
Частота объективного ответа на лечение сопоставима с таковой при внутривенном введении.
Учитывая отсутствие у многих пациентов данных о наличии различных рецепторов в опухоли и клеток иммунной системы в ее микроокружении, по-прежнему нельзя достоверно оценить, влияют ли TILs на исходы иммунотерапии и являются ли они предиктивным фактором.
Ye.V. Kogay, I.V. Samoylenko, PhD, K.A. Baryshnikov, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Igor V. Samoylenko, i.samoylenko@ronc.ru
The intra-tumor administration of anti-PD-1 drugs is an innovative approach to the treatment of patients with stage III–IVM1a skin melanoma. A pilot study conducted at the N.N. Blokhin National Medical Research Center of Oncology is aimed at evaluating the effectiveness and safety of this technique. The study included 31 patients divided into two cohorts: with inoperable and operable tumors. During the study, patients were injected with anti-PD-1 drugs (nivolumab or pembrolizumab) directly into the tumor under ultrasound control every two weeks for 12 weeks. The results showed a clinical response rate for treatment in 67.7% of cases, including complete clinical responses in 16.1% of patients. A complete pathomorphological response was achieved in 22.6% of patients. The median progression-free survival was 11 months, while the median overall survival exceeded 50 months and was not reached at the time of analysis. Despite the small sample size, the results of this study demonstrate the potential of intra-tumor administration of anti-PD-1 drugs as an effective and promising method of treating skin melanoma in a neoadjuvant setting. This approach can become an alternative to traditional methods of treatment, offering a more targeted effect on the tumor and the possibility of reducing the duration of treatment, as well as reducing the risk of systemic side effects. However, further studies involving a larger number of patients are needed to confirm the effectiveness and safety of this technique.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.