Новый отечественный противоопухолевый препарат Араноза в комбинации с доксорубицином и винкристином в качестве второй линии химиотерапии диссеминированного мелкоклеточного рака легкого
- Аннотация
- Статья
- Ссылки


В Европе в 2004 г. зарегистрировано приблизительно 3 млн новых случаев и 1,7 млн смертей от рака. Рак легкого занимает 1-е место (375 000 новых случаев и 340 000 смертей).
При отсутствии эффективных превентивных мероприятий заболеваемость раком легкого возрастет к концу 2030-го до 2,2 млн. В 2000 г. раком легкого заболело 63,1 тыс. человек, составляя 14,1% (в 1980 г. – 15,4%) в структуре заболеваемости населения России. Среди 170 000 новых случаев рака легкого, диагностированных в 2002 г., приблизительно 25% (или около 42 000) составляет мелкоклеточный рак легкого (МРЛ).
МРЛ характеризуется высокой злокачественностью, тенденцией к быстрой диссеминации, но также более высокой чувствительностью к химио- и лучевой терапии. Он относится к низко дифференцированным нейроэндокринным опухолям и иногда может сопровождаться различными паранеопластическими синдромами. Несмотря на стандартную классификацию по TNM, практически используемым является стадирование МРЛ на локализованный и распространенный процесс (классификация Veternas Administration Lung Cancer Study Group). При локализованном МРЛ опухолевое поражение ограничено одним гемотораксом с вовлечением в процесс регионарных и контрлатеральных лимфоузлов корня и средостения и ипсилатеральных надключичных лимфоузлов. Распространенным МРЛ считается процесс, выходящий за пределы локализованного. Локализованную стадию процесса имеют лишь 30% первично диагностируемых больных. Отдаленные результаты лечения МРЛ остаются неудовлетворительными, хотя они заметно улучшились за предыдущее десятилетие.
Эффективными препаратами для лечения МРЛ являются цисплатин, этопозид, доксорубицин, циклофосфан, топотекан, таксаны, гемзар, иринотекан. Их эффективность колеблется от 25 до 50% (29).
В настоящее время одним из основных режимов при МРЛ является комбинация этопозид + цисплатин, которая может использоваться как самостоятельно, так и в комбинации с лучевой терапией. Продолжают изучаться комбинации с новыми препаратами на основе цисплатина или карбоплатина. Так, по данным японских исследователей (30) режим цисплатин + иринотекан оказался эффективнее цисплатина и этопозида, и на основании этого схема PI признана в Японии стандартом лечения локализованной формы МРЛ. Однако в североамериканском исследовании эти данные не были подтверждены(33).
В целом в терапии МРЛ на настоящий момент времени следует подчеркнуть тенденцию к увеличению роли хирургического лечения при ранних стадиях заболевания, раннее начало лучевой терапии в качестве химио-лучевого лечения, обязательное профилактическое облучение головного мозга у больных с полной ремиссией, повышение роли симптоматической терапии с целью улучшения качества жизни больных.
Особое место занимает разработка новых режимов 2-й линии химиотерапии с целью улучшения отдаленных результатов.
Прогноз пациентов, которые прогрессируют на первой линии химиотерапии, чрезвычайно плохой. Медиана выживаемости таких пациентов при паллиативном лечении от 2 до 3 месяцев. Чем больше длительность ремиссии после завершения первой линии химиотерапии, тем больше вероятность достижения объективного эффекта при проведении 2-й линии лечения. При длительности ремиссии более 3-х месяцев, как правило, возобновляют первую линию лечения. Вероятность повторного объективного эффекта достигает 50%.
К сожалению, несмотря на то, что за последнее десятилетие в практику вошло большое количество новых эффективных противоопухолевых препаратов, большинство из них, как показали последние исследования, не добавляют оптимизма в лечении мелкоклеточного рака легкого. Наиболее эффективными режимами в качестве второй линии химиотерапии являются CAV, топотекан, которые показали равную эффективность, медиану выживаемости, однако при лечении топотеканом был отмечен более выраженный симптоматический эффект (9, 10); стандартный режим лечения ЕР в качестве первой линии химиотерапии эффективен и в качестве второй линии лечения рецидивного МРЛ у пациентов, резистентных к CAV (4). Оказались эффективными и режимы с включением паклитаксела – у пациентов, рефрактерных к первой линии химиотерапии CDE. При лечении паклитакселом в комбинации с карбоплатином достигнута медиана выживаемости в 31 неделю (11). В большинстве других исследований режимов второй линии химиотерапии, с включением гемцитабина, иринотекана, доцетаксела, винорельбина, перорального этопозида объективный эффект лечения достигается при рецидивном МРЛ от 11% до 40%. Однако медиана длительности эффекта слишком коротка и не превышает 30 недель (3, 12, 13, 14, 15, 16, 17, 18).
В данное время изучаются новые таргетные препараты при рецидивном МРЛ – синтетические ретиноиды (19), ингибиторы тирозинкиназы (20, 28), матриксных металлопротеиназ (21, 22), фарнезил трансферазы (23), протеосом (24), mTOR (25), ингибиторы ангиогенеза (26,27). Однако результаты этих исследований на данный момент, как правило, отрицательные и не влияющие на значение медианы выживаемости. Привлекают внимание два исследования: в одном из них использование талидамида (ингибитор неоагиогенеза) в течение 2 лет после EP позволило получить однолетнюю выживаемость 42% и медиану выживаемости 10 месяцев при диссеминированном МРЛ (31). При исследовании гливека (ингибитор рецепторов факторов роста) в комбинации с кампто у ранее леченных больных контроль роста опухоли достигнут в 37,8% (эффект – 11,8%, стабилизация – 26%, выживаемость – 5,7 месяцев) (32).
В отделении химиотерапии РОНЦ РАМН был разработан новый режим химиотерапии 2-й линии при диссеминированном мелкоклеточном раке легкого на основе отечественного противоопухолевого препарата аранозы. Араноза – 3-/a-L-арабинопиранозил-1/-метил-1-нитрозомочевина синтезирована в лаборатории химического синтеза в РОНЦ им. Н.Н. Блохина РАМН в 1975 году и представляет собой метильное производное нитрозомочевины, в котором носителем цитотоксической группы является моносахарид L-арабиноза. Араноза – это противоопухолевое алкилирующее средство, ингибирующее синтез ДНК в опухолевых клетках. По экспериментальным данным, араноза обладает более высокой противоопухолевой активностью, чем ее ближайшие структурные аналоги – стрептозотоцин и нитрозометилмочевина.
При I фазе клинического изучения аранозы было показано, что дозолимитирующей токсичностью является миелосупрессия, зарегистрированная при дозе более 792 мг/м2 у 55,5% больных (всего в исследовании участвовал 71 больной) в виде лейкопении и у 22% больных – в виде тромбоцитопении. У 72,8% отмечены тошнота и рвота и у 10,2% – преходящая диарея. Незначительные изменения почечной и печеночной функции по биохимическим показателям, лихорадка и флебиты наблюдались у отдельных больных, главным образом, при дозах выше 528 мг/м2. Для II фазы рекомендован режим 550-800 мг/м2 внутривенно струйно в 5% растворе глюкозы 3 дня подряд или через день с интервалом 4 недели. II фаза клинического изучения аранозы у 337 больных, страдающих различными злокачественными опухолями, проведена в качестве кооперированного мультицентрового исследования в ведущих онкологических институтах бывшего Советского Союза (1). В результате II фазы подтверждена отмеченная еще при I фазе эффективность препарата при злокачественной диссеминированной меланоме кожи; обнаружена эффективность при саркомах матки, раке молочной железы, головы и шеи, лимфосаркомах и лимфогранулематозе, немелкоклеточном раке легкого. При дальнейшем клиническом изучении аранозы при диссеминированной меланоме была показана равная эффективность с дакарбазином, который до последнего времени остается стандартом в лечении диссеминированной меланомы. В 1996 году араноза разрешена ФК МЗ РФ для клинического применения при диссеминированной меланоме кожи. Изучение аранозы при других опухолях ограничено. Близость химической структуры аранозы к стрептозотоцину демонстрирует высокую эффективность при нейроэндокринных опухолях и позволяет предположить эффективность аранозы у больных мелкоклеточным раком легкого. Араноза изучалась в комбинации с циклофосфаном, винкристином, метотрексатом и лучевой терапией при мелкоклеточном раке легкого, объективный эффект составил 49,5% (2).
Материалы и методы
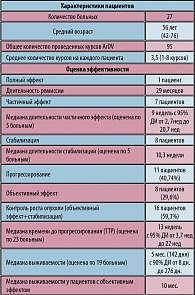
В исследование за период с 1999 по 2005 гг. включено 27 пациентов c подтвержденным гистологически или цитологически рецидивным мелкоклеточным раком легкого. Четверо пациентов на момент установки диагноза имели локализованный процесс, 23 – распространенный. Все пациенты в первую линию лечения получили платиносодержащие режимы химиотерапии. Двоим пациентам с локализованным процессом на первом этапе проводилось химиолучевое лечение с использованием режима этопозид/цисплатин, с достижением полного эффекта лечения, подтвержденным бронхоскопией с исследованием биопсийного материала, однако ремиссия составила менее 1 месяца. Большинство пациентов были рефрактерны к первой линии лечения (25 человек) – то есть прогрессировали во время проведения лечения либо в течение 3-х месяцев после завершения первой линии химиотерапии. В таблице 1 приведены режимы химиотерапии, использовавшиеся в качестве первой линии химиотерапии, и их эффективность. Среди пациентов, оказавшихся чувствительными к первой линии химиотерапии, одному было проведено 5 курсов химиотерапии нитруллин + этопозид + цисплатин с частичным эффектом и длительностью ремиссии 12 месяцев, второму – 4 курса химиотерапии ACNU+этопозид+цисплатин с частичным эффектом, в последующем был проведен курс консолидирующей лучевой терапии с полным эффектом и длительностью ремиссии 6 месяцев.
Клинические результаты
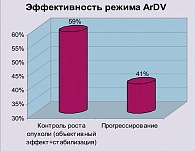
У всех пациентов была оценена эффективность режима ArDV.
Следует отметить, что среди 8 пациентов с объективным эффектом двое имели чувствительную к химиотерапии первой линии форму мелкоклеточного рака легкого. При использовании режима ArDV у одного зарегистрирована полная, у другого частичная регрессия опухоли. У больного с полным эффектом длительность ремиссии составила 116 недель, общая выживаемость – 138 недель; у больного с частичным эффектом длительность ремиссии составила 24 недели, общая выживаемость – 44 недели.
Исследуемый режим оказался многообещающим в отношении пациентов с метастазами в головной мозг – у 4 из 10 пациентов с регистрацией полный эффект при поражении в головном мозге.
Ни один пациент не был исключен из исследования ввиду токсичности. Токсичность 3/4 степени была зарегистрирована со стороны гематологических показателей – лейкопения у 4 пациентов (16%), нейтропения у 8 пациентов (32%), тошнота/рвота была отмечена у одного больного, у которого в качестве премедикации не были назначены антиэметики из группы блокаторов серотониновых 5-HT3 рецепторов (Таблица 3).
Заключение
Режим ArDV в качестве 2-й линии химиотерапии диссеминированного мелкоклеточного рака легкого имеет достаточно высокую эффективность и хорошую переносимость. Многообещающими оказались результаты при метастазах в головной мозг. Настоящее исследование продолжается.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.