О рациональном выборе сахароснижающей терапии при сахарном диабете 2 типа
- Аннотация
- Статья
- Ссылки
На сегодняшний день остаются нерешенными многие проблемы, в первую очередь связанные с достижением целевого метаболического контроля: в России, как и во многих других странах, 2/3 пациентов с СД 2 не достигают рекомендованных целей терапии [2, 15]. Эффективное лечение гипергликемии – основного фактора развития диабетических осложнений – чрезвычайно важный вопрос, учитывая повсеместное стремительное увеличение числа пациентов с СД, их преждевременную инвалидизацию и высокую смертность из-за сосудистых осложнений, частоту которых можно существенно сократить за счет достижения гликемии, близкой к нормальному уровню [1, 19].
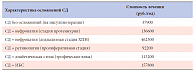
Принципиально важно, чтобы оптимальный контроль гликемии осуществлялся с дебюта СД 2 и в течение всей жизни пациента, ведь к моменту установления диагноза у половины пациентов выявляются два и более осложнения заболевания [14]. Так, по данным исследования CODE- 2 (Cost of Diabetes in Europe – Type 2), различные осложнения имели 59% пациентов с СД 2, причем у 23% было два и у 3% – три осложнения. Сердечно-сосудистая и цереброваскулярная патология была обнаружена у 43 и 12% пациентов соответственно [11]. Острота проблемы нарастает, поскольку велики и экономические последствия, обусловленные осложнениями СД 2 [12]. Так, присоединение диабетических осложнений в среднем повышает стоимость лечения заболевания в 3–10 раз (табл. 1) [2].
Крупные исследования показали, что ранний интенсивный гликемический контроль снижает риск развития осложнений заболевания [3, 19]. Вместе с тем, на сегодняшний день имеются данные о долгосрочном влиянии раннего метаболического контроля на клинические исходы СД 2. На основании этих наблюдений была предложена концепция «метаболической памяти» [6].
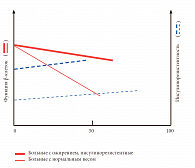
Осознание срочности подбора эффективного и быстро показывающего результат лечения основано в первую очередь на современном понимании патофизиологии СД 2 – непрерывно прогрессирующего заболевания с последовательным ухудшением показателей гликемии, и, что важно, успех любой терапии этого недуга зависит от остаточной функции β-клеток [3, 5, 17]. В развитии СД 2 имеют значение два фундаментальных патофизиологических механизма: прогрессирующее нарушение функции β-клеток и инсулинорезистентность различной степени выраженности. При манифестации диабета секреция инсулина в среднем снижается на 50%, чувствительность к инсулину – на 70% [7, 17]. В дальнейшем функция β-клеток ухудшается со скоростью примерно 4–6% в год от момента установления диагноза; периферическая чувствительность к инсулину остается относительно сохранной, что определяет необходимость выбора оптимальной терапии на каждом этапе развития заболевания (рис. 1) [13].
Прежде чем перейти к вопросам фармакотерапии СД 2, отметим важность немедикаментозных подходов к лечению заболевания и проведению самоконтроля гликемии, без которых любая фармакотерапия будет недостаточно эффективна, – их необходимо использовать у всех пациентов без исключения. Современные рекомендации по диетотерапии СД 2 содержат следующие принципы: энергетическая ценность пищи, поддерживающая массу тела близкой к идеальной, а в случае избыточного веса – низкокалорийное питание; предусматривается максимальное ограничение или исключение легкоусвояемых и преимущественное потребление сложных углеводов. Рекомендуемое содержание углеводов – 50–60%, белков – 15–20% от общей калорийности суточного рациона; доля жиров в суточном рационе не должна превышать 30%, насыщенные жиры должны составлять не более 1/3 от всего потребляемого жира. Предусматривается включение полиненасыщенных жиров в качестве антиатерогенного средства, также необходимо снижение потребления холестерина (менее 300 мг в день) и повышение употребления продуктов с высоким содержанием пищевых волокон, сокращение приема алкоголя (менее 30 г в день). Хороший эффект оказывает рациональная физическая нагрузка, безопасная и эффективная, с учетом индивидуальных особенностей каждого пациента.
В клинической практике с учетом большого количества пероральных сахароснижающих препаратов (ПССП) с различными механизмами действия выбор назначаемой фармакотерапии, основанный на научных данных о патофизиологии СД 2, приобретает большое практическое значение [1, 9]. Основой лечения больных СД 2 уже почти 60 лет являются препараты сульфонилмочевины (ПСМ), механизм действия которых детально изучен. В клинической практике они используются с середины 50-х гг. прошлого столетия [15]. Целесообразность использования ПСМ не подлежит сомнению, так как важнейшим патогенетическим звеном СД 2 является секреторный дефект β-клетки [3, 17].
Производные сульфонилмочевины относятся к группе секретагогов, иначе говоря, их механизм действия основан прежде всего на способности стимулировать секрецию инсулина β-клетками поджелудочной железы, особенно в присутствии глюкозы [15]. Наличие в островках Лангерганса функционально активных β-клеток является основой для проявления эффекта ПСМ. Периферическое (экстрапанкреатическое) действие, по-видимому, вторично и обусловлено повышением инсулинемии, снижением глюкозотоксичности, что вызывает угнетение продукции глюкозы печенью и улучшение утилизации глюкозы периферическими тканями; собственные экстрапанкреатические эффекты убедительно не доказаны [9].
При общем механизме действия каждый из производных сульфонилмочевины имеет особенности фармакокинетики и фармакодинамики, а также дополнительные фармакологические свойства, которые необходимо учитывать при лечении пациентов с СД 2. Основными характеристиками разных ПСМ, имеющими реальное клиническое значение, можно считать следующие: длительность действия, селективность взаимодействия с различными АТФ-зависимыми К+-каналами, путь выведения из организма. Важно отметить, что чрезмерная, длительная стимуляция секреции инсулина, вызываемая некоторыми ПСМ, может способствовать преждевременному истощению функциональной активности β-клеток, увеличению риска гипогликемий и прибавке массы тела у пациентов [15]. По этой причине принципиальный подход к выбору того или иного ПСМ основывается на оценке баланса эффективности, безопасности и доступности для пациента.
Одним из эффективных ПСМ является глимепирид, который характеризуется стопроцентной биодоступностью, быстрой ассоциацией и диссоциацией с сульфонилмочевинным рецептором SURX [1, 8]. Механизм действия глимепирида во многом аналогичен таковому других ПСМ, но вместе с этим он имеет ряд важных преимуществ. Было показано, что, в отличие от других препаратов, глимепирид связывается не с классическим рецептором сульфонилмочевины (мол. масса 140 кД), а с другим белком субъединицы АТФ-зависимых К+- каналов β-клетки с молекулярной массой в 65 кД/SURX [10]. В практическом плане препарат обладает особыми характеристиками фармакологического действия: связывается со специфическим рецептором в 2,5–3 раза быстрее и диссоциирует из комплекса «глимепирид – белок» в 8–9 раз быстрее в сравнении с глибенкламидом, при этом сродство связывания у глимепирида втрое меньше, чем у глибенкламида. Это обеспечивает не только быструю продукцию инсулина во время приема пищи, но и, что принципиально важно, защиту β-клеточного аппарата от преждевременного истощения.
Терапевтическая доза глимепирида, составляющая 1–6 мг в сутки, является наименьшей среди всех ПСМ. Пролонгированное действие (24 часа) позволяет назначать препарат в режиме однократного приема, что не только удобно, но и безопасно для больных СД 2, в том числе пожилого и преклонного возраста. Следует отметить, что фармакокинетика глимепирида у лиц пожилого и преклонного возраста не отличается от молодых [9, 10]. Препарат полностью метаболизируется в печени и имеет двойной путь выведения: 60% с мочой и 40% через желудочно-кишечный тракт, что делает возможным его применение при умеренной почечной недостаточности.
Лечение глимепиридом начинают с 1 мг, принимаемого до или во время еды; это правило должно соблюдаться и в тех случаях, когда пациента переводят с лечения другими ПСМ [1, 8, 10]. Повышение дозы препарата проводится на 1–2 мг в неделю соответственно значениям гликемии. Индивидуальная терапевтическая доза варьирует от 1 до 6 мг в день. Максимально рекомендованная доза составляет 6 мг в сутки. Противопоказаниями к назначению глимепирида являются: СД 1 типа, диабет после панкреатэктомии, кетоацидоз, хирургические вмешательства (большие операции), тяжелые инфекции и травмы, аллергии на ПСМ или сходные с ними препараты в анамнезе, тяжелые нарушения функции почек и печени. Следует воздержаться от назначения препарата в период беременности и лактации. При необходимости усиления сахароснижающего эффекта глимепирид можно комбинировать с метформином, инкретиномиметиками и базальным инсулином, что позволяет у некоторых пациентов добиться более успешного гликемического контроля.
В заключение следует отметить, что рациональная терапия СД 2 Глемазом, обладающим благоприятным спектром фармакологических эффектов, низким риском эпизодов гипогликемий, современная технология «Флексидоза», увеличивающая точность дозировки, позволяют ожидать не только эффективного контроля гликемии, но и большей приверженности больных к рекомендованной терапии и улучшению качества и прогноза жизни больных.
NB
Глемаз (глимепирид 4 мг в таблетке «Флексидоза») – сравнительно новый ПСМ. Новая технология производства «Флексидоза» обеспечивает гомогенность формы активного вещества глимепирида, содержащегося в таблетке, и деление таблетки с сохранением строго определенного количества действующего вещества в каждой из частей.
* Расчет произведен по стандартам оказания амбулаторной медицинской помощи больным СД, утвержденным МЗ и СР РФ в 2007 г.
