Периферические и центральные эффекты сертралина у больных сахарным диабетом 2 типа: потенциал для снижения инсулинорезистентности
- Аннотация
- Статья
- Ссылки
- English
Сертралин может способствовать более эффективному контролю массы тела и поступления углеводов, что позволит достичь целевого уровня глюкозы в крови. Получены также данные о потенциальной возможности препарата снижать инсулинорезистентность, а также апоптоз бета-клеток поджелудочной железы.
Сертралин может способствовать более эффективному контролю массы тела и поступления углеводов, что позволит достичь целевого уровня глюкозы в крови. Получены также данные о потенциальной возможности препарата снижать инсулинорезистентность, а также апоптоз бета-клеток поджелудочной железы.
В настоящее время диагноз «сахарный диабет 2 типа» все чаще ставится пациентам более молодого возраста [1]. Такая ситуация может быть связана не только с уточнением нормативов показателей, усовершенствованием клинико-лабораторной диагностики, но и с изменением ритма жизни, питания и других модифицируемых факторов.
Последние годы получены новые данные о патогенезе СД 2 типа. Кроме того, изменилась сама концепция СД 2 типа. Ранее центральное место в развитии патологии отводилось гипергликемии, сейчас – дисфункции бета-клеток поджелудочной железы. Нарушение секреторной функции коррелирует по принципу обратной связи со всеми остальными механизмами патогенеза [2].
Следовательно, точкой приложения фармакотерапии становятся секреция инсулина и глюкагона, пролиферация и апоптоз бета-клеток. Оптимальная стратегия заключается в применении минимально возможного количества препаратов, воздействующих на максимальное количество звеньев патогенеза. В частности, применение инкретин-направленной терапии в комбинации с метформином позволяет эффективно воздействовать на 10 из 11 известных патогенетических механизмов.
Немаловажная роль в поддержании гомеостаза глюкозы принадлежит центральной и периферической нервной системе. Установлено, что из-за дисбиоза кишечника передача инкретинового сигнала от рецепторов глюкагоноподобного пептида 1 (ГПП-1) нарушается. Это приводит к изменению функционирования нейронов слизистой оболочки кишечника. Микробиота кишечника регулирует обмен аминокислот, а также уровень нейротрансмиттеров (серотонина (5-НТ), оксида азота). Передача инкретинового сигнала опосредована оксидом азота, изменения в работе нейрональной синтазы оксида азота из-за недостатка аминокислот приводят к поломке оси «кишечник – центральная нервная система – бета-клетка» [3].
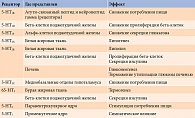
Достаточно большая доказательная база собрана о влиянии серотонинергических рецепторов на пищевое поведение, энергетический обмен и баланс гормонов. Пулы серотонина представлены в центральной и периферической нервной системе: серотонин не проникает через гематоэнцефалический барьер и играет роль ауто- и паракринного регулятора [4]. Однако стоит отметить, что, воздействуя на разные подтипы рецепторов, серотонин реализует разнонаправленные эффекты (табл.) [5].
Таким образом, контроль энергетического обмена может быть осуществлен как через центральные, так и через периферические серотониновые рецепторы.
Серотонин также необходим для глюкозозависимой секреции инсулина. Поэтому потеря соответствующих рецепторов приводит к нарушению толерантности к глюкозе, инсулинорезистентности, что в конечном итоге может обусловить развитие СД 2 типа [5]. Стимулирование соответствующих рецепторов, наоборот, обеспечивает гомеостаз глюкозы и восстановление чувствительности к инсулину [6, 7].
Серотонинергическая регуляция гомеостаза глюкозы связана с циркадианным ритмом. Мелатонин участвует в суточной регуляции метаболизма. Патологические ритмы его секреции зафиксированы при многих заболеваниях центральной нервной системы, в том числе при тревожно-депрессивных расстройствах [8].
У пациентов с СД 2 типа может формироваться десинхроноз серотонинергических процессов, что приводит к нарушению ауто- и паракринной функции серотонина как регулятора гомеостаза глюкозы [9]. Данный факт подтверждается тем, что мелатонин совместно с серотонином может опосредовать функцию инсулина [10] и его применение уменьшает инсулинорезистентность [11].
Дисбаланс серотонинергических процессов регуляции гоместаза на уровне центральной нервной системы, аутокринной и паракринной регуляции может объединять в единый конгломерат метаболические и психические нарушения. Так, J. Das-Munshi и соавт. (2007) выявили, что у больных СД тревожно-депрессивные нарушения встречаются практически в два раза чаще, чем в общей популяции. M. Collins и соавт. (2009) отметили высокие показатели тревожности и депрессии у 71% пациентов с СД. При этом выраженную тревожность наблюдали у 32%, депрессию – у 22,4% [12].
Метаболический синдром, алиментарное ожирение часто сопутствуют СД 2 типа. Результаты исследований свидетельствуют о наличии дисфункции регулирующих пищевое поведение нейромедиаторов, таких как серотонин, дофамин, норадреналин, у пациентов с расстройствами пищевого поведения [13, 14]. Поэтому применение препаратов, влияющих на серотонинергическую систему, при алиментарном ожирении оправданно. Среди эффектов серотонина на пищевое поведение выделяют уменьшение тяги к жирам и быстрым углеводам с сохранением потребления полноценных белковых продуктов [15]. Это является дополнительным преимуществом у пациентов с СД 2 типа, так как известно, что белковая пища, богатая аминокислотами (рыба, красное мясо, но не жирное), стимулирует ответ инкретинов. При этом необходимо избегать стимуляции экспрессии глюкозозависимого инсулинотропного полипептида, который у пациентов с СД 2 типа вместо инсулинотропного вызывает липотропный эффект. В то время как белок, поступивший в организм при употреблении морепродуктов (в частности, тунца), – ГПП-1 и, следовательно, вызывает глюкозозависимую секрецию инсулина [16].
Из всех фармакологических классов препаратов, влияющих на систему моноаминов, особого внимания заслуживает группа селективных ингибиторов обратного захвата серотонина (СИОЗС), одним из представителей которой является сертралин. Данный препарат характеризуется слабым воздействием на обратный захват других нейромедиаторов (норадреналина и дофамина). Он не повышает адренергическую активность, не оказывает антихолинергического или седативного действия и не является психостимулятором [17]. Это один из наиболее хорошо переносимых антидепрессантов. Отсутствие симпатомиметической активности позволяет избежать состояний гипергликемии.
При приеме сертралина 5-HT-рецепторы центра насыщения подвергаются стимуляции эндогенным серотонином, что приводит к своевременному насыщению и предотвращает избыточное поступление калорий [18]. При проведении метаанализа было установлено, что при исходно избыточной массе тела у пациентов с диабетом после назначения СИОЗС, в том числе сертралина, стабильно и статистически значимо снижался индекс массы тела [19]. В то же время получены данные о повышении массы тела и аппетита у пациентов без метаболических нарушений (ожирения, метаболического синдрома и СД 2 типа) в анамнезе [20].
Кроме того, в эксперименте показано, что сертралин способен улучшить морфологию и выживаемость островковых клеток при аллоксановом диабете, снизить уровень глюкозы плазмы и гликированного гемоглобина, а также повысить содержание С-пептида, корректировать инсулинорезистентность [21].
У большинства пациентов, принимавших современные СИОЗС, в том числе сертралин, не отмечено клинически значимого увеличения массы тела [22]. Более того, сертралин совместно с аллостерическим модулятором 5-HT2c-рецепторов оказывал мощный терапевтический эффект в отношении ожирения [23].
Необходимо отметить, что увеличение массы тела на фоне применения психотропных препаратов, в том числе сертралина, ассоциируется с полиморфизмом генов, ответственных за соответствующий фармакодинамический ответ на применение препаратов, и зачастую носит извращенный характер ввиду наследованной мутации [24].
Последнее время появились данные о высокой эффективности сертралина при хронических болевых синдромах. Это имеет принципиальное значение для фармакотерапии диабетической нейропатии, которая является частым осложнением СД [25].
Согласно результатам открытого рандомизированного клинического исследования, в отличие от плацебо применение сертралина в качестве дополнительной терапии увеличивало период времени без депрессии [26].
Соблюдение диеты – одно из условий достижения целевого уровня глюкозы в крови [27]. В то же время ужесточение контроля за рационом питания пациентов с СД 2 типа способно спровоцировать депрессивное расстройство, которое в дальнейшем потребует фармакологической коррекции. Подавленное состояние пациента снижает приверженность терапии. Это в свою очередь может препятствовать достижению целевой гликемии и ухудшить состояние больного [28].
Коррекция образа жизни зачастую носит кардинальный характер, поэтому необходимо поддерживать эмоциональный статус пациента для предотвращения развития и прогрессирования тревожно-депрессивных расстройств [29].
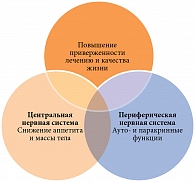
Таким образом, применение сертралина при СД 2 типа может способствовать (рис.) [30]:
- снижению массы тела и потребления углеводов;
- улучшению секреции инсулина и снижению инсулинорезистентности;
- преодолению депрессии и повышению качества жизни пациентов;
- сохранению приверженности схемам лечения;
- повышению эффективности ряда препаратов, например метформина.
Yu.A. Sorokina, A.V. Zanozin, L.V. Lovtsova, O.V. Zanozina
Privolshsky Research Medical University, Nizhny Novgorod
Narcological Hospital, Nizhny Novgorod
Contact person: Olga Vladimirovna Zanozina, zwx2@mail.ru
Disturbance of serotonergic processes of glucose homeostasis control, as well as eating behavior incorporates anxiety-depressive disorders and metabolic disorders, including obesity and type 2 diabetes. Dietary control, side effects of the chosen therapy can provoke a depressive disorder that will require pharmacological correction, and also reduces adherence to therapy, which prevents the achievement of target levels of glycaemia. In consistence with literature data, sertraline can help to better control weight and carbohydrate intake to achieve target glycaemia, improve the quality of life of patients, normalize eating behavior, and potentially reduce insulin resistance and apoptosis of pancreatic beta cells.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.