Значение антиоксидантов в комплексной терапии сахарного диабета типа 2: роль дигидрокверцетина
- Аннотация
- Статья
- Ссылки




По определению J.M. Reaven (17), сахарный диабет типа 2 (СД типа 2) – «хроническое, неизлечимое, прогрессирующее заболевание», течение которого осложняется развитием специфических сосудистых осложнений, так называемых микроангиопатий, и бурным прогрессированием атеросклероза, приводящего к сердечно-сосудистой летальности больных СД типа 2 в 4-5 раз чаще, чем в общей популяции. Тяжесть СД типа 2 с течением времени усугубляется не только прогрессированием микро- и макроангиопатий, но и нарастанием инсулиновой недостаточности, приводящей к необходимости заместительной инсулинотерапии. По статистическим данным, ежегодно 5-10% больных СД типа 2 нуждаются в переводе на инсулинотерапию, т.е. уже через 10-20 лет от начала болезни каждый больной СД типа 2 нуждается в инсулине. В 2007 г. общие расходы на лечение диабета в мире составили около 232 млрд долларов. Ожидается, что эта цифра будет расти по мере развития пандемии диабета и к 2025 г. достигнет 303 млрд долларов.
Патогенез СД типа 2, по современным представлениям, обусловлен двумя ключевыми нарушениями:
- развитием инсулинорезистентности периферических тканей-мишеней;
- неадекватной секрецией инсулина, необходимой для преодоления барьера инсулинорезистентности.
Оба эти дефекта взаимоусиливают друг друга: за счет компенсаторной гиперинсулинемии усугубляется инсулинорезистентность, за счет снижения чувствительности к инсулину возрастает потребность в секреции инсулина (10). Развивающаяся в итоге гипергликемия, вызывающая окислительный стресс за счет аутоокисления глюкозы, приводит к повреждению фосфолипидного слоя плазматических мембран тканей-мишеней и b-клеток, способствуя прогрессированию инсулинорезистентности и снижению секреторных возможностей инсулярного аппарата вследствие апоптоза b-клеток. Уменьшая выраженность окислительного стресса с помощью антиоксидантной терапии, теоретически можно не только замедлить прогрессирование диабетических сосудистых осложнений и инсулиновой недостаточности, но и снизить инсулинорезистентность, способствуя тем самым лучшей компенсации углеводного обмена.
Многочисленные исследования посвящены изучению ангиопротекторных и антиоксидантных свойств природных флавоноидов, в том числе и при диабетической микро- и макроангиопатии (11, 18). Исследованиями J. Robak и R.J. Gryglewsky (1988) было показано, что природные флавоноиды оказывают более выраженное действие, чем антиоксиданты нефлавоноидной природы, так как не только «улавливают» свободные радикалы кислорода, его так называемые «активные формы», но и благоприятно влияют как на сосудистую стенку, так и на систему гемостаза (18). Отсюда понятен тот огромный интерес, который проявляется сегодня к природным флавоноидам, в частности к изучению их ангиопротекторных свойств.
Флавоноиды являются полифенолами растительного происхождения. Особенности их антиоксидантного действия состоят в том, что они могут инактивировать не только гидроперекисный (LО2) и алкоксильный (LО) липидные радикалы, но и супероксидный анион-радикал (О2) (12). Наличие антирадикальных свойств у экстрактов некоторых растений основано на том, что химическая структура флавоноидов содержит ароматическое кольцо и присоединенные к нему ОН-группы, которые способны тормозить процессы ПОЛ на стадии кислородной инициации и передачи электронов с одной активной формы на другую (16).
Дигидрокверцетин (Диквертин) – ДКВ – новый отечественный патентованный препарат, представляющий собой 3,3,4,5,7-пентагидроксифлавон, который получают из измельченной древесины лиственницы сибирской (Larix cibirica L). По химическому строению ДКВ является соединением, родственным кверцетину, но значительно более активным. Он представляет собой его гидрированный по гетероциклическому фрагменту аналог. ДКВ по своим химическим свойствам является мощным антиоксидантом (8), т. е. веществом, связывающим свободные радикалы. В работе В.К. Колхира и соавт. (3) выявлены также капилляропротекторные и антиоксидантные свойства ДКВ (превосходящие в ряде случаев эффект кверцетина), сочетающиеся с противовоспалительным, гастро- и гепатопротекторным, гиполипидемическим и диуретическим действием (3). Вероятно, он обладает прямой антирадикальной активностью преимущественно за счет взаимодействия с липидными радикалами.
В то же время ДКВ, как и кверцетин, является скавенжером супероксидных анионов (8). Как вещество, обладающее высокой степенью биологической активности, ДКВ оказывает целую гамму положительных эффектов на обменные реакции и динамику различных патологических процессов. Его способность снижать содержание в крови липопротеидов низкой плотности (ЛПНП) (11) позволяет рассматривать производные ДКВ как средства профилактики и лечения атеросклероза. Отмечена способность препарата ингибировать окисление липосомальной мембраны из яичных фосфолипидов, индуцированное сульфатом железа или системой Fе2+-аскорба, причем антиокислительная активность ДКВ сравнима с активностью a-токоферола. Установлено также, что таксифоллин – аналог ДКВ – ингибировал активные радикалы в хрусталике крыс, а также накопление сорбитола в эритроцитах у человека (11).
Ранее нами продемонстрирована способность природного биофлавоноида ДКВ подавлять активность процессов перекисного окисления липидов в мембранах эритроцитов и тромбоцитов пациентов с СД типа 2, что проявлялось в снижении содержания малонового диальдегида (МДА) в клеточной мембране, повышением активности ключевых антиоксидантных ферментов супероксиддисмутазы, каталазы и глутатионпероксидазы в эритроцитах, снижением аггрегационой активности тромбоцитов, связанной с уменьшением содержания кальция в кровяных пластинках и продукции тромбоксана (7). Применение ДКВ в комплексной терапии пациентов с СД типа 2 способствовало снижению активности Na+/H+-обменника в эритроцитарной мембране и повышению продукции NO, определяемой по уровню нитритов и нитратов в плазме крови (1, 2). Все это убедительно доказывает положительное влияние ДКВ на функциональную активность форменных элементов, реологию крови и на эндотелиальную дисфункцию при СД, что способствует замедлению прогрессирования диабетических сосудистых осложнений, как это было показано нами на примере диабетической препролиферативной ретинопатии у пациентов с СД типа 2 (2).
Однако наибольший эффект применения ДКВ в сравнении с другими антиоксидантами проявился значимым снижением уровня HbA1c на 7% от исходного (p < 0,05) без изменения дозы сопутствующей сахаропонижающей терапии (7).
Все вышеизложенное побудило нас исследовать возможные эффекты действия ДКВ на чувствительность к инсулину и секреторные возможности инсулярного аппарата, сопоставив их с антиоксидантной активностью препарата.
Целью настоящего исследования явилось изучение влияния ДКВ на оксидантный статус и течение диабетической ретинопатии у больных СД типа 2.
В исследование было включено 40 предварительно компенсированных (Hb A1c – 6,69 ± 0,2%) пациентов (16 мужчин и 24 женщины) в возрасте 56,2 ± 8,5 лет с длительностью СД 0,4 ± 0,12 лет, индексом массы тела 33,3 ± 6,3 кг/м2. Случайным образом пациентов рандомизировали либо в группу, получавшую дополнительно к пероральной сахаропонижающей терапии (метформин в суточной дозе 2000-2500 мг) ДКВ в суточной дозе 120 мг в течение 12 нед., либо в группу сравнения, не получавшую антиоксидантной терапии. В качестве контроля обследовали 20 здоровых добровольцев, сопоставимых по возрасту, без указаний на нарушение толерантности к углеводам и наличие сахарного диабета у родственников.
До начала и в конце исследования контролировали Hb A1c на приборе «DCA 2000 Analyzer» (Bayer) методом латексного ингибирования иммуноагглютинации с помощью Hemoglobin A1c Reagent Kit. Липиды сывортки крови определяли ферментативным методом с помощью наборов «Берингер-Манхайм». Содержание вторичного продукта свободнорадикального окисления липидов – МДА – в ЛПНП определяли по реакции с 2-тиобарбитуровой кислотой при 532 нм на приборе «Hitachi-557» (4).
Для оценки чувствительности к инсулину до начала и после курса антиоксидантной терапии мы использовали расчетные математические модели HOMA-IR (Homeostasis Model Assessment) (15) и ISI (Insulin Sensitivity Index) (14), которые, по мнению большинства исследователей, наиболее четко корреллируют с «золотым стандартом» в оценке инсулиновой чувствительности – «euglycemic clamp technic» (9).
Для оценки секеторных возможностей инсулярного аппарата использовали индекс базальной секреции инсулина – ISecrHOMA (15) и индекс высвобождения инсулина – InsulinoGenicIndex (IGI), определяемый по отношению площади под кривой инсулинового ответа к площади под кривой колебаний гликемии в ходе перорального глюкозо-толерантного теста (14). Уровень иммунореактивного инсулина (ИРИ) определяли путем радиоиммунологического анализа с помощью наборов «Иммунотек» (Венгрия).
Статистическая обработка результатов производилась на компьютере с использованием специального статистического пакета SPSS версии 9.0 (SPSS inc. США). Для определения достоверности различий между сравниваемыми группами использовался t-критерий Стьюдента. Достоверность динамических изменений исследуемых параметров до и после лечения определяли с помощью непараметрических методов вариационного анализа (критерий Вилкоксона). Различия считались достоверными при р < 0,05. Все средние значения в таблицах представлены в виде М ± m.
Как указывалось выше, больные включались в исследование только при условии стабильного достижения удовлетворительной компенсации углеводного и липидного обмена в соответствии с критериями European Diabetes Policy Group (1998). Вместе с тем, как видно из таблицы 1, несмотря на удовлетворительные показатели углеводного и липидного обмена у больных СД типа 2 сохраняется дислипидемия, проявляющаяся гиперхолестеринемией и гипертриглицеридемией, наряду с повышением содержания ЛПНП и снижением уровня липопротеидов высокой плотности (ЛПВП) по сравнению с таковыми у доноров (p < 0,001). Назначение природных флавоноидов приводило к достоверному снижению МДА в липопротеидах плазмы и снижению содержания холестерина (ХС) и триглицеридов (ТГ) практически до уровня контроля (таблица 1).
Выявленная нами нормализация липидного спектра крови, проявившаяся в достоверном снижении ХС, ТГ и повышении уровня ЛПВП на фоне снижения уровня ЛПНП (p < 0,05) свидетельствует о гиполипидемическом действии препарата, что подтверждает данные (12), выявившие снижение содержания ЛПНП в плазме крови и печени крыс под действием ДКВ. Известно, что при окислительном стрессе свободнорадикальное окисление липидов, ведущее к накоплению липопероксидов, ингибирует ключевой фермент катаболизма ХС в печени – микросомальную 7a-гидроксилазу (5), что нарушает ферментативную регуляцию катаболизма ХС и должно приводить к поддержанию его стабильно высокого уровня в крови. В этих условиях гепатоциты могут секретировать в кровяное русло липопротеиды очень низкой плотности (ЛПОНП), включающие в себя окисленные ЛПНП, которые подвергаются окислительной деструкции с образованием МДА. Возможно, что блокирование свободнорадикального окисления липидов с помощью флавоноидов, что проявляется значимым снижением образования МДА, снимает токсическое действие липопероксидов на печеночную 7a-гидроксилазу и тем самым способствует повышению катаболизма ХС и увеличению уровня ЛПВП, а также снижению печеночной продукции ЛПОНП.
При лечении пациентов, страдающих СД типа 2, ДКВ было получено достоверное снижение HbA1c с 6,69 ± 0,15% до 6,124 ± 0,096% (p < 0,01), сопровождавшееся улучшением гликемического контроля по данным базальной и постпрандиальной гликемии, что может быть обусловлено снижением продукции активных форм кислорода при компенсации углеводного обмена и, как следствие, уменьшением образования конечных продуктов неферментного гликирования, к которым относится и HbA1c. Вместе с тем, снижение базальной гликемии без изменения дозы сопутствующей сахаропонижающей терапии, как показано в таблице 2, предполагает повышение чувствительности периферических тканей и, в первую очередь – печени, к циркулирующему инсулину, что и обуславливает, по нашему мнению, снижение глюконеогенеза и базальной гликемии.
Исходя из этого предположения, мы рассчитали чувствительность к инсулину 2 методами – HOMA-IR и ISI (14, 15). Чтобы исключить вариабельность изменений, оценку чувствительности к инсулину провели одновременно с пероральным глюкозо-толерантным тестом, на фоне которого пациенты продолжали прием базовой сахаропонижающей терапии.
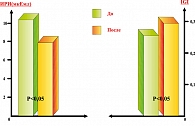
Как видно из представленных в таблице 2 данных, было получено достоверное снижение индекса инсулинорезистентности (IR) по модели HOMA с 3,05 ± 0,39 до 1,61 ± 0,25 (р < 0,005) и повышение индекса чувствительности к инсулину ISI с 87,3 ± 14,1 до 128,2 ± 24,1(p < 0,05). В параллельно оцениваемой группе сравнения мы таких изменений не обнаружили (рисунок 1).
В целях подтверждения взаимосвязи выраженности окислительного стресса и инсулинорезистентности мы провели корреляционный анализ между уровнем вторичного продукта ПОЛ – МДА в ЛПНП и индексом инсулинорезистентности HOMA-IR. Выявлена прямая корреляция между ними (r = 0,755 , p < 0,005). Таким образом, снизив проявления окислительного стресса с помощью антиоксиданта флавоноидного ряда ДКВ, мы одновременно получили и снижение инсулинорезистентности, достоверно коррелирующее со снижением выраженности окислительного стресса.
В группе пациентов, получавших ДКВ в комбинации с препаратами сульфонилмочевины, отмечено достоверное снижение Hb A1c на 7% от исходного (p < 0,05) без изменения дозы сопутствующей сахаропонижающей терапии. Механизм положительного влияния ДКВ на углеводный обмен может быть связан со снижением инсулинорезистентности периферических тканей, выявленной нами при расчете индекса инсулинорезистентности HOMA, что косвенно подтверждается и снижением индекса базальной секреции инсулина, рассчитанным по этому методу. Вместе с тем нам показалось интересным определить действие антиоксиданта флавоноидного ряда ДКВ на секреторные возможности инсулярного аппарата. С этой целью пациентам, достигшим компенсации углеводного обмена на фоне приема метформина, мы провели пероральный глюкозо-толерантный тест с определением концентрации инсулина исходно (натощак) и через 1 и 2 часа после приема глюкозы.
После проведения теста пациентам был назначен ДКВ в суточной дозе 120 мг. Через 3 мес. приема ДКВ тестирование повторили с определением уровня гликемии и инсулинемии в те же временные интервалы. Как видно из таблицы 3 и рисунка 2, после 3-месячного курса ДКВ было достигнуто достоверное повышение (р < 0,05) стимулированной секреции инсулина, выраженной в относительных процентах по сравнению с базальным уровнем ИРИ. При этом уровень базальной инсулинемии снизился (p < 0,05) по сравнению с исходным, что свидетельствует о снижении инсулинорезистентности периферических тканей. При расчете индекса высвобождения инсулина, определяемого по отношению площади под кривой инсулинового ответа (AUCинс) к площади под кривой изменения гликемии (AUCглюк) в ходе перорального глюкозо-толерантного теста, мы получили достоверное повышение индекса высвобождения инсулина (IGI) (p < 0,01).
В целях выяснения возможной взаимосвязи окислительного стресса и функционального состояния β-клетки, оценивалась корреляция улучшения секреторных возможностей инсулярного аппарата по относительному проценту возрастания уровня ИРИ на пике всасывания глюкозы (через 1 ч) со снижением выраженности окислительного стресса (определялась по уровню вторичного продукта ПОЛ – МДА в ЛПНП плазмы на фоне применения ДКВ). Полученная нами обратная корреляция (r = –0,411, p < 0,05) между процентом прироста ИРИ и снижением МДА свидетельствует, на наш взгляд, о положительном влиянии применения ДКВ на секреторные возможности инсулярного аппарата вследствие удаления активных форм кислорода и снижения таким образом появлений окислительного стресса, ведущего к апоптозу β-клеток.
Возможным механизмом утилизации кислородных радикалов является способность гидроксильного соединения флавоноидов отдавать атом водорода и связывать более токсичные соединения, нейтрализуя их (6).
Фенольными антиоксидантами принято называть любые соединения Ar(OH)n, в которых одна или несколько гидроксильных групп (ОН) соединены с ароматическим ядром (Ar); при этом молекулы могут содержать несколько фрагментов Ar(OH)n. Анализ сравнительной активности флавоноидов показал (16) важность наличия 2 гидроксильных групп в ортоположениях в В-кольце и гидроксильной группы в позиции С-3. У нового флавоноида ДКВ присутствуют гидроксильные группы в этих положениях.
По существу, в реакции АrOH + RO2 →Ar O2 + ROOH не исчезает свободная валентность, а лишь гидропероксидный радикал RO2 заменяется феноксильным ArO2, однако при этом достигается эффект ингибирования свободнорадикального окисления, обусловленный большей стабильностью ArO2, который практически не участвует в продолжении цепей окисления. Флавоноиды могут восстанавливать активность L-токоферола, отдавая атом водорода L-токоферольному радикалу (6), последний формируется, когда отдает свой собственный атом водорода из гидроксильной группы пероксильному радикалу, прерывая таким образом цепочку ПОЛ. Возможным механизмом действия флавоноидов может быть хелация ионов металлов Fe и Cu.
Наши данные совпали с данными ряда авторов (13) и могут свидетельствовать о том, что полигидроксилированные агликоновые флавоноиды являются мощными ингибиторами ПОЛ, что еще раз подчеркивает значение гидроксильной группы во флавоновом ядре. Гидроксильная группа в 7-м положении диссоциирует первой и является главным местом атаки пероксильным радикалом (6, 13). В составе ДКВ есть гидроксильная группа в 7-й позиции.
Обобщая полученные данные, можно сделать вывод о несомненных антиоксидантных свойствах отечественного биофлавоноида ДКВ, при применении которого снижается риск прогрессирования диабетических ангиопатий, улучшаются гликемический контроль и чувствительность к инсулину. Включение в комплексную терапию антиоксиданта ДКВ способствовало повышению секреторных возможностей инсулярного аппарата, что позволяет надеяться на сохранение остаточной секреции инсулина при длительном применении антиоксидантной терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.