Особенности лечения артериальной гипертонии у пациентов с метаболическим синдромом и сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки


В настоящее время признаки МС имеются у 10–25% населения промышленно-развитых стран, и прогнозируется рост его распространенности. Наличие МС в 2–4 раза повышает риск развития сердечно-сосудистых заболеваний (CCЗ) и смертности, а риск сахарного диабета (СД) типа 2 повышается в 5–9 раз.
Одним из основных требований, предъявляемым к антигипертензивным препаратам для лечения больных с МС, является их метаболическая нейтральность [2]. Учитывая важную роль МС в развитии ССЗ и смертности, наличие антигипертензивных препаратов, способных улучшать инсулинорезистентность и снижать выраженность инсулинорезистентности, имело бы высокую клиническую ценность.
Блокаторы рецепторов ангиотензина II (БРА) являются одним из самых современных классов антигипертензивных лекарств. Механизм антигипертензивного действия БРА заключается в селективной блокаде рецепторов ангиотензина II 1-го типа. Такое воздействие на ренин-ангиотензин-альдостероновую систему (РААС) позволяет достигнуть наиболее специфичной и поэтому полной ее блокады [3]. Не так давно было обнаружено, что образование ангиотензина (АТ) II может осуществляться, помимо основного пути, в котором ключевую роль играет ангиотензин-превращающий фермент (АПФ), и другими способами, в которых участвуют химаза, химотрипсин-чувствительный АТ II продуцирующий энзим, катепсин G, тканевой активатор плазминогена, тонин. Поэтому ингибирование АПФ не приводит к полной блокаде РААС, в то время как воздействие на рецепторы, через которые осуществляется действие АТ II, позволяет практически полностью блокировать действие этого гормона [4].
Кроме того, при селективной блокаде рецепторов АТ II 1-го типа, активация которых вызывает такие «вредные» эффекты как вазоконстрикция, задержка жидкости, повышение симпатической активности и усиление клеточного роста, циркулирующий АТ II, продуцируемый в повышенной концентрации, взаимодействует с рецепторами АТ II 2-го типа, стимуляция которых, как было недавно установлено, приводит к активации антипролиферативных процессов и ингибированию клеточного роста, апоптоза, дифференциации и вазодилятации, что может еще более усиливать гипотензивный эффект данного класса препаратов [5].
Еще одно отличие БРА от ингибиторов АПФ – они не влияют на брадикининовую систему, поэтому для них нехарактерны такие побочные эффекты как сухой кашель и ангионевротической отек, возникновение которых связывают с повышенным уровнем брадикинина.
Очевидные преимущества БРА – высокая гипотензивная активность и хорошая переносимость – были причиной того, что и в национальных, и в зарубежных рекомендациях по лечению АГ они были включены в число лекарств первого ряда для лечения АГ еще до того, как завершились крупномасштабные исследования.
Результаты уже завершившихся исследований позволили определить место БРА в лечении больных с АГ, в том числе при наличии МС и СД типа 2. Нет сомнений, что данный класс антигипертензивных препаратов за счет своей высокой эффективности, безопасности и выраженных органопротективных способностей является одним из основных в лечении данной категории пациентов.
Препаратом, выгодно выделяющимся в группе БРА, является ее представитель телмисартан. Его эффективность и влияние на прогноз у пациентов с высоким сердечно-сосудистым риском (ССР) изучалась, в частности, в исследовании ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial). Это рандомизированное двойное слепое многоцентровое международное исследование, где телмисартан сравнивался с «золотым стандартом» антигипертензивных препаратов – ингибитором АПФ рамиприлом, а также оценивалась эффективность комбинации телмисартана и рамиприла. В ходе исследования ONTARGET было доказано, что терапия телмисартаном не уступает терапии рамиприлом по влиянию на уровень артериального давления (АД) и другие изученные в исследовании параметры, а также эффективно снижает риск сердечно-сосудистых осложнений (ССО). Важным отличием телмисартана была его хорошая переносимость, превосходящая таковую в группе монотерапии рамиприлом и, особенно, при назначении комбинации ИАПФ и БРА. Именно благодаря этому исследованию телмисартан был особо отмечен в Российских рекомендациях по лечению АГ.
Помимо блокады рецепторов АТ II 1-го типа, телмисартан – единственный препарат из класса БРА – способен действовать как частичный агонист PPAR-γ [6, 7].
Большое число исследований показало, что PPAR-γ рецептор играет важную роль в регуляции углеводного и липидного обмена, а лиганды PPAR-γ могут улучшать чувствительность к инсулину, снижать уровень триглицеридов. Стимуляция PPAR-γ приводит к повышению секреции адипонектина – недавно обнаруженного гормона жировой ткани адипоцитокина, способного потенцировать действие инсулина. Было обнаружено, что гипоадипонектинемия приводит к ИР у пациентов с АГ, а также у больных с СД типа 2 и ожирением. Лиганды PPAR-γ обладают также небольшим антигипертензивным эффектом, частично связанным с их способностью вызывать периферическую вазодилятацию.
Некоторые тиазолидиндионовые лиганды PPAR-γ, являющиеся полными агонистами данного вида рецепторов, утверждены для лечения СД 2 типа, однако эти препараты мало способны снижать АД и способствуют задержке жидкости, повышению веса, отекам и сердечной недостаточности у значительного числа пациентов с диабетом. Эти побочные эффекты также могут развиваться при применении и нетиазолидиндионовых PPAR-γ и, скорее всего, не связаны с тиазолидиндионовым компонентом.
Тиазолидиндионы (TЗД) – относительно новый класс препаратов, действие которых направлено на снижение ИР в тканях, главным образом мышечной и жировой. ТЗД являются высокоафинными агонистами ядерных рецепторов, активируемых пероксисомальным пролифератором типа гамма (PPAR-γ). В клинических исследованиях было показано, что эти препараты способны снижать уровень глюкозы крови как натощак, так и постпрандиальной, а также снижать уровень инсулина крови.
Несмотря на доказанную эффективность и широкое применение, эти препараты имеют определенные побочные эффекты, такие как прибавка веса и периферические отеки [8]. Увеличение веса при применении TЗД обусловлено несколькими факторами. Основной причиной является повышение массы жировой ткани вследствие повышения дифференциации адипоцитов и накопления липидов.
В некоторых исследованиях действительно было показано, что повышение веса при терапии TЗД сопровождается увеличением массы подкожной жировой клетчатки и снижением или неизменной массой висцерального жира. Кроме того, терапия TЗД часто сопровождается повышением объема плазмы [8] по причине прямого влияния на собирательные трубочки с повышением реабсорбции натрия и воды, что является еще одной потенциальной причиной увеличения массы тела.
Одним из препаратов группы ТЗД, действие которого направлено на ключевые звенья патогенеза МС – ИР и функцию β-клеток, является росиглитазон. Он снижает ИР периферических тканей, в большей степени на уровне мышечной и жировой тканей, чем на уровне печени. Активация PPAR-γ рецепторов приводит к снижению экспрессии гена лептина, уменьшает уровень фактора некроза опухолей-α (ФНО-α), который повышает инсулинорезистентность и подавляет секрецию инсулина β-клетками. Дополнительными механизмами действия росиглитазона являются влияние на экспрессию генов-переносчиков глюкозы (в частности GLUT-4), а также стимуляция дифференцировки преадипоцитов в адипоциты, которые обладают большей чувствительностью к инсулину.
Помимо этого, данный препарат усиливает секрецию адипонектина, обладающего кардиопротективными свойствами, и снижает синтез ингибитора активатора плазминогена 1 (PAI-1) и резистина. На фоне его приема уменьшается выраженность микроальбуминурии, умеренно снижается АД. Препараты данной группы оказывают также протективное действие в отношении β-клеток, что может быть связанно не только со снижением липотоксического действия свободных жирных кислот (СЖК), но и непосредственного воздействия ТЗД на процессы апоптоза [9].
Телмисартан, в отличие от тиазолидиндионов, и, в частности, от росиглитазона, действует как частичный агонист PPAR-γ, обладая примерно 30% от максимальной активности полного агониста росиглитазона [10]. Между телмисартаном и росиглитазоном существует различие в механизме связывания с рецепторами. Телмисартан, как и другие частичные агонисты PPAR-γ, не вступает в прямой контакт с активирующим участком (AF-2) [11, 12]. Взаимодействие с AF-2 участком, приводящее к стабилизации и активации рецепторов, характерно для полных агонистов [13]. Телмисартан не взаимодействует с AF-2, что, по-видимому, объясняет его неспособность полностью активировать PPAR-γ рецепторы. Разное связывание с PPAR-γ приводит к различиям в экспрессии генов, в том числе и в адипоцитах. В отличие от росиглитазона, телмисартан приводит к снижению индукции генов, участвующих в транспорте жирных кислот и накоплении триглицеридов. Кроме того, существуют данные о том, что частичные агонисты являются более слабыми стимуляторами и даже ингибиторами адипогенеза [14].
На базе Отдела системных гипертензий НИИ клинической кардиологии им. А.Л. Мясникова РК НПК МЗ РФ мы провели собственное исследование, в задачи которого входило изучение в сравнении влияния телмисартана и росиглитазона на показатели суточного профиля АД, чувствительности к инсулину, углеводного и липидного обмена у больных с МС и АГ I–II степени.
Материалы и методы
В исследование были включены 40 пациентов с МС и мягкой и умеренной АГ. После предварительного скрининга пациенты методом конвертов были поделены на 2 группы по 20 больных в каждой: I группа в течение 24 недель в виде монотерапии получала телмисартан в дозе 80 мг/сут, II группа – росиглитазон по 4 мг/сут.
Соотношение мужчин и женщин в группах телмисартана и росиглитазона составило соответственно 8/12 и 7/13. Средний возраст пациентов, принимавших телмисартан, был 44,2 ± 14,25, росиглитазон – 39,55 ± 12,04. Давность АГ в обеих группах составила 5,1 ± 2,7 и 4,65 ± 2,87 соответственно. У всех пациентов, принимавших участие в исследовании, имело место ожирение по абдоминальному типу разной степени выраженности. Средняя масса тела составляла 95,13 ± 10,9 кг, ИМТ 33,2 ± 3,85 кг/м² и ОТ 109,3 ± 6,8 см. Клиническое САД у пациентов группы телмисартана зафиксировано на уровне 158,56 ± 10,78 мм рт. ст., ДАД 103,11 ± 6,7 мм рт. ст. В группе росиглитазона эти показатели составили 134,71 ± 8,22 мм рт. ст. и 91,21 ± 8,14 мм рт. ст. соответственно. Причем в подавляющем большинстве случаев до лечения отмечалась недостаточная степень ночного снижения уровня как систолического (САД), так и диастолического АД, что является характерной особенностью МС.
У большинства пациентов было выявлено нарушение толерантности к углеводам, у остальных – гипергликемия натощак. До начала терапии у всех 40 пациентов показатели чувствительности к инсулину соответствовали выраженной резистентности периферических тканей к инсулину. У абсолютного большинства больных также отмечалась разной степени выраженности дислипидемия.
До начала исследования и через 24 недели терапии у пациентов собирали полный анамнез, проводили физикальный осмотр и антропометрическое обследование: измерение роста, массы тела, окружности талии (ОТ). Индекс массы тела (ИМТ) рассчитывался по формуле Кетле. Проводили биохимическое исследование венозной крови (общий холестерин (ХС), ХС липопротеидов низкой плотности (ЛПНП), ХС липопротеидов высокой плотности (ЛПВП), триглицеридов (ТГ), глюкоза, мочевая кислота). Для оценки толерантности к глюкозе использовался стандартный пероральный тест толерантности к глюкозе с определением уровней глюкозы, эндогенного инсулина и С-пептида. Исходно и через 24 недели терапии пациентам также проводилась оценка ИР с использованием инсулин-модифицированного теста толерантности к внутривенно вводимой глюкозе (ВВГТТ). Помимо этого изучался уровень таких гормонов как грелин, резистин, адипонектин. АД измеряли клиническим методом Короткова и проводили суточное мониторирование АД (СМАД).
Результаты и обсуждение
К окончанию исследования у большинства пациентов на фоне терапии телмисартаном отмечалось снижение массы тела и выраженности абдоминального ожирения. Масса тела и ИМТ достоверно снизились по сравнению с исходными значениями в среднем с 92,75 ± 11,03 кг до 90,15 ± 11,57 кг (р < 0,05) и с 33,02 ± 3,48 кг/м2 до 32,08 ± 3,47 кг/м2 (р < 0,05) соответственно. Также значимо уменьшился ОТ – с 107,95 ± 6,82 см до 105,55 ± 7,3 см (р < 0,05). Снижение массы тела и ОТ отмечалось у 14 (70%) больных, принимавших телмисартан. При этом на протяжении всего исследования пациенты не использовали специальных гипокалорийных диет и препаратов для снижения массы тела.
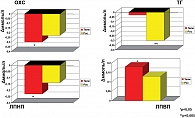
На фоне терапии росиглитазоном не было выявлено достоверной динамики средних показателей массы тела (исходно 95,18 ± 8,99 кг и через 24 недели 95,82 ± 8,68 кг), ИМТ (исходно 31,62 ± 2,09 кг/м2 через 24 недели 31,75 ± 2,04 кг/м2) и ОТ (исходно 105,45 ± 7,78 и через 24 недели 104,91 ± 8,14 см). У 80% пациентов отмечалось небольшое повышение массы тела и соответственно ИМТ (рис. 1).
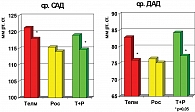
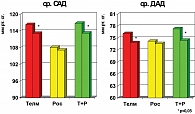
Терапия телмисартаном больных АГ с МС вызвала достоверное снижение практически всех средних показателей суточного профиля АД. Целевого уровня АД достигли 80% больных данной группы.
В данной работе у больных с МС и АГ, получавших монотерапию росиглитазоном, не отмечалось выраженного гипотензивного эффекта, хотя и было небольшое снижение клинического АД и снижение показателей нагрузки давлением по результатам СМАД. В целом целевых уровней АД достигли 15% пациентов этой группы (рис. 2, 3).
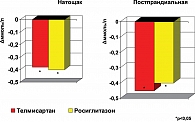
В результате терапии телмисартаном у пациентов с МС и АГ отмечалось существенное улучшение показателей углеводного обмена. Уровень глюкозы в крови натощак снизился в среднем с 5,33 ± 0,52 ммоль/л до 4,95 ± 0,56 ммоль/л (p < 0,01) и постпрандиальный уровень глюкозы с 6,08 ± 1,4 ммоль/л до 5,63 ± 0,97 ммоль/л (p < 0,01).
У большинства пациентов этой группы исходные уровни иммуно-реактивного инсулина (ИРИ) как натощак, так и постпрандиального были выше нормы (N < 12,5 мкМЕ/мл) и составили в среднем 14,39 ± 6,32 мкМЕ/мл и 44,22 ± 53,41 мкМЕ/мл соответственно. На фоне 24 недель терапии телмисартаном отмечалось некоторое снижение концентрации ИРИ натощак в среднем до 13,24 ± 6,41 мкМЕ/мл и достоверное снижение его постпрандиального уровня, в среднем, до 26,95 ± 18,21 мкМЕ/мл (р < 0,05). Исходный уровень С-пептида составил в среднем 3,11 ± 0,89 нг/мл натощак и 4,23 ± 2,03 нг/мл после нагрузки глюкозой. На фоне 24 недель терапии телмисартаном отмечалось достоверное снижение уровня С-пептида натощак, в среднем, до 2,77 ± 0,97 нг/мл (р < 0,05) и незначительное снижение постпрандиального уровня, в среднем, до 3,79 ± 1,79 нг/мл.
На фоне терапии росиглитазоном отмечалось достоверное снижение глюкозы в плазме крови натощак с 5,56 ± 0,63 ммоль/л до 5,16 ± 0,6 ммоль/л (p < 0,05) и постпрандиального уровня глюкозы с 5,97 ± 0,98 ммоль/л до 5,59 ± 0,82 ммоль/л (p < 0,05). У подавляющего большинства пациентов в группе росиглитазона отмечалось исходное повышение уровня ИРИ натощак до 15,09 ± 6,5 мкМЕ/мл и постпрандиального уровня до 39,07 ± 4,84 мкМЕ/мл. На фоне 24 недель терапии росиглитазоном отмечалось достоверное снижение концентрации ИРИ натощак, в среднем, до 12,63 ± 5,8 мкМЕ/мл (р < 0,05), причем у 16 (80)% пациентов достигнут нормальный его уровень. Постпрандиальный уровень ИРИ на фоне лечения уменьшился также достоверно, в среднем, до 15,97 ± 6,79 мкМЕ/мл (р < 0,05). Исходный уровень С-пептида у пациентов группы росиглитазона составил, в среднем, 3,01 ± 0,67 нг/мл натощак и 2,95 ± 1,2 нг/мл после нагрузки глюкозой. У всех пациентов на фоне 24 недель терапии росиглитазоном отмечалось достоверное снижение уровня С-пептида натощак и после нагрузки до нормальных значений, в среднем до 2,72 ± 0,67 нг/мл (р < 0,05) и до 2,58 ± 0,95 нг/мл (р < 0,05) соответственно (рис. 4, 5).
По результатам внутривенного теста толерантности к глюкозе с помощью компьютерной программы «МИНМОД» Бергмана был рассчитан индекс SI, отражающий чувствительность периферических тканей к инсулину. Согласно полученным результатам, у 18 (90%) пациентов с МС выявлена ИР. Индекс SI у этих больных составил в среднем 1,46 ± 1,91 (min-1(мкЕдмл)-1). За нормальную чувствительность к инсулину принимались значения индекса SI = 4,0 - 8,0 x 10-4 min-1(мкЕдмл)-1. После 24 недель терапии телмисартаном отмечалось достоверное повышение SI в среднем до 3,28 ± 3,09 (min-1(мкЕдмл)-1) (р < 0,05). Необходимо отметить, что у 8 (40%) пациентов этой группы с исходно сниженным SI этот показатель повысился до нормы.
У почти 90% пациентов группы росиглитазона было выявлено снижение чувствительности периферических тканей к инсулину. Индекс SI у больных этой группы составил в среднем 2,27 ± 2,4 (min-1(мкЕдмл)-1). После 24 недель терапии росиглитазоном у всех пациентов с МС отмечалось достоверное повышение SI в среднем до 6,8 ± 1,93 (min-1(мкЕдмл)-1) (p < 0,05). В данной группе этот показатель повысился до нормы у 10 (50%) пациентов с исходно сниженным SI (рис. 6).
В группе пациентов с МС и АГ до исследования отмечалось выраженное запоздание пика первой фазы секреции (фазы быстрого высвобождения) инсулина (после 25 мин.). В результате терапии телмисартаном первая фаза секреции инсулина возникает в нормальном временном диапазоне (в первые 10 мин.), что сопровождается уменьшением гиперинсулинемии и гликемии. У пациентов, принимавших росиглитазон, исходно также отмечалось нарушение 1-й фазы секреции инсулина в виде отсутствия выраженного пика секреции и задержки во времени. Терапия росиглитазоном привела к восстановлению 1-й фазы секреции инсулина по времени и выраженности.
Таким образом, в обеих группах было отмечено достоверное повышение чувствительности периферических тканей к инсулину. Однако более существенно показатель чувствительности к инсулину повысился у больных, принимавших росиглитазон. Терапия росиглитазоном оказала более значительное позитивное влияние и на первую фазу секреции инсулина.
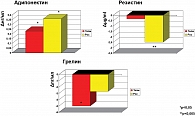
У больных группы телмисартана отмечалось достоверное уменьшение концентрации грелина в среднем со 22,94 ± 13,34 нг/мл до 17,94 ± 8,76 нг/мл (р < 0,02). Отмечалось значимое повышение уровня адипонектина (исходно 0,7 ± 0,52 кг/м2, после терапии 0,93 ± 0,57 кг/м2) (р < 0,02). У пациентов, принимавших росиглитазон, отмечалось достоверное уменьшение уровня резистина в среднем со 5,76 ± 2,3 нг/мл до 3,27 ± 1,4 нг/мл (р < 0,01). Отмечалось значимое повышение уровня адипонектина (исходно 0,77 ± 0,66 кг/м2, после терапии 1,13 ± 0,9 кг/м2) (р < 0,01) (рис. 7). Уровень грелина в обеих группах снизился незначительно (рис. 8).
На фоне терапии телмисартаном также отмечалось значимое улучшение показателей липидного обмена. У пациентов, принимавших телмисартан, было выявлено достоверное снижение показателей ОХС и ХС ЛПНП и повышение ХС ЛПВП. До начала исследования уровень ОХС составлял в среднем 5,68 ± 0,79 ммоль/л, через 24 недели терапии – 5,41 ± 0,71 ммоль/л (р < 0,01). Уровень ХСЛПНП до лечения телмисартаном составлял в среднем 3,48 ± 0,63 ммоль/л, а после его окончания достоверно снизился и составил 3,25 ± 0,45 ммоль/л (р < 0,05). Показатель ХС ЛПВП определялся в нормальном диапазоне как до лечения, так и после, при этом отмечалось достоверное его увеличение с 1,23 ± 0,24 ммоль/л до 1,36 ± 0,29 ммоль/л (р < 0,01). Уровень ТГ исходно не превышал нормальных значений (1,6 ± 0,7 ммоль/л) и значимо не менялся через 24 недели приема телмисартана (1,57 ± 0,35 ммоль/л) (см. рис. 7). Уровень мочевой кислоты у пациентов этой группы существенно не менялся, составляя до лечения 333 ± 99,79 мкмоль/л, а после – 315 ± 60,53 мкмоль/л.
В результате терапии росиглитазоном у пациентов с МС уровни ОХС и ХС ЛПНП несколько уменьшились, но их динамика была статистически недостоверна (ОХС с 5,57 ± 1,06 ммоль/л до 5,34 ± 0,88 ммоль/л, ХС ЛПНП с 3,45 ± 0,83 ммоль/л до 3,41 ± 0,7 ммоль/л). Уровень ТГ наоборот снизился достоверно, в среднем с 1,71 ± 0,9 ммоль/л до 1,41 ± 0,6 ммоль/л (р < 0,05). Уровень ХС ЛПВП до лечения составлял 1,31 ± 0,3 ммоль/л, после – 1,47 ± 0,38 ммоль/л. Уровень мочевой кислоты у пациентов этой группы также существенно не менялся, составляя до лечения 320 ± 55,77 мкмоль/л, а после лечения 308 ± 60,44 мкмоль/л.
Таким образом, в группе телмисартана улучшились такие показатели липидного обмена, как ОХС, ХСЛПНП и ХСЛПВП при этом уровень ТГ значимо не менялся. В группе росиглитазона достоверно снижался только уровень ТГ.
Выводы
- Терапия телмисартаном оказывает выраженное гипотензивное действие.
- На фоне приема телмисартана отмечается значимое снижение массы тела и ОТ, тогда как на фоне терапии росиглитазоном не было выявлено достоверной динамики средних показателей массы тела. Более того, у 80% пациентов отмечалось небольшое повышение массы тела и, соответственно, ИМТ и ОТ.
- Терапия телмисартаном вызвала достоверное уменьшение гиперинсулинемии, особенно значимо постпрандиальной. ГИ достоверно снизилась как на фоне терапии телмисартаном, так и росиглитазоном. В обеих группах было отмечено достоверное повышение чувствительности периферических тканей к инсулину и восстановление первой фазы секреции инсулина, более выраженное в группе росиглитазона.
- В группе телмисартана улучшились показатели ОХС, ХС ЛПНП и ХС ЛПВП, при этом уровень ТГ значимо не менялся. В группе росиглитазона достоверно снижался только уровень ТГ.
Таким образом, если большинство представителей АРА продемонстрировали метаболически нейтральное действие в отношении углеводного и липидного обмена у больных СД, то результаты нашего исследования с применением телмисартана у больных с МС установили, что он способен оказывать позитивное влияние на метаболические процессы. Эти эффекты телмисартана, вероятно, обусловлены его частичным агонизмом в отношении PPAR-γ рецепторов.
Результаты данного исследования являются еще одним доказательством обратимости изменений при МС. Терапия сахаропонижающим препаратом росиглитазоном и антигипертензивным телмисартаном вызвала не только существенное улучшение метаболизма углеводов и липидов, но и восстановление 1-й фазы секреции инсулина, то есть улучшение функции β-клеток поджелудочной железы, хотя хорошо известно, что нарушение 1-й фазы секреции инсулина у больных СД типа 2 отражает необратимое истощение функции β-клеток. В связи с этим представляется важным своевременное выявление и лечение МС с применением немедикаментозных и медикаментозных методов лечения, воздействующих на его основные патогенетические механизмы: ожирение, ИР, АГ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.