Прямой ингибитор ренина – алискирен: новые возможности антигипертензивной терапии при метаболическом синдроме
- Аннотация
- Статья
- Ссылки
Артериальная гипертония (АГ) является одним из проявлений совокупности метаболических отклонений, которые включают абдоминальное ожирение, характерную дислипидемию – низкое содержание липопротеидов высокой плотности (ЛПВП), высокое содержание липопротеидов низкой плотности (ЛПНП) и триглицеридов (ТГ), нарушенную толерантность к глюкозе, а также инсулинорезистентность (ИР) и гиперинсулинемию (ГИ), лежащих в основе МС. Известно, что при МС, даже без наличия АГ, отмечается субклиническое поражение органов-мишеней, особенно почек – микроальбуминурия (МАУ), снижение скорости клубочковой фильтрации (СКФ), сердца, сосудов. Присоединение АГ значительно усугубляет эти органные нарушения.
Сочетание АГ и ожирения особенно неблагоприятно сказывается на функционировании почек. Так, в международном проспективном исследовании, включавшем 20 828 поликлинических пациентов с АГ, было показано, что при сочетании этих двух заболеваний частота выявления МАУ возрастает примерно в 2 раза, чем в среднем по поликлинической популяции [1].
Уровень экскреции альбумина с мочой коррелирует не только с показателями индекса массы тела (ИМТ), но и с показателями окружности талии (ОТ) у пациентов с АГ. Даже при избыточной массе тела (ИМТ 25–29,9 кг/м2) частота МАУ превышает указанный показатель для средней популяции АГ и составляет 58,6%. Для пациентов с ожирением (ИМТ выше 30 кг/м2) показатель частоты выявляемости МАУ возрастает до 62,1% [1].
Учитывая большое значение активации РААС в патогенезе АГ у больных с ожирением, становится понятным, почему лекарственные препараты, влияющие на РААС, – ингибиторы ангиотензин-превращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (БРА), являются препаратами выбора для лечения АГ у этой группы пациентов. В последние годы появился препарат нового класса – прямой ингибитор ренина (ПИР) – алискирен, с отличным от ИАПФ и БРА влиянием на РААС. ИАПФ блокируют АПФ, БРА блокируют рецепторы к АТ II, а ПИР действуют на ренин, уменьшая плазменную активность ренина. Все эти группы препаратов снижают АД и предотвращают поражение почек, сердца и сосудов.
При назначении ИАПФ и БРА компенсаторно по механизму обратной связи повышается выброс ренина из почек, повышается плазменная активность ренина и порочный каскад запускается вновь. С этим связано ускользание эффекта на ИАПФ. Алискирен является единственным на сегодня селективным ПИР. Алискирен, связываясь с активным центром молекулы ренина, препятствует превращению ангиотензиногена в АТ I. Молекула алискирена является устойчивой, имеет непептидную структуру и высокое сродство к ренину человека. Алискирен действует в начальной точке активации РААС, уменьшая активность ренина плазмы и предотвращая образование АТ I из ангиотензиногена, порочный каскад не запускается и механизм обратной связи не активируется. Повышение плазменной активности ренина является доказанным независимым фактором риска сердечно-сосудистой смертности и осложнений.
В течение последних 15 лет в нескольких исследованиях доказано, что повышенная плазменная активность ренина связана с повышенным риском смертности и заболеваемости у пациентов с АГ, коронарным атеросклерозом и хронической сердечной недостаточностью (ХСН).
Благодаря такому уникальному механизму действия, алискирен уже был выделен в Российских рекомендациях по диагностике и лечению АГ за 2008 год [2]. В 2009 году в новых рекомендациях по диагностике и лечению АГ Европейского общества по артериальной гипертензии нет указания на его применение в той или иной конкретной клинической ситуации [3]. Но в этих же рекомендациях алискирену посвящена целая глава – как новому классу антигипертензивных препаратов. В ней суммируются новые данные, полученные за последние 2 года. Отмечено, что, во-первых, алискирен показал эффективность в снижении систолического АД (САД) и диастолического АД (ДАД) у пациентов с АГ в монотерапии, во-вторых, данный препарат эффективен в комбинации с тиазидными диуретиками, антагонистами кальция, ИАПФ и БРА [4–6], в-третьих, недавно появились данные о способности алискирена защищать органы-мишени на этапе субклинических поражений при использовании в комбинации с БРА.
В одном исследовании у пациентов с АГ и СД с протеинурией данная комбинация препаратов привела к большему снижению экскреции белка с мочой, чем при назначении только БРА [7]. В другом же исследовании среди пациентов с АГ и гипертрофией миокарда левого желудочка (ЛЖ) данная комбинация не привела к достоверно большему уменьшению гипертрофии миокарда ЛЖ, чем при назначении только БРА [8]. В третьем исследовании среди пациентов с сердечной недостаточностью данная комбинация достоверно превосходила назначение только блокатора РААС с целью уменьшения концентрации в плазме мозгового натрийуретического пептида [9], признанного прогностического показателя сердечной недостаточности [10]. Доступные данные оправдывают применение алискирена у пациентов с АГ, особенно в сочетании с другими препаратами. Это также подтверждается хорошей переносимостью алискирена.
Как правило, при уменьшении массы тела происходит снижение уровня АД, и чем больше снижение массы тела, тем более выражена степень снижения АД. Отмечено, что при возрастании ИМТ эффективность антигипертензивной терапии снижается и требует либо увеличения доз препаратов проводимого лечения, либо добавления к схеме лечения дополнительных препаратов. Как показали результаты исследования Bramlage и соавт., с ростом степени ожирения неуклонно увеличивается среднее количество назначаемых препаратов для достижения контроля АД у пациентов с АГ [11]. Так, по данным исследования HYDRA (The Hypertension and Diabetes Risk Screening and Awareness), при нормальном ИМТ монотерапия применяется у 51,1%, а два, три и более препаратов получают 48,9% пациентов, то при ожирении (ИМТ > 40 кг/м2) два, три и более препаратов получает уже 64,9% пациентов [12].
Неудовлетворительный контроль АД при ожирении может быть связан с комплексом патофизиологических эффектов, влияющих на почечную функцию и морфологию. Ожирение способствует увеличению реабсорбции натрия в почечных канальцах и уменьшает натрийурез за счет активации РААС и симпатической нервной системы (СНС). Длительно текущее ожирение вызывает значительные структурные нарушения почек и ухудшает функцию нефронов, создавая тем самым предпосылки к дальнейшему прогрессированию АГ. В целом, с увеличением степени ожирения значительно возрастает процент использования таких групп антигипертензивных препаратов как ИАПФ и диуретики, что еще раз подтверждает основные механизмы, поддерживающие высокое АД у пациентов с ожирением: гиперактивация РААС и задержка жидкости.
По данным Prescott и соавт., при анализе эффективности антигипертензивной терапии у пациентов с ожирением (гидрохлортиазид (ГХТЗ), амлодипин/ГХТЗ 10/25 мг, ирбесартан/ГХТЗ 300/25 мг и алискирен/ГХТЗ 300/25 мг) было показано, что с увеличением ИМТ антигипертензивная эффективность терапии, основанной на БРА, антагонистах кальция и диуретике, снижается. В группе пациентов с ожирением 3 степени (ИМТ ≥ 40 мг/м2) гипотензивный эффект был менее выражен, чем в общей группе пациентов с ожирением 1-2 степени (ИМТ 30–39,9 кг/м2) [13].
Напротив, сочетание алискирена с ГХТЗ не только не потеряло эффективность у наиболее тяжелых пациентов, но и в большей степени увеличило антигипертензивный эффект именно у группы с наибольшим ИМТ (> 40 кг/м2) по сравнению с группой пациентов с меньшей степенью ожирения [13].
Согласно проведенному анализу (J. Jordan и соавт.) плазменной активности ренина в 4 группах пациентов с ожирением, по сравнению с базальным уровнем плазменная активность ренина значительно увеличивается в группах: монотерапии ГХТЗ (+66,1%), амлодипин/ГХТЗ (+195,6%) и ирбесартан/ГХТЗ (+536,6%). Напротив, в группе терапии алискирен/ГХТЗ плазменная активность ренина достоверно снизилась по сравнению с базальным уровнем (-45%), тем самым нивелируя один из важных независимых факторов СС смертности и СС осложнений [14].
Эти данные легко объяснить, если принять во внимание механизм действия ПИР – алискирена, который обладает рядом отличий от уже существующих классов. Алискирен действует, связываясь с активным центром молекулы ренина, тем самым предотвращая взаимодействие ренина с ангиотензиногеном и образование АТ I – предшественника АТ II, который способен стимулировать незрелые адипоциты к росту и дифференцировке.
Таким образом, препятствуя превращениям ангиотензиногена, алискирен действует патогенетически и нейтрализует дальнейшую активацию молодых адипоцитов жировой ткани посредством АТ II. Если рассматривать влияние ИАПФ и БРА на РААС, то обращает на себя внимание тот факт, что эти препараты по механизму обратной связи повышают концентрацию и активность ренина и проренина в плазме.
Эффективность алискирена была доказана в ряде сравнительных исследований с ИАПФ. По данным Uresin и соавт., при сравнении двух режимов монотерапии алискиреном 300 мг/сут. и рамиприлом 10 мг/сут. у пациентов с АГ и СД, алискирен обеспечивал достоверно большее снижение АД. Средний ИМТ в исследовании был выше 30 кг/м2. Таким образом, в исследовании, где подавляющее большинство пациентов страдали ожирением, алискирен в монотерапии оказался способным снизить АД на 19,7 мм рт. ст. по сравнению с 14,9 мм рт. ст. на проводимой терапии рамиприлом (p < 0,05) [15].
Ожирение является важным фактором риска развития СД типа 2. Около 80% людей с СД типа 2 имеют избыточный вес [16]. У таких пациентов с АГ, ожирением, СД и поражением почек имеют особую значимость достижение контроля уровня АД, метаболическая нейтральность препарата и его способность обеспечить максимальную нефропротекцию.
Так, в исследовании AVOID (Aliskiren in the eValuation of prOteinuria In Diabetes), в котором участвовали Российские клинические центры, включившем 599 пациентов с АГ I–II степени, СД типа 2 и альбуминурией, алискирен показал способность обеспечивать дополнительную нефропротекцию при добавлении к терапии БРА [7]. В этом исследовании к лозартану в дозе 100 мг, назначенному с целью нефропротекции, добавлялись либо алискирен в дозе 300 мг, либо плацебо. Через 6 месяцев терапии в группе комбинированного лечения лозартан + алискирен альбуминурия оказалась на 20% меньше, чем в группе сравнения (лозартан + плацебо) [7, 17]. В группе двойной блокады РААС в 2 раза больше пациентов (24,7%) достигло снижения альбуминурии на 50% по сравнению с группой сравнения (12,5%) (p = 0,0002). При монотерапии у пациентов с АГ и СД алискирен снижал уровень экскреции альбумина с мочой на 48% от исходного уровня, по данным F. Persson и соавт. [18].
Кроме того, в трех исследованиях, входящих в крупную исследовательскую программу ASPIRE HIGHER («Стремление ввысь») по оценке возможностей алискирена в защите органов-мишеней в различных ситуациях с очень высоким риском развития потенциально фатальных осложнений (гипертрофия ЛЖ, СД типа 2, ХСН), были продемонстрированы его дополнительные кардиопротективные и нефропротективные свойства. В исследовании AVOID присоединение алискирена к лозартану обеспечивало достоверное дополнительное по сравнению с плацебо уменьшение соотношения альбумин/креатинин мочи у пациентов с АГ и диабетической нефропатией [7].
В исследовании ALOFT (The Aliskiren Observation Of Heart Failure Treatment Study) показано, что добавление препарата к стандартной терапии у пациентов с АГ и ХСН приводило к достоверно большему снижению уровня мозгового натрийуретического пептида в плазме крови (маркер тяжести течения ХСН) [19].
Исследование ALLAY (Aliskiren in Left Ventricular Hypertrophy) продемонстрировало способность алискирена уменьшать гипертрофию миокарда ЛЖ у пациентов с АГ, сопоставимую с лозартаном [8]. В информационном письме – обращении в регионы рабочей группы экспертов Российского медицинского общества артериальной гипертонии во главе с профессором И.Е. Чазовой указано, что потенциально предпочтительными клиническими ситуациями для назначения алискирена являются:
- АГ и абдоминальное ожирение;
- АГ и СД типа 2;
- АГ и МС;
- АГ II–III степени в составе комбинированной терапии;
- АГ и ХСН;
- АГ и МАУ/протеинурия;
- резистентная АГ.
В отделе системных гипертензий Института клинической кардиологии им А.Л. Мясникова проведено исследование, посвященное изучению эффективности ПИР алискирена у больных с МС, целью которого явилась оценка влияния алискирена на уровень АД, показатели углеводного, липидного обмена, микроальбуминурии и жесткость сосудистой стенки.
Материалы и методы
В исследовании приняли участие 33 больных с МС. Все включенные в исследование пациенты имели признаки абдоминального ожирения и ИМТ более 25 кг/м². Возраст пациентов варьировал в пределах от 27 до 59 лет, в среднем составил 41,2 ± 0,9 лет. По половому признаку пациенты распределились в соотношении 16 мужчин и 17 женщин. Все пациенты имели АГ I–II степени, длительность АГ составляла от 6 месяцев до 15 лет, в среднем 4,8 ± 3,2 года.
Критериями МС, согласно рекомендациям ВНОК 2009 года, являлись: основной признак – центральный (абдоминальный) тип ожирения – окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин.
Дополнительные критерии: артериальная гипертония (АД ≥ 130/85 мм рт. ст.), повышение уровня триглицеридов (≥ 1,7 ммоль/л), снижение уровня ХС ЛПВП (< 1,0 ммоль/л у мужчин; < 1,2 ммоль/л у женщин), повышение уровня ХС ЛПНП > 3,0 ммоль/л, гипергликемия натощак, нарушение толерантности к глюкозе. Наличие у пациента центрального ожирения и двух из дополнительных критериев является основанием для диагностирования у него метаболического синдрома.
Критериями исключения были тяжелые сердечно-сосудистые заболевания, включающие артериальную гипертонию III степени, острый инфаркт миокарда, стенокардию III–IV ФК, нестабильную стенокардию, сердечную недостаточность, острое нарушение мозгового крово-обращения, клинически значимые изменения ЭКГ, требующие немедленной терапии; вторичные АГ: реноваскулярную, эндокринную; хроническую почечную недостаточность; тяжелые нарушения функции печени (превышение уровня трансаминаз в 2 раза и более нормы); беременность и период лактации.
Всем пациентам, включенным в исследование, был назначен алискирен в дозе 150–300 мг/сут. До начала исследования 70% пациентов уже принимали антигипертензивную терапию, однако целевого уровня АД не достигли. Больным, которые уже принимали ИАПФ, БРА или антигипертензивные препараты других классов в виде монотерапии в средних терапевтических дозах, но, тем не менее, не достигшим целевого уровня АД, предшествующая терапия была заменена на алискирен в стартовой дозе 150 мг. Если дозы указанных групп препаратов были максимальными, то стартовая доза алискирена составила
300 мг/сут, при необходимости для достижения целевых значений АД к терапии алискиреном добавляли гипотиазид в дозе 12,5 мг.
До и после терапии использовались следующие методы исследования: антропометрические – окружность талии (показа-тель абдоминального ожирения) определяли при помощи сантиметровой ленты, накладываемой циркулярно под краем реберной дуги. ИМТ рассчитывался по формуле Кетле: ИМТ = масса тела (кг) / рост (м), возведенный в квадрат. Показатели – холестерин, триглицериды – определяли в пробах венозной крови, взятой натощак, то есть не ранее чем через 12 ч после последнего приема пищи, при помощи ферментативного колориметрического метода с использованием наборов фирмы DIASYS (Германия) на биохимическом автоанализаторе EXPRESS PLUS (CHIRON/Diagnostics, Великобритания). Содержание глюкозы в плазме крови определяли глюкозооксидазным методом с использованием набора Glucose GOD-PAP (Roche) на автоанализаторе EXPREES PLUS (CHIRON/Diagnostics, Великобритания). Результаты выражали в ммоль/л. Проведение перорального теста толерантности к глюкозе (ПТТГ) начинали не позднее 10 ч утра. После забора пробы венозной крови для определения уровня глюкозы натощак, пациент принимал внутрь 75 г дегидратированной глюкозы, разведенной в 200 мл воды, после чего через 2 ч осуществляли следующий забор крови для определения постпрандиального уровня глюкозы. Микроальбуминурию определяли методом иммунотурбидиметрического анализа. За норму принимали концентрацию альбумина в моче менее 20 мг/л в ночной порции мочи. Регистрация ЭКГ в 12-ти отведениях проводилась по стандартной методике.
Состояние сосудистой стенки оценивали плече-лодыжечным методом объемной сфигмографии с помощью прибора VaSera-1000 (Fucuda Denshi, Япония) по следующим показателям:
- R/L-PWV – скорости пульсовой волны (СПВ) по артериям преимущественно эластического типа справа и слева;
- CAVI1/L-CAVI1 – сердечно-лодыжечному сосудистому индексу справа и слева. Это новый показатель, отражающий истинную жесткость сосудистой стенки. Он позволяет исключить влияние уровня АД на артериальную ригидность. CAVI вычисляется путем регистрации пульсовых волн в двух точках и измерением систолического и диастолического АД (Ps, Pd): CAVI = 1/k2 (ln x Ps/Pd) PWV'2;
- R-АI – индексу прироста (аугментации), характеризующему величину отраженной волны. Он вычислялся по формуле: R-АI = Р1/Р2, где Р1 – давление на пике ударной волны и Р2 – давление на пике отраженной волны.
- При обработке результатов использовался пакет прикладных программ Statistica 6.0 (StatSoft Inc., США). При нормальном распределении для анализа применяли параметрический критерий t Стьюдента. Результаты представлены в виде М ± SD. Для каждого признака (из числа включенных в анализ) проводили попарное сравнение заданных групп пациентов (реализаций), с выявлением достоверных различий между ними.
Результаты
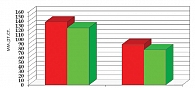
В результате лечения алискиреном достоверно снизились практически все исходно повышенные показатели суточного профиля АД. Целевого уровня АД (как САД, так и ДАД) достигли 80% пациентов. В среднем днем САД снизилось с 137,38 ± 2,3 до 126,57 ± 1,9 мм рт. ст. (р ≤ 0,01), ДАД с 84,90 ± 1,99 до 78,14 ± 1,25 мм рт. ст. (р ≤ 0,05) (рис. 1).
На фоне терапии алискиреном произошло значительное снижение индекса времени (ИВ) САД с 53,07 ± 5,91 до 21,28 ± 4,71% (р ≤ 0,001) и ИВ ДАД с 47,70 ± 6,54 до 20,04 ± 4,59% (р ≤ 0,001), что свидетельствует о высокой антигипертензивной эффективности препарата.
У пациентов, принимающих алискирен, через 6 месяцев вес тела снизился в среднем с 95,18 ± 4,84 до 93,03 ± 4,61 кг, однако эти изменения были недостоверными. ИМТ и ОТ существенно не менялись.
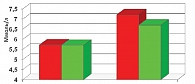
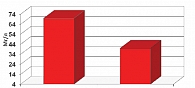
В результате терапии алискиреном уровень глюкозы натощак не менялся, однако отмечено достоверное снижение постпрандиального уровня глюкозы с 7,22 ± 0,36 до 6,20 ± 0,22 ммоль/л (р ≤ 0,05) (рис. 2). Показатели липидного обмена достоверно не менялись. В целом по группе значимого снижения микроальбуминурии не произошло, однако, при более тщательном анализе, в группе пациентов с исходно высоким уровнем микроальбуминурии, отмечено достоверное снижение уровня микроальбумина мочи с 70,2 ± 21,7 до 41,3 ± 13,6 мг/л (р ≤ 0,05) (рис. 3).
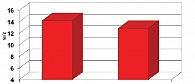
Еще одной задачей нашего исследования была оценка влияния терапии алискиреном на состояние магистральных сосудов. По данным объемной сфигмографии отмечено уменьшение ригидности артерий. СПВ, которая исходно была выше нормальных значений, достоверно снизилась с 14,21 ± 0,45 до 12,98 ± 0,23 м/с (р ≤ 0,05) (рис. 4), т.е. достигла нормы.
Индексы CAVI имели тенденцию к снижению, однако достоверной динамики этих показателей получено не было. Помимо СПВ и СAVI, оценивался индекс R-AI, дающий представление о системной артериальной эластичности, геометрии и тонусе артериального дерева. Нами зарегистрировано достоверное снижение этого параметра c 1,13 ± 0,04 до 1,01 ± 0,01 (р ≤ 0,05), что свидетельствует об улучшении структурно-функциональных свойств сосудистой стенки.
На фоне назначения алискирена не было существенной динамики показателей креатинина, АСТ и АЛТ. Побочных эффектов на фоне его приема не наблюдалось, абсолютное большинство больных отметили хорошую переносимость препарата и отсутствие нежелательных явлений при его назначении.
Выводы
- Терапия алискиреном сопровождалась хорошим антигипертензивным эффектом со снижением как систолического, так и диастолического АД до целевых значений у 80% пациентов с АГ и МС. Лечение алискиреном у больных с АГ и МС сопровождалось улучшением показателей углеводного обмена: отмечалось достоверное снижение постпрандиального уровня глюкозы.
- Терапия алискиреном не оказала влияния на показатели липидного обмена у больных АГ и МС.
- У пациентов с МС и АГ, а также исходно высоким уровнем микроальбуминурии в результате терапии алискиреном отмечено достоверное снижение микроальбумина мочи.
- На фоне лечения алискиреном зарегистрировано снижение ригидности магистральных артерий и улучшение структурно-функциональных свойств сосудистой стенки, отмечено достоверное снижение скорости пульсовой волны и индекса аугментации R-AI.
- Терапия алискиреном сопровождалась хорошим профилем переносимости и отсутствием нежелательных явлений при его применении.
Таким образом, прямое ингибирование ренина с помощью алискирена у больных с МС и АГ продемонстрировало высокую антигипертензивную эффективность с хорошим профилем переносимости и безопасности. Терапия алискиреном сопровождается достоверным улучшением основных показателей суточного профиля АД, снижением постпрандиального уровня глюкозы, уменьшением исходно повышенного уровня микроальбумина в моче, а также снижением ригидности магистральных артерий уже в первые 6 месяцев лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.