Роль блокаторов рецепторов ангиотензина II в лечении артериальной гипертонии у больных с метаболическим синдромом и сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
В настоящее время нет убедительных доказательств, свидетельствующих о преимуществах одного класса антигипертензивных препаратов над другими. Результаты множества многоцентровых исследований показали, что диуретики, b-адреноблокаторы, ингибиторы ангиотензин-превращающего фермента (иАПФ), антагонисты кальция, блокаторы рецепторов ангиотензина II (БРА) в равной мере обладают способностью снижать уровень АД, предотвращать поражение органов-мишеней, снижать сердечно-сосудистый риск и любой из них может применяться в качестве стартовой терапии. Однако в отдельных клинических ситуациях несомненно, что тот или иной класс препаратов или даже отдельные их представители имеют предпочтение для лечения АГ. Все существующие на сегодня рекомендации по АГ (российские, европейские, американские и т.д.) выделяют препараты, влияющие на ренин-ангиотензин-альдостероновую систему (РААС), иАПФ и БРА как приоритетные для лечения АГ у больных с МС и СД, заболеванием почек, имеющих в анамнезе острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК) и др. Это обусловлено не только их высокой антигипертензивной активностью, но и способностью лучше других классов препаратов предотвращать поражение органов-мишеней у данной категории больных.
БРА – относительно новый класс антигипертензивных препаратов. Появившись в начале 1990-х годов, они стремительно завоевали место среди основных классов антигипертензивных препаратов. БРА подавляют активность ангиотензина II, являющегося частью РААС, наиболее изученной и одной из важнейших систем в регуляции АД. Установлено, что перепроизводство ренина и связанных с ним метаболитов, в первую очередь ангиотензина II, ведет не только к АГ, но и повреждению органов-мишеней, являясь одним из основных факторов прогрессирования АГ и ее осложнений, ремоделирования сердца и сосудов. При применении иАПФ, несмотря на блокирование образования ангиотензина II, с течением времени уровень этого пептида может вернуться к норме из-за альтернативного пути его образования с помощью других ферментов, катализирующих превращение ангиотензина I в ангиотензин II (2). К числу таких ферментов относятся, к примеру, сердечная химаза и трипсин. Блокаторы же ангиотензина II, ингибируя рецепторы АТ1, предотвращают негативные эффекты этого пептида независимо от пути его образования.
Кроме того, как свидетельствует ряд экспериментальных работ, стимуляция ангиотензином II незаблокированных рецепторов АТ2 может сыграть дополнительную положительную роль, поскольку происходит увеличение NO как через брадикинин-зависимый, так и брадикинин-независимый механизмы (3). Таким образом, создание БРА позволило преодолеть некоторые недостатки иАПФ, в частности такие побочные эффекты, как кашель и ангионевротический отек, возникающие при применении иАПФ.
Согласно результатам клинических и экспериментальных исследований, некоторые представители этого класса препаратов обладают особыми свойствами, что дает им преимущества у больных с метаболическими нарушениями. Результаты крупного исследования LIFE (Losartan Intervention For Endpoint reduction in hypertension) показали, что БРА значительно эффективней снижают риск сердечно-сосудистых осложнений и смертности по сравнению с атенололом у больных СД и АГ (4).
В исследовании CROSS (Candesartan Role on Obesity and on Sympathetic System) было установлено, что БРА улучшают чувствительность к инсулину у пациентов с ожирением и АГ (5). А у больных АГ высокого риска БРА снижают риск развития СД, как было показано в исследовании VALUE (Valsartan Antihypertensive Long-term Use Evaluation) (6).
Из 9 клинических исследований с использованием БРА у больных с АГ без СД только в 4 получено значимое повышение чувствительности к инсулину, что подтверждает мысль о том, что метаболические эффекты присущи не всем представителям этого класса в одинаковой степени. Установлено, что ирбесартан может действовать как частичный агонист PPARg, в отличие от других препаратов этой группы. Недавно было обнаружено интересное структурное сходство между ирбесартаном и пиоглитазоном – PPARg-лигандом, применяемым для лечения СД 2 типа. Это открытие подтверждает возможность того, что некоторые молекулы могут быть способными не только блокировать рецепторы к ангиотензину II – ключевые рецепторы, влияющие на АД, но и активировать PPARg, внутриклеточный ядерный гормональный рецептор, участвующий в регуляции углеводного и липидного обменов (7).
Кроме того, БРА обладают низким потенциалом взаимодействия с другими препаратами, что является весьма выгодным свойством, так как при лечении АГ зачастую требуется применение двух-, трехкомпонентной и более терапии.
Всеми положительными свойствами данного класса препаратов в полной мере обладает ирбесартан (Апровель). При приеме внутрь он быстро и полностью абсорбируется из желудочно-кишечного тракта; скорость всасывания не зависит от приема пищи. Для него характерно постепенное начало действия и, как следствие, отсутствие эффекта первой дозы, который часто наблюдается при использовании других гипотензивных средств. После однократного приема максимальный эффект развивается через 3-6 ч. Гипотензивное действие сохраняется на протяжении 24 ч, поэтому однократное применение ирбесартана обеспечивает 24-часовой контроль АД. Максимальный эффект при постоянном применении достигается через 4-6 недель без развития толерантности. Ирбесартан назначается в дозировке 150-300 мг 1 раз в сутки, независимо от приема пищи.
Монотерапия препаратом при АГ первой и второй степени эффективно контролирует АД у 40-50% пациентов; при добавлении низких доз тиазидных диуретиков АД контролируется у 60-70% пациентов. В многочисленных исследованиях было показано, что эффективность ирбесартана в снижении АД не уступает эффективности известных антигипертензивных препаратов при низкой частоте побочных эффектов.
Эффективность и безопасность ирбесартана была продемонстрирована целым рядом исследований. В 4-недельном рандомизированном двойном слепом исследовании 181 пациент с мягкой и умеренной гипертензией был рандомизирован в группу ирбесартана 150 мг или амлодипина 5 мг (8). На 4-й неделе терапии статистического различия в снижении диастолического и систолического АД между группами ирбесартана и амлодипина не наблюдалось. Таким образом, ирбесартан приводил к такому же снижению АД, как и амлодипин.
В другом рандомизированном двойном слепом исследовании ирбесартан (75 мг, с титрованием дозы при необходимости до 150 мг на 4-й или 8-й неделе и до 300 мг на 8-й неделе) сравнивался с иАПФ эналаприлом в полной дозе (10 мг, с увеличением дозы до 20 мг и 40 мг) у пациентов с мягкой и умеренной АГ (9). Оба препарата значительно снижали АД без значимых различий эффективности между группами лечения. Частота кашля как побочного эффекта при лечении ирбесартаном была несколько ниже, чем в группе эналаприла.
В рандомизированном 12-недельном двойном слепом исследовании ирбесартан сравнивался с эналаприлом на 182 пациентах с АГ 3 степени (10). Через 12 недель исследования ирбесартан в дозе 150 мг, титрованный до 300 мг, с добавлением при необходимости гидрохлортиазида и атенолола или нифедипина, сравнивался с терапией, основанной на эналаприле от 20 мг до 40 мг, с добавлением при необходимости сопутствующей терапии. На 12-й неделе 59% пациентов из группы ирбесартана и 57% из группы эналаприла имели нормальное АД. Пациенты из группы ирбесартана имели тенденцию к более быстрой нормализации АД. Несколько большему числу пациентов из группы эналаприла требовалась трехкомпонентная и более терапия. При этом терапия ирбесартаном приводила к значимо меньшей частоте кашля, чем терапия, основанная на эналаприле.
Эффективность и безопасность ирбесартана и эналаприла у пациентов с мягкой и умеренной эссенциальной гипертонией по данным суточного АД-мониторирования сравнивалась в многоцентровом, рандомизированном, двойном слепом исследовании MAPAVEL (Monitorizacion Ambulatoria Presion Arterial APROVEL) (11). В этом исследовании изучалось 24-часовое снижение АД и контроль АД, оцениваемые с помощью суточного амбулаторного мониторирования АД, у пациентов с мягкой и умеренной АГ, леченных ирбесартаном или эналаприлом. После 3-недельного периода «отмывания» 238 пациентов были рандомизированы в группы 12-недельной активной терапии ирбесартаном (115 человек) или эналаприлом (123 человека). Стартовая доза равнялась 150 и 10 мг/сут. соответственно, с титрованием до 300 или 20 мг/сут. На основании клинических измерений контроль АД определялся при АД < 140/90 мм рт. ст. после 12-недельной терапии; пациенты, достигшие снижения ДАД ³ 10 мм рт. ст. на 12-й неделе, считались ответчиками. Критерием контроля АД при суточном мониторировании, независимо от клинических значений, было достижение дневного АД < 130/85 мм рт. ст. после 12 недель терапии; пациенты, достигшие снижения 24-часового ДАД ³ 5 мм рт. ст. на 12-й неделе, считались ответчиками. В результате проведенного исследования выяснилось, что снижение АД было схожим в обеих группах, как при клиническом измерении (ДАД 12,7 ± 8,8 мм рт. ст. на ирбесартане к 12,4 ± 7,4 мм рт. ст. на эналаприле; САД 19,0 ± 14,1 мм рт. ст. к 17,5 ± 14,0 мм рт. ст. соответственно), так и при 24-часовом амбулаторном мониторировании АД (ДАД 9,4 ± 8,5 мм рт. ст. к 8,8 ± 8,5 мм рт. ст.; САД 14,7 ± 14,7 мм рт. ст. к 12,6 ± 13,1 мм рт. ст. соответственно). По данным суточного мониторирования АД (СМАД), частота контроля АД была 40,5% (45/111) для ирбесартана и 33,9% (39/115) для эналаприла, а процент ответчиков составил 71,2% (79/111) и 71,3% (82/115) соответственно. Общая частота побочных эффектов (40,0% при терапии ирбесартаном, 51,2% при терапии эналаприлом) статистически не различалась, но частота побочных эффектов, связанных с гипотензивной терапией, была значимо выше в группе эналаприла (24,6%) против 9,2% в группе ирбесартана (p = 0,026), прежде всего вследствие высокой частоты кашля (8,1% против 0,9%). Таким образом, по данным СМАД, ирбесартан 150-300 мг/сут. был так же эффективен в снижении АД и достижения контроля АД, как и эналаприл 10-20 мг/сут. Ирбесартан лучше переносился, чем эналаприл в отношении числа побочных эффектов.
Помимо антигипертензивного действия, ирбесартан обладает и рядом дополнительных положительных эффектов, обусловленных блокадой РААС, что является крайне важным при лечении АГ и метаболического синдрома. Длительное лечение ирбесартаном предотвращало развитие метаболического синдрома: не только значимо снижало АД, но и предотвращало развитие ожирения и гиперинсулинемии на животной модели метаболического синдрома (12).
Кроме того, ирбесартан продемонстрировал высокую органопротективную активность. В исследовании итальянских ученых (13) при монотерапии ирбесартаном в дозе 300 мг отмечалась регрессия гипертрофии левого желудочка, оцениваемой эхокардиографически, 24,7% против 13,0% при монотерапии амлодипином в дозе 10 мг (р < 0,0001).
В крупном, длительном многоцентровом рандомизированном исследовании PRIME (PRogram for Irbesartan Mortality and Morbidity Evaluations) было доказано нефропротективное действие ирбесартана при АГ и СД 2 типа, а также благоприятное действие на общую смертность и сердечно-сосудистые события. PRIME состояла из двух исследований: IRMA 2 и IDNT. В исследовании IRMA 2 (IRbesartan MicroAlbuminuria in Hypertensive Patients with Type 2 Diabetes Mellitus) оценивался эффект ирбесартана и контрольной группы (плацебо в дополнение к другим неисключенным антигипертензивным средствам) на предотвращение или замедление прогрессирования явной (клинически выраженной) нефропатии у гипертоников с СД 2 типа, микроальбуминурией и нормальной функцией почек. В исследовании IDNT (Irbesartan Diabetic Nephropathy Trial) сравнивался профилактический эффект ирбесартана, антагониста кальциевых каналов амлодипина и контрольной группы (плацебо в дополнение к другим неисключенным антигипертензивным средствам) на прогрессирование нефропатии, общую смертность и сердечно-сосудистые события у пациентов с гипертонией и СД 2 типа и установленным поражением почек (14). До программы PRIME не было крупных, длительных сравнительных исследований по применению различных антигипертензивных классов препаратов у пациентов с АГ и СД 2 типа с нефропатией.
IRMA 2 продемонстрировало 70% снижение риска прогрессирования микроальбуминурии в явную диабетическую нефропатию при лечении ирбесартаном в дозе 300 мг в сравнении с контрольной группой (плацебо в дополнение к другим неисключенным антигипертензивным препаратам). Кроме того, регрессия в нормоальбуминурию в группе ирбесартана встречалась значительно чаще, чем в контрольной группе. Эти результаты не зависели от влияния ирбесартана на системное АД. Ирбесартан показал себя безопасным и хорошо переносимым препаратом, с меньшей частотой серьезных побочных эффектов, более редким прекращением приема препарата вследствие побочных эффектов и меньшей частотой нефатальных сердечно-сосудистых событий (15).
IDNT продемонстрировало достоверное 23% снижение риска повышения креатинина, развития терминальной стадии ХПН или смерти в пользу ирбесартана при сравнении с амлодипином (р = 0,006) и 20% снижение риска в сравнении с группой контроля (плацебо в дополнение к другим антигипертензивным препаратам). Эти результаты не зависели от эффекта ирбесартана на системное АД. Снижение АД в группе ирбесартана и амлодипина было сопоставимым (достигнутое среднее АД в группах составило 140/77 мм рт. ст. и 141/77 мм рт. ст. соответственно). Значимых различий по риску сердечно-сосудистых событий в трех группах не было. Таким образом, кардиопротективный эффект ирбесартана был сопоставим с другими широко используемыми антигипертензивными препаратами, включая амлодипин, диуретики и b-блокаторы. Ирбесартан также был безопасен и хорошо переносился, с более низкой частотой серьезных побочных явлений, чем в группе контроля или амлодипина.
На основании результатов IRMA 2 было рассчитано, что лечение 10 пациентов с АГ и СД 2 типа и микроальбуминурией ирбесартаном 300 мг на протяжении 2 лет предохранит 1 пациента от развития явной диабетической нефропатии в течение 2 лет.
На основании результатов IDNT лечение 15 гипертензивных пациентов с СД 2 типа и протеинурией (³ 900 мг/сут.) ирбесартаном на протяжении 3 лет предохранит 1 пациента от развития первичной конечной точки (удвоения креатинина сыворотки, терминальной ХПН или смерти от всех причин) в течение 3 лет.
Влияние ирбесартана на абсолютный сердечно-сосудистый риск оценивалось в многоцентровом, проспективном, наблюдательном исследовании, включавшем 1974 пациента с впервые выявленной эссенциальной АГ или АГ, не контролируемой монотерапией антигипертензивными препаратами, и с умеренным, высоким и очень высоким сердечно-сосудистым риском (16). Ирбесартан в качестве монотерапии в дозе 150-300 мг или в комбинации с гидрохлортиазидом 12,5 мг оказался эффективным в снижении абсолютного сердечно-сосудистого риска, что было достигнуто за счет значительного снижения АД и хорошего профиля безопасности биохимических параметров. Наблюдалась отличная толерантность с низкой частотой побочных эффектов. Клиническое наблюдение велось в течение 6 месяцев. Оценивался абсолютный сердечно-сосудистый риск, измерявшийся как качественно, так и количественно (группа низкого, умеренного, высокого и очень высокого риска согласно рекомендациям ВОЗ/Международного общества гипертензии). Терапия ирбесартаном приводила к значимому (p = 0,0001) снижению САД и ДАД. Количественный абсолютный сердечно-сосудистый риск снизился на 29,8% (p < 0,0001). Доля пациентов с очень высоким сердечно-сосудистым риском снизилась с 1,52% до 0,51%, а доля пациентов с высоким сердечно-сосудистым риском с 92,77% до 88,32%. Последние пациенты перешли в группу умеренного риска. В результате группа умеренного риска увеличилась с 5,71% до 11,17%. Частота побочных реакций была очень низка и составила лишь 2,2% пациентов. Таким образом, ирбесартан продемонстрировал способность высоко достоверно снижать сердечно-сосудистый риск.
В отделе системных гипертензий НИИ клинической кардиологии им. А.Л. Мясникова изучали влияние блокатора рецепторов к ангиотензину II ирбесартана на АД, чувствительность тканей к инсулину, показатели углеводного и липидного обмена, состояние перфузии головного мозга у пациентов с АГ без метаболических нарушений, с МС и СД типа 2. В исследование было включено 20 пациентов с АГ без метаболических нарушений, 20 пациентов с АГ и МС, 20 пациентов с АГ в сочетании с СД типа 2. Пациентам была назначена терапия ирбесартаном в дозе 150-300 мг в сутки однократно.
Исходно и через 24 недели терапии у пациентов собирали полный анамнез, проводили физикальный осмотр, измерение АД, измерение массы тела, окружности талии. Проводили биохимическое исследование венозной крови (общий ХС, ХС ЛПНП, ХС ЛПВП, ТГ). Для оценки толерантности к глюкозе использовался стандартный пероральный тест толерантности к глюкозе с определением уровней глюкозы, эндогенного инсулина и С-пептида. Исходно и через 24 недели терапии пациентам проводился также внутривенный инсулин-модифицированный тест толерантности к глюкозе, по результатам которого рассчитывался индекс инсулинорезистентности (ИР) по минимальной модели N. Bergman.
Состояние перфузии головного мозга оценивали методом однофотонной эмиссионной компьютерной томографии с использованием в качестве радиофармпрепарата (РФП) гексаметиленпропиленаминоксим (HMPAO), меченого in vitro изотопом технеция 99mTc (Церетек, Nycomed-Ammersham, Дания).
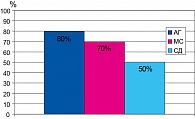
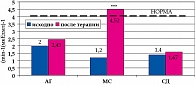
Результаты нашего исследования подтвердили высокую антигипертензивную эффективность ирбесартана. В качестве монотерапии ирбесартан привел к достижению целевых уровней АД у 80% больных с АГ, у 70% больных с АГ и МС и у 50% больных АГ и СД типа 2 (рисунок 1).
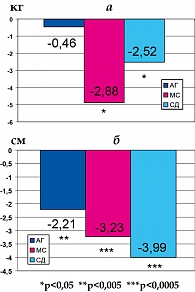
Отмечалось достоверное снижение массы тела у больных с МС и больных СД типа 2. При этом показатель абдоминального типа ожирения (окружность талии) снижался значимо во всех 3 группах. Очевидно, что масса тела снижалась за счет уменьшения висцерального жира, который посредством биологически активных веществ, вырабатываемых в его адипоцитах, принимает участие в метаболизме углеводов, липидов и влияет на чувствительность к инсулину (рисунок 2).
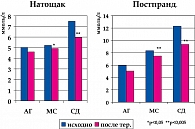
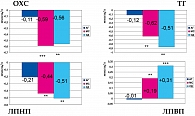
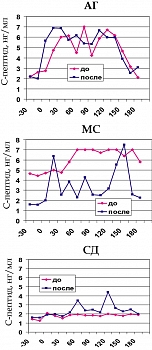
Наиболее интересными оказались выявленные в данной работе метаболические эффекты ирбесартана. Показатели глюкозы натощак и постпрандиальный уровень глюкозы, а также ОХС, ХС ЛПНП и ТГ снижались достоверно у больных с МС и СД (рисунки 3, 4). Причем, снижение было тем очевиднее, чем выше были исходные их показатели. В этих же группах пациентов значимо повышался уровень ХС ЛПВП.
Гиперинсулинемия (ГИ) исходно выявлялась у пациентов с АГ без метаболических нарушений и у пациентов с МС, тогда как показатели инсулина у больных СД типа 2 были ниже нормальных значений, что подчеркивает необратимые изменения (истощение) бета-клеток поджелудочной железы при СД. Снижение чувствительности к инсулину отмечалось не только у больных с МС и СД, но и у 60% больных с АГ без ожирения и явных метаболических нарушений. Этому факту есть подтверждение в литературных источниках, в которых было установлено, что у части больных с эссенциальной АГ выявляется ГИ и ИР. Действительно, АГ за счет повышения общего периферического сосудистого сопротивления (ОПСС), может нарушить доставку глюкозы к периферическим тканям и, таким образом, снизить ее утилизацию и привести к инсулинорезистентности. Терапия ирбесартаном оказала позитивное влияние на показатели инсулина, чувствительности к инсулину, а также фазы секреции инсулина во всех трех исследуемых группах пациентов. Однако это влияние качественно различалось в каждой из групп.
На фоне терапии ирбесартаном существенно уменьшилась ГИ у больных АГ без метаболических нарушений и у больных АГ с МС, в то время как исходно сниженный постпрандиальный уровень инсулина у больных СД типа 2 значимо повысился. Показатель чувствительности к инсулину более значимо повысился у больных с МС, что подтверждает обратимость изменений у этой категории больных (рисунок 5).
Наиболее интересными представляются результаты динамики фаз секреции инсулина в каждой из 3 групп пациентов. У больных АГ без метаболических нарушений 1-я фаза секреции инсулина была достаточно выраженной, однако отмечалась задержка во времени ее появления. Терапия ирбесартаном привела к возвращению в нормальные временные параметры 1-й фазы секреции инсулина у больных этой группы.
У больных с МС также отмечалось нарушение 1-й фазы секреции инсулина, пик которой был слабо выражен. На фоне терапии ирбесартаном произошло восстановление достаточного пика секреции инсулина.
В группе больных СД типа 2 были нарушены обе фазы секреции инсулина. Терапия ирбесартаном не повлияла на 1-ю фазу, однако значимо улучшилась 2-я фаза секреции инсулина (повысилась его секреция), за счет чего, вероятно, отмечалось значимое снижение уровня глюкозы в крови у этих пациентов (рисунок 6).
Результаты представленного исследования показали, что ирбесартан обладает дополнительными свойствами, позволяющими позитивно влиять на метаболические процессы, не зависящими от антигипертензивного действия. Вероятно, с одной стороны ирбесартан способен повышать чувствительность к инсулину, с другой – повышать секрецию инсулина бета-клетками поджелудочной железы. Первое, возможно, обусловлено частичным взаимодействием с PPARg-рецепторами висцеральной жировой ткани, что приводит к повышению секреции адипонектина адипоцитами. Недостаточная секреция адипонектина вызывает снижение чувствительности к инсулину. Повышение содержания адипонектина, в свою очередь, приводит к уменьшению секреции резистина и фактора некроза опухоли альфа, повышению активности транспортеров глюкозы и липопротеинлипазы. Все эти процессы снижают поступление в кровь свободных жирных кислот и таким образом способствуют повышению чувствительности периферических тканей к инсулину, что было получено у больных с МС в представленной работе.
Повышение секреции инсулина на фоне приема ирбесартана, которое убедительно было продемонстрировано в нашем исследовании у больных СД типа 2, вероятно, обусловлено его способностью улучшать ионный обмен и микроциркуляцию островков Лангерганса поджелудочной железы.
Кроме того, в нашей работе было выявлено значимое улучшение микроциркуляции в головном мозге у всех больных на фоне приема ирбесартана. Вероятно, это также обусловлено несколькими причинами. С одной стороны, ирбесартан повышает содержание тканевого активатора плазминогена и обладает противовоспалительным, антиоксидантным и антипролиферативным действиями, что улучшает реологические свойства крови. С другой стороны, повышение чувствительности к инсулину и, как следствие, снижение гипергликемии и гиперлипидемии приводит к уменьшению оксидативного стресса и снижению агрегации тромбоцитов, что в свою очередь препятствует тромбообразованию. Кроме того, снижение ИР улучшает функцию эндотелия сосудов и NO-зависимую вазодилатацию.
Таким образом, из результатов нашего исследования совершенно очевидно, что ирбесартан является идеальным препаратом для лечения АГ, в том числе у больных с высоким сердечно-сосудистым риском, который наряду с хорошей антигипертензивной эффективностью обладает дополнительными позитивными метаболическими эффектами и органопротективными свойствами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.