Особенности ведения пациентов с сахарным диабетом после трансплантации печени
- Аннотация
- Статья
- Ссылки
- English
В настоящее время цирроз в исходе неалкогольной жировой болезни печени занимает второе место среди причин трансплантации печени после циррозов вирусной этиологии. Наличие сахарного диабета отрицательно влияет на результаты операции и качество жизни больных в послеоперационном периоде.
Посттрансплантационный сахарный диабет протекает более тяжело и приводит к более тяжелым системным микроциркуляторным осложнениям, может вызывать развитие неалкогольной жировой болезни печени у пересаженной печени с быстрым прогрессированием до цирроза.
В условиях иммуносупрессивной терапии после трансплантации печени лечение сахарного диабета представляет определенные трудности и не всегда эффективно.
В настоящее время цирроз в исходе неалкогольной жировой болезни печени занимает второе место среди причин трансплантации печени после циррозов вирусной этиологии. Наличие сахарного диабета отрицательно влияет на результаты операции и качество жизни больных в послеоперационном периоде.
Посттрансплантационный сахарный диабет протекает более тяжело и приводит к более тяжелым системным микроциркуляторным осложнениям, может вызывать развитие неалкогольной жировой болезни печени у пересаженной печени с быстрым прогрессированием до цирроза.
В условиях иммуносупрессивной терапии после трансплантации печени лечение сахарного диабета представляет определенные трудности и не всегда эффективно.
Согласно данным экспертов Международной федерации диабета (International Diabetes Federation – IDF) и Американской диабетической ассоциации, количество пациентов с сахарным диабетом (СД) за последние десять лет увеличилось более чем в два раза. Столь стремительный рост заболеваемости стал причиной принятия в 2006 г. Организацией Объединенных Наций резолюции о сахарном диабете [1], в 2011 г. – политической декларации [2], призывающей создавать многопрофильные стратегии для профилактики развития неинфекционных заболеваний и борьбы с ними, в частности СД, осложнения которого являются одной из ведущих причин инвалидизации и смерти пациентов [3–5].
В 2017 г. количество больных СД превысило 425 млн [6]. В 2019 г. патология выявлена уже у 463 млн. Если в 2017 г. эксперты IDF к 2045 г. прогнозировали рост заболеваемости до 629 млн человек [6], то в 2019 г. – уже до 700 млн [7].
В Российской Федерации, так же как во всем мире, отмечается увеличение числа больных СД. Согласно данным федерального регистра СД, в 2018 г. на диспансерном учете состояло около 4,6 млн (3,1% населения), из них примерно 4,2 млн (92%) с СД 2 типа, 256 тыс. (6%) с СД 1 типа и 90 тыс. (2%) с другими типами СД, в том числе 8 тыс. с гестационным СД. Однако эти данные не отражают реального количества пациентов, поскольку учитываются только выявленные и зарегистрированные случаи. Так, результаты масштабного российского эпидемиологического исследования NATION подтвердили, что диагностируется лишь 54% случаев СД 2 типа. Реальная цифра больных в России – не менее 9 млн (около 6% населения). В долгосрочной перспективе это может представлять чрезвычайную проблему. У значительной части пациентов патология не диагностирована. Следовательно, они не получают лечения и высок риск развития сосудистых осложнений [8–15].
У 90% больных СД имеет место неалкогольная жировая болезнь печени (НАЖБП) [16, 17]. Еще в 1996 г. эксперты Национального института здоровья США признали ее шестым компонентом метаболического синдрома.
В настоящее время НАЖБП считается самым распространенным заболеванием печени.
Неалкогольная жировая болезнь печени, так же как сахарный диабет, является основой полиморбидности. Прежде всего она ассоциируется с риском развития сердечно-сосудистых заболеваний [16–18].
НАЖБП представляет собой поражение печени, включающее жировую дистрофию с воспалением и повреждением гепатоцитов – неалкогольным стеатогепатитом (НАСГ) и фиброзом с возможностью перехода в цирроз. В 85–90% случаев патология протекает на фоне ожирения, дислипидемии, артериальной гипертензии, сахарного диабета 2 типа или нарушения толерантности к глюкозе [16–18].
При НАЖБП смертность в первый месяц после операции по трансплантации печени значительно превышает данный показатель при циррозах печени другой этиологии, также увеличивается риск осложнений. Речь, в частности, идет об отторжении трансплантата, развитии сепсиса и патологии со стороны сердечно-сосудистой системы [19, 20].
На сегодняшний день трансплантация печени остается единственным вариантом лечения, позволяющим улучшить прогноз у пациентов с терминальной стадией заболевания. Улучшение качества ведения больных в предоперационном периоде и иммуносупрессивная терапия позволили увеличить годовую, пятилетнюю и десятилетнюю выживаемость до 90, 85 и 70% соответственно [21–23].
Посттрансплантационная иммуносупрессивная терапия может вызывать ряд побочных эффектов, одним из которых является сахарный диабет.
Впервые посттрансплантационный сахарный диабет (ПТСД) был описан более 50 лет назад T.E. Starzl и соавт. [24]. Однако только недавно он был признан серьезным осложнением послеоперационного периода [25–27]. Частота возникновения ПТСД после трансплантации паренхиматозных органов варьируется от 2 до 53% [27, 28]. После трансплантации печени ПТСД развивается в 7–28% случаев [29].
Ключевую роль в развитии ПТСД может играть инсулинорезистентность (рис. 1). Последняя признана одной из главных причин эндотелиальной дисфункции, приводящей к развитию сердечно-сосудистых заболеваний и их осложнений [30, 31]. Это может утяжелять течение послеоперационного периода.
Инсулинорезистентность приводит к нарушению биологического ответа (метаболического и молекулярно-генетического) на экзогенный и эндогенный инсулин, метаболизма углеводов, жиров и белков, а также синтеза ДНК, регуляции транскрипции генов, процессов дифференцировки и роста клеток и тканей организма. В инициации инсулинорезистентности большое значение отводится пострецепторным нарушениям передачи сигнала инсулина, обусловленным, вероятно, повышением уровня фактора некроза опухоли α (ФНО-α), неэcтерифицированных жирных кислот. К факторам риска относят малоподвижный образ жизни, высококалорийную диету, возраст, курение, избыточный вес/ожирение и др. [32].
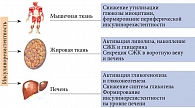
Причинами инсулинорезистентности клеток поперечнополосатых мышц могут быть дефекты транспорта глюкозы, обусловленные патологией глюкозного транспортера 4 (ГЛЮТ-4) [33] (рис. 2), а также модификация белков переносчиков глюкозы и белково-пептидных комплексов, что осуществляется на уровне гепатоцитов при их повреждении, в том числе при НАЖБП.
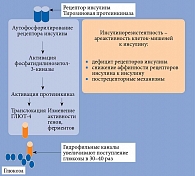
Необходимо отметить, что инсулинорезистентность может быть как причиной, так и следствием НАЖБП. Первопричиной она признается в рамках теории липотоксичности. С инсулинорезистентностью связывают поступление в печень большого количества свободных жирных кислот. В свою очередь НАЖБП способна усиливать и потенцировать инсулинорезистентность за счет патологии инсулиновых рецепторов, а также других цепей инсулинорезистентности. Рецептор к инсулину состоит из двух субъединиц – α и β. Субъединица α взаимодействует с инсулином вне клетки. Субъединица β связана со вторичными мессенджерами, субстратами инсулинового рецептора 1 и 2 типов. Рецептор к инсулину представляет собой тирозинкиназу. Посредством аутофосфорилирования активируются различные пути, в частности путь PI-3-K (фосфоинозитол-3-киназа), за счет которого происходит транспорт глюкозы внутрь клетки с помощью ГЛЮТ-4.
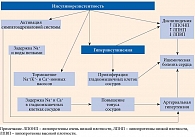
Установлено, что сахарный диабет 2 типа и неалкогольная жировая болезнь печени имеют общие патогенетические механизмы: активный липолиз свободных жирных кислот (СЖК) и синтез провоспалительных цитокинов. В частности, ФНО-α влияет на субстраты инсулинового рецептора, блокируя путь PI-3-K. Как следствие, блокируются эффекты этого пути на обмен глюкозы и глюкоза не может проникнуть внутрь клетки. Развивается инсулинорезистентность. Инсулиновые рецепторы становятся нечувствительны к инсулину, и его биологическая роль извращается. В условиях инсулинорезистентности печень начинает активно синтезировать жирные кислоты, триглицериды, ускоряется липолиз. Кроме того, в печени происходят процессы, приводящие к развитию сахарного диабета: стимулируется глюконеогенез, подавляется гликолиз и синтез гликогена (рис. 3 и 4).
Причинами перегруженности печени жирными кислотами являются синтез активных жирных кислот, снижение окисления жирных кислот и попадание в нее жира в составе хиломикронов. Печень теряет способность метаболизировать СЖК путем β-окисления. Включается перекисное окисление липидов, в результате чего в большом количестве продуцируются активные формы кислорода, возникает оксидативный стресс. Именно эти факторы приводят к фосфорилированию субстрата инсулинового рецептора. Запускается резистентность к инсулину. Возникает порочный круг. И определить, что было первичным, становится сложно.
В настоящее время цирроз в исходе НАЖБП занимает второе место среди причин трансплантации печени после цирроза печени вирусной этиологии [19, 20]. Как было отмечено ранее, смертность в первый месяц после операции значительно превышает данный показатель при циррозах печени другой этиологии. Кроме того, у пациентов с НАЖБП повышен риск других осложнений, таких как сепсис, отторжение трансплантата и развитие патологии со стороны сердечно-сосудистой системы [19, 20]. Проведенный в 2014 г. систематический обзор и метаанализ результатов и исходов трансплантации печени при НАСГ показал, что у таких пациентов достаточно высок риск развития осложнений со стороны сердечно-сосудистой системы [19, 20].
Согласно данным многочисленных исследований, НАЖБП является неотъемлемым компонентом метаболического синдрома наряду с изменениями углеводного и липидного обмена [34–38], в основе которых также лежит инсулинорезистентность.
Считается, что риск развития ПТСД увеличивают дисфункция β-клеток поджелудочной железы, нарушение секреции инсулина, связанное с использованием ингибиторов кальциневрина и ингибиторов мишени рапамицина млекопитающих комплекса 1 (mammalian target of rapamycin complex 1 – mTORC1), послеоперационное увеличение веса и гепатит С, ассоциированный с инсулинорезистентностью [39, 40].
Влияние ПТСД и ранее существующего СД на течение послеоперационного периода до конца неизвестно. В ряде исследований продемонстрировано негативное влияние ПТСД на выживаемость пациентов [41–46]. Результаты других исследований не подтверждают данного факта [47–49]. В этих исследованиях, как правило, не сравнивали влияние ПТСД и уже существовавшего СД [41, 43, 44, 48]. Кроме того, во многих из них наблюдение было ограничено по времени, что потенциально приводило к недооценке воздействия ПТСД и СД на выживаемость пациентов в послеоперационном периоде [42, 44, 47, 48]. Большинство исследований проводилось в Восточной Азии [41, 43, 44, 47, 48] и, следовательно, не отражало ситуацию в европейских странах [26].
На сегодняшний день исследование A.D. Aravinthan и соавт. – самый крупный нерегистрационный долгосрочный опыт лечения сахарного диабета, предиабета и посттрансплантационного сахарного диабета у пациентов после трансплантации печени [26]. Оно охватило полиэтническое население Западной Европы, в то время как большинство исследований, как было отмечено ранее, включает моноэтнические когорты из Восточной Азии [41, 43, 44, 47, 49].
Кроме того, в нем изучали факторы риска развития ПТСД, влияние предиабета и ПТСД на почечную и сердечно-сосудистую системы, а также риск развития рака de novo. Был сделан вывод, что ни предиабет, ни ПТСД не влияли на выживаемость пациентов, повторную трансплантацию или развитие рака de novo. Риск развития терминальной почечной недостаточности и серьезных сердечно-сосудистых осложнений был значительно выше у пациентов с предиабетом, чем у лиц без него. Влияние ПТСД на развитие сердечно-сосудистых осложнений и терминальной почечной недостаточности не различалось у пациентов с предиабетом и без СД, однако данные не получили статистической значимости [26].
У четверти пациентов, не страдавших сахарным диабетом, на момент трансплантации печени развился ПТСД, что соответствовало ранее представленным данным – от 19 до 35% [41, 43, 44, 50–53]. Однако в нескольких исследованиях сообщалось о более низком уровне заболеваемости – от 6 до 8% [47, 54].
Согласно данным A.D. Aravinthan и соавт. [26] и других исследователей, частота развития ПТСД была значительно выше в ранний посттрансплантационный период [44, 48, 52, 53]. Следует подчеркнуть, что демографические и клинические характеристики во время трансплантации печени у пациентов с предиабетом и постоперационным сахарным диабетом были схожими [44, 48, 52, 53].
В связи с риском развития ПТСД сразу после трансплантации печени встает ряд вопросов: является ли ПТСД клиническим проявлением ранее существовавшего субклинического предиабетического состояния, могут ли лица с риском развития ПТСД быть идентифицированы при проведении тщательных исследований?
Согласно результатам ретроспективного исследования, проведенного E.J. Carey и соавт., двукратное увеличение риска развития ПТСД связано с превышением уровня глюкозы плазмы на каждые 10 мг/дл перед трансплантацией печени [55].
Высказано предположение, что широкий спектр факторов у реципиента и донора, причин и тяжести заболевания печени, а также особенности и длительность оперативного вмешательства и лечения в посттрансплантационном периоде играют важную роль в развитии ПТСД [41, 43, 44, 50–58].
Метаанализ 19 ретроспективных исследований в отношении более 4500 пациентов, проведенный D.W. Li и соавт., позволил выявить независимые факторы риска развития ПТСД [59]. К таковым были отнесены мужской пол, индекс массы тела, этиология гепатита С, нарушение уровня глюкозы плазмы натощак перед трансплантацией печени и использование такролимуса. В данном метаанализе такие показатели, как возраст реципиента, этиология НАЖБП и факторы донора, не оценивались.
Несмотря на то что A.D. Aravinthan и соавт. включили в свой регистр ряд факторов, которые связаны с развитием ПТСД, для уменьшения разброса данных при множественных сравнениях была использована поправка Холма – Бонферрони (процедура множественных проверок гипотез и групповая вероятность ошибки) [26]. Независимыми факторами риска развития ПТСД ими признаны этиология НАЖБП, а также применение сиролимуса и такролимуса [26].
Сиролимус – иммунодепрессивное средство, механизм действия которого отличается от механизма действия других иммунодепрессантов. Он подавляет активацию T-клеток за счет блокирования Ca2+-зависимой и Ca2+-независимой внутриклеточной передачи сигнала. Связывается со специфическим цитозольным белком – иммунофилином (FK-связывающим белком 12 – FKPB-12). Комплекс «FKPB-12 – сиролимус» подавляет активацию мишени рапамицина млекопитающих. Ингибирование mTOR приводит к блокаде нескольких специфических путей преобразования сигнала и в конечном итоге к подавлению активации лимфоцитов и снижению иммунитета. Уменьшает активность T- и B-лимфоцитов и подавляет отторжение аллогенного трансплантата, подавляет инактивацию гликогенолиза в печени, опосредованную инсулином [60], вызывает снижение количества протоковых клеток поджелудочной железы человека и ингибирует секрецию инсулина, стимулированную глюкозой [61], что потенциально объясняет его роль в развитии ПТСД. Препарат используется для профилактики отторжения трансплантата (у взрослых больных с низким и умеренным иммунологическим риском после трансплантации почки и печени), в комбинации с глюкокортикостероидами и циклоспорином в течение двух-трех месяцев.
В качестве потенциальных механизмов ПТСД, связанного с применением такролимуса, были предложены снижение секреции инсулина и повышение инсулинорезистентности [62].
Такролимус является иммунодепрессантом из группы природных макролидов. Он был открыт в Японии в 1987 г. На молекулярном уровне эффекты и внутриклеточная кумуляция такролимуса обусловлены связыванием с FKBP-12. Комплекс «FKBP-12 – такролимус» специфически и конкурентно ингибирует кальциневрин, что обеспечивает Ca-зависимое блокирование путей передачи Т-клеточных сигналов и предотвращает транскрипцию дискретного ряда лимфокинных генов.
Такролимус активно метаболизируется в печени, главным образом при участии изофермента CYP3A4. Это один из наиболее важных ферментов, участвующих в метаболизме ксенобиотиков. Преимущественно находится в печени и кишечнике. Метаболизм такролимуса интенсивно протекает в стенке кишечника. В настоящее время идентифицировано несколько метаболитов такролимуса. В экспериментах in vitro показано, что только один из метаболитов обладает иммуносупрессивной активностью, близкой к активности такролимуса. Иммуносупрессивная активность других метаболитов слабая или вообще отсутствует. В системном кровотоке обнаружен только один из метаболитов такролимуса, при этом в низких концентрациях. Таким образом, фармакологическая активность такролимуса практически не зависит от метаболитов.
Согласно данным A.D. Aravinthan и соавт., НАЖБП и ПТСД могут быть связаны с субклиническим предиабетическим статусом пациентов [26].
Однако ни предиабет, ни ПТСД отрицательно не повлияли на выживаемость пациентов и повторную трансплантацию. Несмотря на оптимальный контроль гликированного гемоглобина после трансплантации печени, предиабет ассоциировался с ухудшением почечных и сердечно-сосудистых исходов. Возможные причины этого – наличие микро- и макрососудистых повреждений органов-мишеней еще до постановки диагноза СД [63] и сомнительная надежность гликированного гемоглобина как маркера гликемического контроля [64].
Данные литературы о влиянии как предиабета, так и ПТСД на исходы при трансплантации других солидных органов ограничены и противоречивы. Так, в южнокорейском исследовании у 176 реципиентов почечного трансплантата без диабета после трансплантации был выявлен ПТСД, что привело к увеличению частоты сердечно-сосудистых заболеваний, но не влияло на выживаемость трансплантата или пациента [65]. В одноцентровом португальском исследовании с участием 648 реципиентов почечного трансплантата было показано, что ПТСД не влиял на почечную функцию, сердечно-сосудистые события, выживаемость трансплантата и пациентов [66].
Аналогичные результаты получены в исследовании, проведенном в Южной Африке [67]. В нем приняли участие 111 реципиентов почечного трансплантата. ПТСД не влиял на выживаемость трансплантата или пациентов.
Однако в многоцентровом исследовании с участием более 2000 реципиентов почечного трансплантата из пяти североамериканских и двух европейских центров установлена независимая связь ПТСД с выживаемостью трансплантата [68]. Необходимо подчеркнуть, что в этом исследовании не удалось изучить влияние ПТСД на выживаемость пациентов и другие исходы.
В реестровом исследовании с участием более 9000 реципиентов трансплантата легких показано, что как предиабет, так и ПТСД отрицательно влияли на выживаемость пациентов [69].
У лиц с транзиторной гипергликемией наиболее частой причиной заболевания печени был гепатит С [70].
Не меньший интерес представляет другой, специфический для гепатита С механизм развития резистентности к инсулину [61]. Убедительно доказана ее связь с инфицированием вирусом гепатита С и развитием гепатита [71–75]. Вирусная инсулинорезистентность обусловлена непосредственным и опосредованным (через провоспалительные цитокины) действием вируса на инсулиновый каскад. Вирус угнетает инсулиновый рецепторный субстрат 1 и 2, провоспалительные цитокины подавляют тирозинкиназное фосфорилирование инсулиновых рецепторов и функции генов, кодирующих белки каскада [76, 77].
Подтверждением участия вируса в развитии инсулинорезистентности при хроническом гепатите С служат данные о повышении чувствительности к инсулину у больных с устойчивым ответом на противовирусную терапию и сохранении инсулинорезистентности в отсутствие элиминации вируса [78].
Инсулинорезистентность приводит к развитию гиперинсулинемии, которая является важным механизмом формирования фиброза печени. Гиперинсулинемия стимулирует синтез внеклеточного матрикса звездчатыми клетками, что приводит к прогрессированию фиброгенеза [79].
Вопросы о роли гепатита С в развитии транзиторной гипергликемии в период непосредственно после трансплантации печени и причинах отсутствия гипергликемии после первых шести месяцев остаются открытыми.
Необходимым условием благоприятного течения посттрансплантационного периода является своевременная диагностика СД и его адекватная терапия.
Общие подходы к лечению ПТСД пока не разработаны. Пациентам требуется индивидуальная лекарственная коррекция под наблюдением эндокринолога и гепатолога. Безусловно, клеткам печени, обремененным патологически измененным метаболизмом при сахарном диабете, будет труднее справляться с токсическим воздействием, потому что для данного органа характерен пониженный функциональный резерв. Следовательно, при назначении терапии надо отдавать предпочтение препаратам, которые меньше всего метаболизируются в печени.
У пациентов с СД после трансплантации печени необходимо осуществлять не только адекватную иммуносупрессивную терапию, но и сахароснижающую.
При ПТСД есть вероятность повторного развития НАЖБП, гепатита С и токсических поражений печени, что также обусловливает избегание назначения препаратов, которые метаболизируются в печени.
В настоящее время препаратом выбора остается инсулин.
M.V. Shinkin, L.A. Zvenigorodskaya, MD, PhD, Prof., A.M. Mkrtumyan, MD, PhD, Prof., A.O. Akopova
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Mikhail V. Shinkin, jendis@yandex.ru
Diabetes mellitus is a significant problem for patients around the world. It leads to significant morbidity and mortality due to a number of macrovascular and microvascular complications. In addition, diabetes is also associated with an increased risk of developing several types of cancer. It is an important risk factor for the development of non-alcoholic fatty liver disease (NAFLD), which is a major cause of cirrhosis, liver cancer and eventually liver transplant (LT). In addition, the presence of diabetes increases the risk of death in patients with liver disease.
Liver transplantation in patients with cirrhosis as a result of NAFLD currently occupies the 2nd place after cirrhosis of the liver of viral etiology.
In addition, the presence of diabetes increases the risk of death in patients with liver disease, negatively affects the results of liver transplantation (LT) and the quality of life of patients in the postoperative period.
Post-transplant diabetes mellitus is more severe and leads to more severe systemic microcirculatory complications, can cause the development of NAFLD in the transplanted liver and lead to its rapid progression up to liver cirrhosis.
In the context of immunosuppressive therapy after LT, diabetes treatment presents certain difficulties and is not always effective.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.