Оценка эффективности терапии железодефицитной анемии у беременных препаратом Мальтофер
- Аннотация
- Статья
- Ссылки
- English


Введение
Железодефицитная анемия (ЖДА) – одно из наиболее распространенных осложнений при беременности, которое развивается вследствие нарушения равновесия между повышенным расходом железа и его поступлением в организм. ЖДА оказывает неблагоприятное влияние на состояние матери, плода и новорожденного [1, 2].
Современный образ жизни и питания предрасполагает к тому, что дефицит железа весьма распространен как в развивающихся, так и в развитых странах. В странах с высоким уровнем жизни населения и более низкой рождаемостью ЖДА диагностируют у 8–20% беременных, тогда как в экономически неблагоприятных регионах частота ЖДА у беременных достигает 80% [3].
На фоне ЖДА существенно ухудшается как течение беременности и родов, так и состояние плода. У беременных с анемией значительно выше риск самопроизвольного выкидыша и преждевременных родов, хронической гипоксии и задержки внутриутробного роста плода. Роженицы чаще подвержены слабости родовой деятельности и кровотечениям, родильницы – гнойно-воспалительным процессам и другим осложнениям послеродового периода [4].
Дефицит железа во время беременности и лактации
Железо – это микроэлемент, который попадает в организм только алиментарным путем. Недостаточное поступление железа в организм возможно либо при низком его содержании в пищевом рационе, либо при общем ограничении принимаемой пищи. При сбалансированном питании в желудочно-кишечный тракт (ЖКТ) ежедневно с пищей поступает около 20–30 мг железа, из которого только 1–2 мг попадает в плазму крови. Место всасывания железа – тонкий кишечник. В пище железо находится в трехвалентном виде. Снижение всасывания железа – достаточно распространенная причина возникновения его дефицита, оно возможно при различных заболеваниях ЖКТ, таких как гастриты и энтериты, а также при резекции желудка и кишечника. Кроме того, всасывание двухвалентного железа, в отличие от трехвалентного, может снижаться при взаимодействии этого микроэлемента с определенными лекарственными средствами и пищевыми ингредиентами.
Недостаточное поступление железа в организм в результате определенного пищевого поведения и сниженного всасывания его в ЖКТ – это те причины развития железодефицитного состояния, которые не имеют гендерных различий. Остальные причины дефицита железа, а именно повышение потребности в нем при различных физиологических состояниях и хронической кровопотере, встречаются в основном у женщин, поэтому частота развития ЖДА у них в несколько раз выше, чем у мужчин. В первую очередь ЖДА наблюдается при беременности и лактации.
Потребность в железе во время беременности увеличивается на 1070 мг, расходование его распределяется следующим образом: 300 мг на формирование плода, 100 мг для плаценты и пуповины, 50 мг для увеличения размеров матки, 620 мг на обеспечение собственных потребностей и увеличения эритроцитарной массы [5]. Плод расходует железо не только для обеспечения собственного эритропоэза, но и для функционирования тканей своего организма, а в последние два месяца – для образования резервов в печени, селезенке и костном мозге. Для обеспечения этих процессов суточная потребность в железе в период беременности и нормально протекающих родов удваивается [6]. Часть требуемого количества микроэлемента компенсируется увеличением резорбции алиментарного железа в кишечнике, которая достигает 2,5–3,0 мг в сутки. Но, несмотря на это, расход железа превышает его поступление в среднем на 250 мг. В физиологических условиях эта недостаточность компенсируется выведением из депо запасов железа, что не отражается на общем состоянии и гематологических показателях. За период беременности депо железа уменьшается в среднем на 50%. При истощении запасов развивается ЖДА, чаще к третьему триместру беременности. Практически у 90% беременных ко второй половине гестационного периода отмечается дефицит железа [7].
Во время беременности в организме женщины происходят существенные изменения во многих органах и системах, в том числе затрагивающие систему крови. Например, на 50% от исходного увеличивается объем циркулирующей крови, составляя 10% массы тела женщины, тогда как вне беременности этот показатель не превышает 0,5%. Увеличение объема циркулирующей крови происходит в основном за счет прироста на 40% объема циркулирующей плазмы, тогда как объем циркулирующих эритроцитов увеличивается всего лишь на 15%. Такие изменения активируют обменные процессы в плаценте, способствуя переходу через плаценту органических веществ, электролитов, газов и т.д., улучшают обмен веществ в материнском организме, вызывая дилюцию фетальных продуктов жизнедеятельности и облегчение их выведения, предупреждают тромбообразование. Эти транзиторные изменения крови носят название олигоцитемической гиперволемии, синонимами которой являются гиперплазмия беременных, гиперволемия, гемодилюция, гидремия, псевдоанемия [8]. Закономерным результатом вышеуказанных физиологических изменений становятся снижение среднего значения гемоглобина, уменьшение количества эритроцитов приблизительно на 10%, снижение гематокрита на 5–7%, нижняя граница нормы которого устанавливается на 32–34%. Цветовой показатель при этом колеблется в пределах 0,9–1,05, а количество ретикулоцитов может повышаться.
До настоящего времени нет единого мнения о том, считать гиперплазмию беременных физиологическим или патологическим железодефицитным состоянием. Некоторые авторы рассматривают физиологическую гидремию как самую легкую форму анемии, вызванной беременностью и не существующей вне ее. Другие авторы не считают это патологическим состоянием, в пользу чего говорит отсутствие морфологических изменений эритроцитов [9].
Допустимыми пределами физиологической гемодилюции при беременности считаются снижение показателей гемоглобина до 110 г/л, эритроцитов – до 3,6 × 1012/л, гематокрита – до 32–34%. Эти показатели у небеременных женщин считаются нормальными при значениях гемоглобина от 120 до 140 г/л, эритроцитов – 3,7–4,7 × 1012/л, гематокрита – от 36 до 42%. Дальнейшее снижение показателей красной крови в условиях повышенной потребности организма беременной в железе следует расценивать как истинную анемию [10].
Экспертами Всемирной организации здравоохранения принята следующая классификация анемии у беременных:
- анемия легкой степени тяжести – концентрация гемоглобина в крови от 90 до 110 г/л;
- умеренно выраженная анемия – концентрация гемоглобина в крови от 89 до 70 г/л;
- тяжелая анемия – концентрация гемоглобина в крови менее 70 г/л.
Во время лактации суточная потребность в железе увеличивается в десять раз. Потери железа при каждой беременности, родах и за время лактации составляют 700–900 мг (до 1 г). Дефицит железа, обусловленный беременностью и лактацией, восполняется в течение двух – четырех лет [10, 11]. Если женщина повторно рожает раньше этого срока, у нее неизбежно развивается анемия.
Клиническая картина
Клинические проявления железодефицитных состояний зависят от степени дефицита железа, скорости его развития и включают симптомы анемии и тканевого дефицита железа (сидеропению). Биологическая значимость железа определяется его участием в тканевом дыхании. В связи с этим для ЖДА у беременных характерны тканевая гипоксия и связанные с этим осложнения. В легких случаях анемии общие симптомы могут отсутствовать, поскольку компенсаторные механизмы (усиление эритропоэза, активация функций сердечно-сосудистой и дыхательной систем) удовлетворяют физиологическую потребность тканей в кислороде. Клиническая симптоматика наблюдается обычно при анемии средней тяжести и нарастает при тяжелой анемии. Она обусловлена неполным обеспечением кислородом и проявляется следующими жалобами:
- общая слабость, быстрая утомляемость;
- головокружение, головные боли, шум в ушах;
- сердцебиение, неприятные ощущения в области сердца;
- одышка;
- обмороки;
- бессонница;
- извращение вкусовых ощущений;
- нарушение глотания с ощущением инородного тела в горле (синдром Пламмера – Винсона).
Мальтофер в лечении железодефицитной анемии
При выявлении причины развития ЖДА (энтерит, алиментарная недостаточность и др.) основное лечение должно быть направлено на ее устранение. В коррекции дефицита железа и уровня гемоглобина у больных ЖДА предпочтение следует отдавать лекарственным препаратам, а не продуктам питания, содержащим железо.
В большинстве случаев для коррекции дефицита железа в отсутствие специальных показаний препараты железа назначают внутрь. Парентеральный путь введения препаратов железа у большинства беременных без специальных показаний считается нецелесообразным [11, 12].
Одним из наиболее эффективных препаратов для лечения ЖДА является Мальтофер (VIFOR (International) Inc., Швейцария). Препарат Мальтофер содержит железо в виде полимальтозного комплекса гидроокиси железа (III). Железо в гидроксид-полимальтозном комплексе находится в связанном виде, подобном состоянию железа в ферритине. Комплекс стабилен и не расщепляется в обычных физиологических условиях, не выделяет железо в виде свободных ионов, по структуре сходен с естественными соединениями железа. Его молекула имеет большую молекулярную массу – 50 кД, которая настолько велика, что ее диффузия через мембраны слизистой оболочки кишечника приблизительно в 40 раз меньше, чем у гексагидрата железа (II). Комплекс состоит из центральной решетки, образованной ядрами трехвалентного железа, окруженной массой молекул полимальтозы. Он не обладает прооксидантными свойствами, которые могут приводить к окислению липопротеидов низкой и очень низкой плотности. Кроме того, препарат не содержит декстранов, повышающих вероятность развития анафилактических реакций [2, 5, 7, 12].
Структура Мальтофера сходна с естественным соединением железа ферритином. Благодаря такому сходству железо (III) поступает из кишечника в кровь путем активного транспорта. Всосавшееся железо связывается с ферритином и хранится в организме, преимущественно в печени. Затем в костном мозге оно включается в состав гемоглобина. Существует корреляция между выраженностью дефицита железа и уровнем его всасывания (чем больше выраженность дефицита железа, тем лучше всасывание).
В связи с вышеизложенным после приема Мальтофера внутрь железо комплекса активно абсорбируется преимущественно в двенадцатиперстной и тощей кишке посредством обмена с железосвязывающими белками, находящимися в гастроинтестинальной жидкости и эпителии слизистой оболочки ЖКТ. Необходимо подчеркнуть, что из кишечника железо поступает в кровь только путем активного всасывания, что объясняет невозможность передозировки препарата и интоксикации в отличие от простых солей железа, всасывание которых происходит по градиенту концентрации. Степень абсорбции зависит не только от выраженности дефицита железа, но и от дозы препарата (чем выше доза, тем хуже абсорбция). Невсосавшаяся часть железа выводится из организма с калом [13].
Экспериментальное изучение влияния Мальтофера на репродукцию у животных не выявило какого-либо риска для плода. Результаты контролируемых исследований с участием беременных не продемонстрировали вредных воздействий препарата на мать и плод в первом триместре беременности. Не обнаружено доказательств тератогенного воздействия Мальтофера во время первого триместра, то есть возможность его отрицательного влияния на плод маловероятна [13].
Клинический опыт показывает, что пероральные препараты железа, особенно его простые соли, вызывают неприятные побочные явления, включающие тошноту, боли в животе, диарею и запор. Индивидуальная чувствительность к терапии железом варьируется.
Фармакокинетические и клинические исследования, проведенные с применением препарата Мальтофер, показали, что компоненты пищи и другие лекарства не снижают биодоступность железа [13]. Мальтофер может приниматься во время еды и одновременно с другими препаратами в отличие от простых солей железа, которые рекомендуется принимать минимум за час до приема пищи.
В настоящее время Мальтофер включен в протокол ведения больных ЖДА, утвержденный Минздравом России. Согласно указанному документу, продолжительность лечения клинически выраженного дефицита железа (ЖДА) составляет три – пять месяцев до нормализации уровня гемоглобина. После этого прием препарата следует продолжить в дозировке для лечения латентного дефицита железа в течение еще нескольких месяцев, а для беременных – минимум до родов для восстановления запасов железа. Продолжительность терапии латентного дефицита железа составляет один-два месяца.
Доза препарата рассчитывается индивидуально и адаптируется в соответствии с общим дефицитом железа по следующей формуле: общий дефицит железа (мг) = масса тела (кг) × (нормальный уровень гемоглобина – уровень гемоглобина больного) (г/л) × 0,24 + железо запасов (мг).
Данные по безопасности, полученные во время клинических исследований препарата Мальтофер, свидетельствуют о низкой частоте побочных эффектов, что обеспечило большую комплаентность лечения по сравнению с препаратами простых солей железа, особенно при применении препарата у беременных, младенцев и детей. Только в редких случаях наблюдались симптомы раздражения ЖКТ, такие как чувство переполнения желудка, давление в области эпигастрия, тошнота, запор или диарея.
После нормализации уровня гемоглобина рекомендуется продолжить прием антианемических препаратов внутрь в профилактических дозах в течение шести месяцев [4, 6]. Лечение ЖДА всегда длительно, а эффективность напрямую зависит от переносимости препарата пациентом: хорошая переносимость обеспечивает высокую приверженность к лечению и, таким образом, увеличивает вероятность успеха терапии. Современные пероральные препараты железа редко вызывают значительные побочные явления, требующие отмены приема и перехода на парентеральный путь введения. Нежелательные явления на фоне применения пероральных препаратов железа обычно возникают со стороны ЖКТ: тошнота, металлический привкус во рту, запор (что, возможно, объясняется связыванием в кишечнике сероводорода, стимулирующего перистальтику), реже – диарея, анорексия.
Цель исследования
Изучение эффективности терапии железодефицитной анемии у беременных препаратом Мальтофер.
Материал и методы
Под наблюдением в течение 2016–2017 гг. находилось 62 беременных с одноплодной беременностью и ЖДА легкой степени тяжести. Критерии включения в исследование: концентрация гемоглобина от 90 до 110 г/л, сывороточного железа 12,5 мкмоль/л и ниже, ферритина ≤ 20 мкг/л, гестационный срок 28 недель и более.
Основную группу составили 35 беременных, получавших препараты железа, группу сравнения – 27 беременных, не получавших препараты железа. Для терапии ЖДА в основной группе использовали препарат Мальтофер (железа (III) гидроксид полимальтозат, эквивалентно 100 мг железа) в дозе по одной жевательной таблетке два раза в день. Средняя продолжительность лечения составила 43,6 ± 2,4 дня. Эффективность терапии оценивали по динамике гематологических показателей и показателей обмена железа.
Всем беременным была рекомендована лечебная диета № 11, подразумевающий употребление повышенного количества белковой пищи, которая в свою очередь улучшает усвояемость железа организмом и необходима для построения гемоглобина. Кроме того, в меню беременных включались продукты, богатые микроэлементами, участвующими в кроветворении (железо, кобальт, цинк, марганец). Перечисленные микроэлементы содержатся во многих крупах, мясных продуктах, овощах и зелени. Кроме того, рекомендовалось употреблять продукты, ускоряющие всасывание железа: овощи и фрукты, богатые аскорбиновой кислотой (цитрусовые, киви, кисло-сладкие ягоды, сладкий перец, бобовые).
Пациентки обеих групп были сопоставимы по возрасту и паритету. Возраст беременных колебался от 20 до 37 лет и в среднем составил 26,4 ± 1,6 года для пациенток основной группы и 25,4 ± 2,1 года – для группы сравнения. Исходное значение гемоглобина в основной группе колебалось от 90 до 110 г/л и в среднем составило 100,3 ± 2,0 г/л, в группе сравнения – 104,2 ± 1,3 г/л.
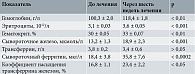
У всех беременных до и через шесть недель после начала исследования измерялись гематологические и феррокинетические параметры: гемоглобин, гематокрит, эритроциты, сывороточное железо, сывороточный ферритин, трансферрин, а также определялся коэффициент насыщения трансферрина железом. После родов, на третьи сутки, определяли уровень гемоглобина, гематокрита, эритроцитов.
Количество эритроцитов, концентрацию гемоглобина в периферической крови, гематокрит определяли на приборе Micros 60 (Франция), концентрацию железа, ферритина и трансферрина в сыворотке – на биохимическом анализаторе Коnе Ultra (Финляндия) с использованием стандартных реактивов. Коэффициент насыщения трансферрина железом, отражающий процент насыщения трансферрина железом, определяли по стандартной формуле. Статистическая обработка результатов выполнялась с использованием прикладных программ для статистической обработки Excel версия 7.0, раздел программы «Анализ данных». Различия между сравниваемыми величинами признавали статистически достоверными при уровне значимости р < 0,05.
Результаты и их обсуждение
При анализе осложнений беременности в первом и втором триместрах пациентки обеих групп были сопоставимы. Через естественные родовые пути произошли роды у 25 (71,4%) беременных основной группы и у 17 (63%) – группы сравнения. У всех женщин родились живые дети, из них 33 (97,1%) доношенных в основной группе и 26 (96,1%) – в группе сравнения. Средняя масса тела новорожденных составила 3420 ± 68 г в основной группе и 3359 ± 68 г в группе сравнения.
Объем кровопотери в среднем составил в основной группе 545 ± 52 мл, в группе сравнения – 558 ± 51 мл.
Кроме того, анализировался характер жалоб при беременности и после родоразрешения. Основные жалобы: слабость, шум в ушах, повышенная утомляемость, головокружение, одышка при физической нагрузке. После проведенного курса лечения препаратом Мальтофер количество жалоб у больных уменьшилось, одышка и мышечная слабость исчезли у всех пациенток основной группы. У пациенток, не принимавших препараты железа, характер жалоб не изменился. Клинический и гематологический эффекты были получены через четыре-пять недель приема препарата у 80% больных.
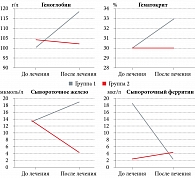
Количество эритроцитов, уровень гемоглобина, гематокрита, железа, трансферрина, ферритина в сыворотке крови у обследованных женщин обеих групп приведены в табл. 1 и 2, а также на рис.
Как видно из таблиц 1 и 2, у беременных, получавших терапию анемии препаратом Мальтофер, были достоверно выше как гематологические показатели (гемоглобин и количество эритроцитов, гематокрит), так и показатели обмена железа в сыворотке (уровень сывороточного железа, сывороточного ферритина, коэффициент насыщения трансферрина железом) по сравнению с пациентками, не получавшими терапии. Для объективной оценки эффективности лечения в основной группе был подсчитан рост каждого показателя по отношению к исходному уровню, выраженный в процентах. Прирост средних значений гематологических показателей на фоне лечения составил для гемоглобина – 8,5%, для гематокрита – 9,1%, для эритроцитов – 8,6%, что соответствует удовлетворительному результату лечения.
Стоит отметить, что, по данным анализа гематологических показателей после родоразрешения, у пациенток группы сравнения были достоверно снижены все гематологические показатели (табл. 3).
Таким образом, у беременных с анемией на фоне лечения препаратом Мальтофер происходит достоверная нормализация феррокинетических показателей, что приводит к улучшению оксигенации тканей и благоприятным изменениям в организме и, как следствие, положительному клиническому эффекту.
Заключение
На основании анализа данных литературы можно сделать вывод о том, что при ЖДА неионные препараты железа, например Мальтофер, обладают выраженной терапевтической эффективностью и высокой безопасностью. Они характеризуются хорошей переносимостью со стороны ЖКТ, не взаимодействуют с компонентами пищи и применяемыми одновременно хелатными лекарственными средствами.
Эффект от лечения препаратами железа наступает постепенно, в связи с чем терапия должна быть длительной. Повышение уровня ретикулоцитов (ретикулоцитарный криз) отмечается на 8–12-й день при адекватном назначении препаратов железа в достаточной дозе, концентрации гемоглобина – к концу третьей недели. Нормализация показателей красной крови наступает только через пять – восемь недель лечения. Однако общее состояние больных улучшается гораздо раньше.
Таким образом, терапия ЖДА у беременных и родильниц препаратом Мальтофер является высокоэффективной, приводит к нормализации показателей гемограммы, улучшению общего состояния пациенток, снижению акушерских и неонатальных осложнений.
V.L. Tyutyunnik, N.E. Kan, O.I. Mikhailova, N.V. Dubrovina
V.I. Kulakov Obstetrics, Gynecology and Perinatology Research Center, Moscow
Contact person: Olga Igorevna Mikhailova, o_mikhailova@oparina4.ru
The article presents the main pathogenetic mechanisms of the development of iron deficiency anemia in pregnant women. In this regard, the effectiveness of iron deficiency anemia therapy in pregnant women by Maltofer has been studied. It has been shown that iron deficiency anemia therapy in pregnant women and puerperas by Maltofer is highly effective, results in normalization of hemogram parameters, improvement of the general condition of patients, and reduction in obstetric and neonatal complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.