Патогенетическая терапия диабетической невропатии при сахарном диабете 2 типа
- Аннотация
- Статья
- Ссылки
- English
Введение
По данным Всемирной организации здравоохранения, сахарный диабет (СД) – это глобальная медицинская и социально-экономическая проблема ввиду широкой распространенности и высокого риска развития серьезных осложнений, нередко представляющих угрозу для жизни. Рост заболеваемости наблюдается уже в течение многих лет и достиг в ХХІ в. масштабов пандемии. По данным Международной диабетической федерации (International Diabetes Federation), в мире насчитывается более 350 млн больных СД, в том числе около 4 млн в Российской Федерации. Однако эта цифра считается заниженной, поскольку не всегда вовремя выявляются и ставятся на учет лица с повышенным уровнем глюкозы и нарушенной толерантностью к глюкозе [1, 2].
СД поражает нервную систему, поэтому при обследовании у пациентов с СД можно выявить симптомы и центральной, и периферической невропатии. Центральная невропатия развивается при нарушении функций центральной нервной системы и проявляется такими заболеваниями, как инсульт, энцефалопатия, миелопатия, энцефаломиелопатия, острые нервно-психические расстройства. К периферической невропатии относят острую диффузную невропатию, хроническую дистальную симметричную сенсомоторную невропатию, мононевропатию, в том числе множественную мононевропатию, невропатию черепно-мозговых нервов, радикулопатию, плексопатию. Для автономной (висцеральной) невропатии характерно поражение внутренних органов.
Согласно статистике у каждого второго пациента с СД выявляется диабетическая дистальная симметричная сенсорно-моторная полиневропатия – наиболее изученный и распространенный вариант диабетической невропатии [3, 4].
Поскольку СД и его осложнения длительно протекают бессимптомно, многие пациенты могут не подозревать о том, что больны. В этой связи очень важно контролировать уровень глюкозы и гликированного гемоглобина, своевременно диагностировать и лечить осложнения СД. Лечебные и профилактические мероприятия необходимо начинать уже при нарушенной толерантности к глюкозе.
Выделяют три стадии диабетической невропатии:
- субклиническую. Симптомы незначительные. Диагностируется при проведении электромиографического исследования или биопсии нерва;
- стадию клинических проявлений. Диагностируется при общеклиническом обследовании;
- стадию осложнений диабетической невропатии.
Как правило, диагноз диабетической невропатии ставится на второй или третьей стадии. Поздняя диагностика осложняет лечение и ухудшает прогноз. Все это определяет актуальность проблемы СД 2 типа и диабетической невропатии [5–7].
Сложный патогенез и механизм развития диабетической невропатии обусловлены нарушениями метаболизма и микроциркуляции. Высокая концентрация глюкозы оказывает токсическое действие на нервную ткань. Активизация в условиях гипергликемии полиолового пути при участии внутриклеточного фермента альдозоредуктазы способствует превращению глюкозы в сорбитол, а затем при участии фермента сорбитол-дегидрогеназы – во фруктозу. Повышение концентрации сорбитола и фруктозы токсично для нервных клеток. Увеличивается осмолярность цитоплазмы, что приводит к осмотическому дисбалансу, отеку, набуханию, подавлению синтеза важнейшего компонента миелина – миоинозитола и снижению активности Na(+), K(+)-АТФазы. Эти патологические процессы способствуют нарушению проведения нервного импульса.
В результате гликозилирования белков, присоединения молекул глюкозы к аминогруппам белка повреждаются различные белковые молекулы, структурные компоненты клеточных и базальных мембран, белки-ферменты, рецепторные белки и белки, находящиеся в системе циркуляции, что нарушает метаболические, транспортные и другие жизненно важные процессы, которые они регулируют.
Токсическое действие гипергликемии на эндотелий сосудов приводит к снижению эндоневрального кровотока, нарушению капиллярной проницаемости, увеличению эндоневральной васкулярной сопротивляемости, уменьшению эндоневрального кислородного напряжения и в конечном итоге – тканевой гипоксии.
Гипергликемия способствует образованию кетоальдегидов, свободнорадикальных форм кислорода. Активация этого процесса повреждает клетки нервной системы и снижает защитную функцию естественных антиоксидантных систем организма. Все эти патологические процессы повышают уровень продуктов свободнорадикального окисления и оказывают повреждающее действие на клетки и ткани [2–4].
Окислительному стрессу принадлежит ведущая роль в развитии осложнений СД. Собственная антиоксидантная система организма при СД не способна противостоять этому патологическому процессу. Окислительный стресс, блокада гексозоаминового пути утилизации глюкозы с накоплением промежуточных продуктов обмена глюкозы запускают активацию протеинкиназы С и образование большого числа конечных продуктов избыточного гликирования белков. Причиной блокады обмена глюкозы является активизация регенеративных полимераз, возникающая в ответ на разрушение митохондриальной ДНК одним из наиболее активных свободных радикалов – супероксидом. В результате изменяется структура эндотелия сосудистой стенки, ухудшаются реологические свойства крови, нарушаются эндотелийзависимые реакции и функции структур нервных клеток, поражаются волокна периферических нервов. Этим объясняется эффективность при диабетической невропатии антиоксидантов.
Проведенные многочисленные международные и российские исследования убедительно доказали, что ведущим патогенетическим средством с антиоксидантной активностью является альфа-липоевая, или тиоктовая, кислота (АЛК), которая была открыта еще в 1948 г. АЛК – неотъемлемая часть клеток органов и систем организма. Будучи физиологическим антиоксидантом, АЛК образуется в организме при окислительном декарбоксилировании альфа-кетокислот и пировиноградной кислоты.
АЛК представляет собой рацемическую смесь R(+)- и S(-)-изомеров. АЛК растворяется и в воде, и в липидах, что позволяет ей проникать через билипидный слой мембран в цитоплазму клеток. В организме АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая нейтрализует свободные радикалы, супероксиды, снижает активность перекисного окисления липидов, увеличивает активность супероксиддимутазы и каталазы, улучшает эндоневральный кровоток и скорость распространения возбуждения по периферическим нервам. Способность АЛК действовать в качестве ловушки свободных радикалов подтверждена в экспериментальных исследованиях на животных и в клинических исследованиях.
АЛК участвует в митохондриальном обмене веществ клетки, высвобождении энергии из глюкозы аэробным путем. Выполняет функцию кофактора в комплексе превращения веществ, обладающих выраженным антитоксическим действием. Эти вещества защищают клетку от реактивных радикалов, образующихся при промежуточном обмене веществ или распаде экзогенных чужеродных веществ. Благоприятно воздействует на энергетический, углеводный и липидный обмен. Оказывает цитопротективное, нейротропное, гепатопротективное и детоксикационное действие. По характеру биохимического действия АЛК близка к витаминам группы В.
Препараты АЛК выпускаются в виде раствора для инфузий и таблеток, покрытых оболочкой.. Оптимальный курс лечения включает введение внутривенно капельно 600 мг на 250 мл физиологического раствора (медленно в течение 40 минут) на протяжении 10–15 суток с переходом на пероральный прием по 600 мг/сут за 30 минут до еды в течение одного – шести месяцев [8–10]. Препараты АЛК хорошо переносятся и практически не вызывают побочных эффектов.
Цель
Сравнительная оценка эффективности разных по длительности курсов применения альфа-липоевой кислоты (препарата Берлитион®) у пациентов с СД 2 типа и диабетической невропатией.
Материал
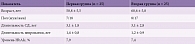
В клинико-диагностическом центре было проведено комплексное обследование 50 амбулаторных больных (15 мужчин, 35 женщин, средний возраст 61,4 года) с СД 2 типа (срок заболевания от трех и более лет) и жалобами, характерными для диабетической невропатии (табл. 1). В исследование включались пациенты при наличии осложнений СД 2 типа, выявленных после специального обследования. Критериями исключения были:
- тяжелая форма СД с выраженными осложнениями;
- прием антиоксидантов в течение последнего месяца до начала исследования;
- невропатия другого генеза;
- наличие тяжелых заболеваний периферических кровеносных сосудов;
- клинически значимые соматические заболевания;
- беременность, кормление грудью;
- отягощенный аллергологический анамнез;
- злоупотребление алкоголем.
С целью сравнительной оценки эффективности разных по длительности курсов лечения препаратом Берлитион® больные были разделены на две группы. Курс лечения начинали с внутривенного капельного введения 600 мг препарата на 250 мл физиологического раствора в течение десяти дней, после этого первая группа принимала препарат Берлитион® в таблетках по 600 мг/сут в течение одного месяца, вторая группа – на протяжении трех месяцев.
Было запланировано четыре визита: первый визит – скрининг, второй визит – через 40 дней (конец курса лечения первой группы), третий визит – через 100 дней (конец курса лечения второй группы), четвертый визит – через три месяца после окончания лечения каждой из групп.
Методы
Неврологический осмотр больных включал:
- исследование сенсорной чувствительности (оценка разных видов чувствительности: болевой, тактильной, вибрационной). При диабетической невропатии часто выявляются локализованные в дистальных отделах нижних и верхних конечностей парестезии, расстройства чувствительности в виде онемения, стягивания, чувства ползания мурашек, болезненного жжения по типу покалывания, зуда;
- исследование глубокой чувствительности;
- исследование сухожильных рефлексов;
- определение мышечной силы.
Для оценки имеющихся невропатических симптомов (стреляющей боли, парестезий, жжения и онемения в области стоп или голеней) использовалась шкала оценки общих симптомов (Total Symptom Score – TSS). Оценка по TSS варьируется от 0 (отсутствие симптомов) до 14,64 балла (максимальное количество).
Для количественной оценки неврологического дефицита использовали шкалу оценки симптомов невропатии нижних конечностей (Neuropathy Impairment Score of Lower Limbs – NIS-LL), которая позволяет объективно оценить степень тяжести поражения нервных волокон. Мышечная сила определялась при сгибании/разгибании бедра, колена, голеностопа (тыльное/подошвенное) и пальцев стопы. В норме коэффициент мышечной силы равен 0, при снижении на 25% – 1, на 50% – 2, на 75% – 3, при параличе – 4. Шкала NIS-LL также подразумевает оценку степени снижения коленного и ахиллова рефлексов (с двух сторон), а также болевой, вибрационной и тактильной чувствительности: ощущение прикосновения и укола иглой (Нейропен), вибрации (при помощи 64 Гц камертона Риделя – Зайфферта (от 0 до 8 баллов)), позиционное чувство для тыльной поверхности концевой фаланги большого пальца обеих стоп. В норме коэффициент рефлексов и чувствительности равен 0, при их снижении – 1, отсутствии – 2. У пациентов 50–69 лет сниженные ахилловы рефлексы считаются нормой.
Для измерения порога вибрационной чувствительности (Vibration Perception Threshold – VPT) биотензиометр накладывали на пять точек в области обеих стоп: медиальную лодыжку (malleolus medialis), медиальную головку первой плюсневой кости (caput metatarsalis medialis primi), подушечку большого пальца стопы (hallux pulpae), латеральную головку пятой плюсневой кости (caput metatarsalis lateralis quinti) и бугристость пятой плюсневой кости (tuberositas ossis metatarsalis quinti). Рассчитывали среднее значение для пяти точек на одной стопе. Калибровку, текущее обслуживание и подобные процедуры проводили в соответствии с инструкцией по эксплуатации прибора. Для включения пациента в исследование порог вибрационной чувствительности на каждой стопе должен был составлять ≤ 30В. Значение порога вибрационной чувствительности > 25В хотя бы на одной стопе связано с высоким совокупным риском развития невропатических язв, показатель 16–24В указывает на промежуточный риск и значение < 15В – на низкий риск [9, 10].
Электромиографическое исследование проводилось до и после лечения. Оценивались следующие показатели: скорость проведения возбуждения, амплитуда М-ответа и латенция при стимуляции nervus peroneus, амплитуда потенциала действия и скорость распространения возбуждения при антидромной стимуляции nervus suralis.
Результаты и их обсуждение
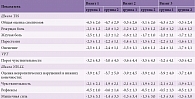
Динамика клинических симптомов представлена в табл. 2. Среднее количество баллов по шкале TSS в группах исходно не различалось. Анализ динамики каждого симптома (боль, жжение, онемение, парестезии) по отдельности свидетельствовал об уменьшении их выраженности в обеих группах уже на десятый день, к концу курса введения препарата Берлитион® в суточной дозе 600 мг внутривенно капельно. В обеих группах к концу исследования наблюдалась положительная динамика. Достоверных различий между группами получено не было. Обследование больных через три месяца после окончания курса лечения показало, что во второй группе после длительного курса лечения сохранялась более стойкая положительная динамика по сравнению с первой группой.
Необходимо отметить хорошую переносимость препарата Берлитион®, побочные эффекты не наблюдались. Уменьшение баллов по шкале NIS-LL происходило в большей степени за счет оживления или появления рефлексов и в меньшей – из-за улучшения состояния чувствительности различных модальностей. Важную роль сыграло улучшение одного из показателей электромиографии – дистальной латенции. Полученные данные свидетельствуют о том, что основные неприятные ощущения, беспокоящие пациентов с диабетической невропатией и снижающие качество жизни, – боль, жжение, онемение, парестезии уменьшались при лечении препаратом Берлитион® благодаря его активизирущему действию на функции периферических нервов.
Выводы
Анализируя результаты проведенного исследования, можно сделать вывод, что препарат Берлитион® способствует уменьшению выраженности позитивной невропатической симптоматики, улучшает порог вибрационной чувствительности и сенсорную функцию у пациентов с СД 2 типа и диабетической невропатией. Препарат можно вводить внутривенно в течение десяти дней в суточной дозе 600 мг с последующим приемом перорально по 300 мг два раза в день (суточная доза 600 мг) в течение не менее 30 дней. При более длительном курсе лечения достигнутый эффект имеет более стойкий характер. К важным преимуществам АЛК относится хороший профиль безопасности. В этой связи прием препарата может быть рекомендован пациентам с диабетической невропатией на фоне СД 2 типа с лечебной целью, а больным СД 2 типа без осложнений с профилактической целью сроком на три – шесть месяцев. Благодаря механизму действия и широкому спектру фармакологического эффекта Берлитион® оказывает влияние на основные звенья патогенеза осложнений СД. Ввиду эффективности и безопасности препарат Берлитион® может быть рекомендован больным СД 2 типа и диабетической невропатией с лечебной и профилактической целью.
M.N. Dadasheva, B.V. Agafonov
Moscow Regional Research and Clinical Institute named after M.F. Vladimirsky
Contact person: Marina Nikolayevna Dadasheva, donveles777@inbox.ru
A great interest to type 2 diabetes and its complications paid by medical doctors of various specialties is caused by extreme prevalence of this disorder. In last years, multiple clinical studies dedicated to this issue were conducted both in Russia and abroad. By affecting mainly people of working age, type 2 diabetes and its complications result in significant labor losses, and frequent disability and sudden death. Current diagnostics and application of pathogenetic therapy allow increasing treatment efficacy. Here, the data of personal study with comparative assessment of therapy of diabetic neuropathy by using alpha-lipoic acid (Berlition) of various durations are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.