Эффективность альфа-липоевой (тиоктовой) кислоты при диабетической полинейропатии
- Аннотация
- Статья
- Ссылки
- English

В связи с широкой распространенностью метаболического синдрома Всемирная организация здравоохранения признала его актуальной медико-социальной проблемой. Практически треть населения мира подвергается высокому риску развития патологии сосудов мозга, сердечно-сосудистой патологии, сахарного диабета (СД), которые являются причиной не только инвалидизации, но и смертности [1, 2].
По данным исследований KIHD, ARIC, IRAS, MCDC и SAHS, риск развития артериальной гипертензии, ишемической болезни сердца, острого нарушения мозгового кровообращения, сахарного диабета, хронической ишемии головного мозга у лиц с метаболическим синдромом в два – четыре раза выше, нежели в популяции [1, 2].
Наиболее тяжелым среди метаболических заболеваний является СД. При этом на СД 2 типа приходится большая часть пациентов. В настоящее время их число превышает 4 млн.
СД снижает качество жизни пациентов, их адаптационные возможности, трудоспособность.
При СД нарушается функционирование всех органов и систем, как следствие, усугубляются течение и прогноз соматических заболеваний. Поражение внутренних органов, обострение хронических заболеваний могут привести к декомпенсации СД и прогрессированию его осложнений, среди которых наиболее значимыми считаются нейропатии. Самой распространенной из них является дистальная симметричная соматосенсорная полинейропатия (ДПН). Статистика показывает, что ДПН встречается у 10% больных СД. Однако некоторые ученые считают, что эта цифра занижена и сейчас приближается к 50%. А при длительности СД более 25 лет показатели могут оказаться даже выше, поскольку существует доклиническая (бессимптомная) стадия ДПН, при которой поражение соматических и автономных нервов выявляется только при обследовании больного с помощью электромиографии и других подобных методов [1, 2, 3].
Клинические проявления ДПН принято подразделять на позитивные и негативные. К позитивной симптоматике относят парестезии, расстройство чувствительности, характеризующееся ощущением онемения, стягивания, ползания мурашек, возможны также жжение как при покалывании иголками, зуд, и локализованное преимущественно в дистальных отделах нижних конечностей. При тяжелой форме ДПН поражаются и верхние конечности. К негативной – неврологический дефицит: снижение поверхностной и глубокой чувствительности, снижение или выпадение сухожильных рефлексов, вначале, как правило, ахиллова, в дальнейшем возможно появление пареза, слабости в дистальных отделах конечностей.
Позитивная и негативная симптоматика количественно тестируется с помощью различных шкал, что при динамическом наблюдении помогает оценить степень поражения и эффективность лечения [4, 5].
Патогенез ДПН не до конца изучен. Считается, что существует определенный гипергликемический порог развития заболевания, а длительность и выраженность декомпенсации СД коррелируют с его тяжестью.
Несмотря на различие теорий патогенеза ДПН, ученые сходятся в одном – ведущая роль принадлежит оксидативному стрессу, который приводит к избыточному образованию свободных радикалов. А при СД антиоксидантная система организма не способна противостоять их повреждающему эффекту.
Оксидативный стресс, блокада гексозоаминового пути утилизации глюкозы с накоплением промежуточных продуктов обмена глюкозы запускает активацию протеинкиназы С и выработку большого числа конечных продуктов избыточного гликирования белков. Причиной блокады обмена глюкозы является активация регенеративных полимераз в ответ на разрушение митохондриальной ДНК одним из наиболее активных свободных радикалов – супероксидом. В результате изменяется эндотелий сосудистой стенки и ухудшаются реологические свойства крови, нарушаются эндотелийзависимые реакции и функции структур нервных клеток, поражаются волокна периферических нервов. Этим объясняется эффективность при ДПН антиоксидантов, мощнейшим из которых является альфа-липоевая (тиоктовая) кислота (АЛК).
АЛК – рацемическая смесь R(+)- и S(-)-изомеров, плохо растворяющихся в воде и хорошо – в липофильных растворителях, что позволяет ей проникать в цитоплазму клеток через билипидный слой мембран. В организме она находится в виде липоата и дигидролипоата, которые участвуют в восстановительном цикле липоевой кислоты.
Липоевая кислота является физиологическим антиоксидантом, связывающим свободные радикалы, участвует в митохондриальном обмене веществ клетки и выполняет функцию кофактора в комплексе превращения веществ, обладающих выраженным антитоксическим действием. Они защищают клетку от реактивных радикалов, образующихся при промежуточном обмене веществ или при распаде экзогенных чужеродных веществ. АЛК нормализует энергетический, углеводный и липидный обмен, характеризуется синергизмом в отношении инсулина. АЛК оказывает цитопротективное, нейротропное, гепатопротективное и детоксикационное действие. Этот эндогенный антиоксидант образуется при окислительном декарбоксилировании альфа-кетокислот и пировиноградной кислоты. По характеру биохимического действия близок к витаминам группы В.
АЛК обладает высокой переносимостью и практически не вызывает побочных эффектов. Ее способность действовать в качестве ловушки свободных радикалов подтверждена в исследованиях на животных и клинических исследованиях.
Препарат выпускается в форме таблеток, покрытых оболочкой, и раствора для инфузий. Оптимальным режимом лечения считается внутривенное капельное введение в дозе 600 мг на 250 мл физиологического раствора (всего 10 капельниц) с переходом на пероральный прием по 600 мг/сут или в течение одного – шести месяцев [6–8].
Нами было проведено открытое сравнительное исследование эффективности двух курсов применения АЛК у больных СД 2 типа с хронической ДПН.
Материал и методы
В исследование было включено 30 пациентов. Критерии включения: симметричная сенсомоторная периферическая полинейропатия на фоне СД 2 типа не ниже 2-й стадии, выраженность симптомов по шкале TSS (total symptom score – шкала общей оценки симптомов) ≥ 7,5 баллов, VPT (vibration perception threshold – порог вибрационной чувствительности) на каждой стопе ≤ 30 В, возраст от 18 до 80 лет, уровень гликированного гемоглобина (НbА1с) < 10%.
Критерии исключения: тяжелая форма СД с выраженными осложнениями, прием антиоксидантов за месяц до начала исследования, нейропатия другого генеза, в анамнезе тяжелые заболевания периферических кровеносных сосудов, пролиферативная ретинопатия, клинически значимые заболевания сердца, легких, органов желудочно-кишечного тракта, язвенные поражения стоп, отягощенный аллергологический анамнез, беременность, период лактации, злоупотребление алкоголем.
Пациенты были рандомизированы на две группы, сопоставимые по полу и возрасту. Первая 10 дней получала АЛК внутривенно капельно в дозе 600 мг на 250 мл физиологического раствора (длительность процедуры – 40 минут), затем один месяц перорально в дозе 600 мг/сут за 30 минут до еды. Вторая – в течение 40 дней перорально в той же дозе и режиме.
В ходе исследования предполагалось три визита: первый – в первый день терапии, второй – через 10 дней терапии, третий – в последний день терапии. Симптомы ДПН оценивались по шкалам TSS и NIS-LL (neuropathy impairment score – lower limbs – шкала поражения нейропатией нижних конечностей). Электромиографическое исследование проводилось до и после лечения. Изучались следующие показатели: скорость проведения возбуждения, амплитуда М-ответа и латенция при стимуляции nervus peroneus, амплитуда потенциала действия и скорость проведения возбуждения при антидромной стимуляции n. suralis.
Результаты и их обсуждение
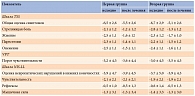
Данные участников представлены в табл. 1. Для оценки имеющихся симптомов (стреляющей боли, парестезий, жжения и онемения в области стоп или голеней) использовали шкалу TSS (максимальное количество баллов – 14,64). Для оценки неврологического дефицита – шкалу NIS-LL. Сила мышц определялась при сгибании/разгибании бедра, колена, голеностопа (тыльное/подошвенное) и пальцев стопы. В норме коэффициент мышечной силы равен 0, при снижении на 25% – 1, на 50% – 2, на 75% – 3, при параличе – 4. По шкале NIS-LL также оценивалась степень снижения коленного и ахиллова рефлексов (с двух сторон) и болевой, вибрационной и тактильной чувствительности (ощущение прикосновения и укола иглой (Нейропен), вибрации (при помощи 64 Гц камертона Риделя – Зайфферта (от 0 до 8 баллов)), а также позиционное чувство для большого пальца обеих стоп.
В норме коэффициент рефлексов и чувствительности равен 0, при их снижении – 1, отсутствии – 2. У пациентов 50–69 лет сниженные ахилловы рефлексы считаются нормой.
Чувствительность определялась на тыльной поверхности концевой фаланги большого пальца стопы с обеих сторон.
Для измерения VPT биотензиометр накладывали на пять точек стоп: медиальную лодыжку (malleolus medialis), медиальную головку первой плюсневой кости (caput metatarsalis medialis primi), подушечку большого пальца стопы (hallux pulpae), латеральную головку пятой плюсневой кости (caput metatarsalis lateralis quinti) и бугристость пятой плюсневой кости (tuberositas ossis metatarsalis quinti). Далее рассчитывали среднее значение для пяти точек на одной стопе. Калибровку, текущее обслуживание и подобные процедуры проводили в соответствии с инструкцией по эксплуатации прибора. VPT > 25 В (хотя бы на одной стопе) связан с высоким совокупным риском развития нейропатических язв, 16–24 В указывает на промежуточный риск и < 15 В – на низкий [9, 10].
Динамика клинических симптомов представлена в табл. 2. Достоверных различий между группами по общей оценке симптомов не было. Анализ динамики каждого симптома в отдельности свидетельствовал об уменьшении их выраженности в обеих группах. Однако если в первой группе значимое снижение произошло уже на 10-й день терапии, то во второй оно происходило постепенно. К концу исследования достоверных различий между группами не отмечено.
Побочные эффекты терапии не отмечались ни при внутривенном, ни при пероральном применении АЛК.
Уменьшение баллов по шкале NIS-LL происходило в основном за счет оживления или появления рефлексов и в меньшей степени за счет улучшения чувствительности различных модальностей. Важную роль сыграло также улучшение дистальной латенции.
Полученные данные свидетельствуют, что основные ощущения (боль, жжение, онемение, парестезии) снижались благодаря улучшению функции периферических нервов. При внутривенном введении АЛК быстрее снижается выраженность нейропатической и неврологической симптоматики.
Выводы
Результаты проведенного исследования показали, что применение АЛК при ДПН на фоне СД 2 типа способствует уменьшению выраженности позитивной нейропатической симптоматики, улучшает порог вибрационной чувствительности и сенсорную функцию. При этом оба режима применения препарата имеют одинаковую эффективность. АЛК обладает хорошим профилем безопасности. Следовательно, она может быть рекомендована больным СД 2 типа как с лечебной, так и профилактической целью.
Efficacy of Alpha-Lipoic (Thioctic) Acid during Diabetic Polyneuropathy
M.N. Dadasheva1, N.Yu. Taranenko2, B.V. Agafonov1
1 M.F. Vladimirskiy Moscow Regional Research Clinical Institute
2 A.I. Evdokimov Moscow State Institute of Medicine and Dentistry
Contact person: Marina Nikolayevna Dadasheva, donveles777@inbox.ru
Metabolic syndrome holds an important place in pattern of morbidity and mortality. Diabetes mellitus, especially type 2 diabetes mellitus, is considered as the most severe pathology among metabolic diseases. However, its complications are dangerous as well. Here we discuss one of the common complications related to diabetes mellitus such as distal symmetric somatosensory polyneuropathy (DPN). The results on efficacy of alpha-lipoic acid applied at different regimens in patients with type 2 diabetes mellitus with DPN are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.