Ингибиторы интерлейкина 6 в терапии ревматоидного артрита
- Аннотация
- Статья
- Ссылки
- English

Ревматоидный артрит (РА) представляет собой хроническое иммуновоспалительное заболевание, основным проявлением которого является деструктивный (эрозивный) артрит. Без активного лечения патология приводит к тяжелой инвалидизации и возможной преждевременной смерти вследствие осложнений или прогрессирующего развития коморбидных состояний.
Современные подходы к терапии РА связаны с представлением о ключевых сигнальных путях иммунной системы, активация которых приводит к хроническому воспалению в суставах и других органах. Системное воспаление при РА в значительной степени определяется гиперпродукцией провоспалительных цитокинов, таких как интерлейкин 6 (ИЛ-6) и фактор некроза опухоли α (ФНО-α), для которых характерна плейотропность (множественность точек приложения) воздействия на организм. Именно поэтому даже очень специфическое воздействие с помощью генно-инженерных биологических препаратов (ГИБП), представляющих собой моноклональные антитела, растворимые рецепторы или другие биомолекулы, на конкретные молекулы-мишени оказывается комплексным.
Интерлейкин 6 представляет собой плейотропный цитокин с широким спектром биологической активности в отношении иммунной регуляции, воспаления, кроветворения и онкогенеза [1, 2]. Данный цитокин был открыт в 1986 г. японскими исследователями [3]. К настоящему времени достигнут значительный прогресс в понимании системы рецепторов ИЛ-6, механизма передачи сигналов и его биологической активности.
Известно, что ИЛ-6 реализует свое действие через два компонента своего рецептора: лиганд-связывающую цепь массой 80 кДа и не связывающий лиганд гликопротеин 130 (gp130) [4], которые в ряде случаев функционально могут рассматриваться как единый рецептор (ИЛ-6Р). Это позволило создать семейство ингибиторов рецепторов ИЛ-6 (тоцилизумаб, сарилумаб, левилимаб).
Стимуляция ИЛ-6Р индуцирует фосфорилирование тирозина и активацию JAK-STAT-сигнального пути, который димеризуется и перемещается в ядро, чтобы инициировать транскрипцию специфических генов [5].
Таким образом, ИЛ-6 при РА выступает как фрагмент сигнального пути «ИЛ-6 → ИЛ-6Р → JAK-STAT», принципиально отличающегося от другого активирующегося при РА сигнального пути «ФНО-α → NF-κB». В связи с этим блокада биологических эффектов ИЛ-6 путем связывания самого ИЛ-6 или ИЛ-6Р оказывается эффективной в тех случаях, когда не работают ингибиторы ФНО-α.
Интерлейкин 6 воздействует на иммунные клетки, такие как В- и Т-лимфоциты, на гепатоциты, кроветворные клетки, сосудистые эндотелиальные клетки и многие другие [6]. Он играет важную роль в осуществлении иммунных реакций, кроветворения и воспаления [7], регулирует такие процессы, как пролиферация, дифференцировка, выживаемость и апоптоз клеток. ИЛ-6 активирует высвобождение белков острой фазы воспаления в гепатоцитах, включая С-реактивный белок (СРБ) и сывороточный амилоид А [8].
При РА наблюдается гиперпродукция ИЛ-6 [9], при этом его сывороточные уровни коррелируют с комбинированными показателями активности болезни [10]. Повышение активности ИЛ-6 приводит к системным воспалительным реакциям, а также к активации остеокластов и развитию деструкции костной ткани [11].
В связи с комплексным влиянием на патогенез РА рассматриваемый цитокин представляет собой хорошую терапевтическую мишень.
Несмотря на то что группа ингибиторов биологических эффектов ИЛ-6, включающая как ингибиторы ИЛ-6, так и ингибиторы ИЛ-6Р, появилась в арсенале ревматологов значительно позже ингибиторов ФНО-α, в настоящее время она занимает значительное место в терапии РА и является активно развивающейся группой ГИБП [8].
Исторически первыми были внедрены ингибиторы ИЛ-6Р (тоцилизумаб, сарилумаб) [7, 8]. Именно на этих препаратах были изучены особенности действия ингибиторов ИЛ-6Р при РА, в частности отсутствие прямой зависимости от комбинации с метотрексатом (МТ) и возможность эффективного применения в монотерапии, что отражено в международных клинических рекомендациях [12].
Предпочтение использовать в качестве мишени рецепторы ИЛ-6Р, а не ИЛ-6 в определенной степени объясняется тем, что концентрации рецепторов имеют меньшую вариабельность, чем концентрации ИЛ-6, которые могут различаться в десятки раз у разных пациентов в зависимости от активности болезни, и это может упростить выбор доз и схемы лечения [13, 14]. Кроме того, сложная структура рецептора, включающая как сам ИЛ-6Р, так и gp130, которая формирует гексамерный комплекс, наличие растворимых и связанных с мембраной клеток рецепторов ассоциированы с разными вариантами передачи сигнала от ИЛ-6 – классический и транс-сигнальный пути, а также транс-презентация [2, 13, 15]. Гликопротеин 130 участвует в передаче сигнала не только от ИЛ-6, но и от других цитокинов, например ИЛ-27, участвующего в ряде противовоспалительных реакций [16]. Поэтому потенциально последствия блокады ИЛ-6Р могут быть менее предсказуемыми.
Использование в качестве молекулярной мишени ИЛ-6 потенциально может оказывать весьма специфичное и в то же время комплексное воздействие на связанный с ним сигнальный путь активации иммунной системы. Так, антагонисты ИЛ-6Р (тоцилизумаб, сарилумаб) предотвращают связывание ИЛ-6 с рецептором, что приводит к блокаде как классического пути, так и транс-сигнального, но не транс-презентации. Антитело против ИЛ-6 олокизумаб, наоборот, связывается с сайтом IIIa ИЛ-6 и препятствует полноценному функционированию рецепторного комплекса, блокируя взаимодействие с gp130 [17].
Олокизумаб1 (ОКЗ) представляет собой гуманизированное моноклональное антитело к иммуноглобулину G4κ. Он имеет очень высокое сродство с ИЛ-6, которое обусловлено уровнем связи между двумя биомолекулами [18].
Присутствие ОКЗ индуцирует конформационные изменения ИЛ-6. Кристаллографический анализ выявил заметное различие в отношении естественной сборки комплекса «ИЛ-6Р – ИЛ-6 – gp130» под воздействием ОКЗ. В данном случае происходит изменение конформации молекулы, набор из нескольких аминокислот из GLU42-ASN47 оказывается организованным в небольшую спираль (спираль F). Эта небольшая спираль закупоривает карман, связывающий рецептор gp130, что обеспечивает высокую ингибирующую активность [19].
Теоретические выкладки, несомненно, требуют подтверждения на практике. Дискуссии о возможных различиях между ингибиторами ИЛ-6 и ИЛ-6Р активно ведутся в литературе [20].
До настоящего времени только один ингибитор ИЛ-6 (ОКЗ) зарегистрирован по показанию «ревматоидный артрит».
Сравнительные данные клинических исследований ОКЗ и тоцилизумаба при РА свидетельствуют об отсутствии различий в безопасности или эффективности между блокированием рецептора и лиганда [13].
Олокизумаб прошел достаточно длинный путь клинических исследований. Результаты исследования фазы I продемонстрировали хороший профиль безопасности в отсутствие серьезных нежелательных реакций у добровольцев [21]. Результаты исследований фазы II подтвердили профиль безопасности препарата у больных РА и эффективность в нескольких дозах [22, 23]. Это позволило выбрать оптимальную дозу олокизумаба для проведения исследований фазы III. Клинические исследования фазы III представляют серию испытаний CREDO (таблица) [24–26]. Всего в них приняли участие 2444 пациента с РА.
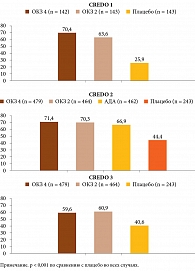
Все три исследования CREDO достигли своих первичных конечных точек – статистически значимого превосходства над плацебо по ACR 20, то есть 20%-ного улучшения по пяти ключевым критериям из семи. В исследовании с активным контролем (адалимумаб (АДА)) была продемонстрирована не меньшая эффективность ОКЗ (рис. 1).
В рандомизированном клиническом исследовании CREDO 1 оценивались эффективность и безопасность ОКЗ у пациентов с активным ревматоидным артритом, несмотря на лечение МТ [24]. В этом 24-недельном многоцентровом плацебо-контролируемом двойном слепом исследовании пациенты были рандомизированы в соотношении 1:1:1 для подкожного введения ОКЗ в дозе 64 мг один раз каждые две недели (ОКЗ 2), или ОКЗ в дозе 64 мг один раз каждые четыре недели (ОКЗ 4), или плацебо в дополнение к МТ. Первичной конечной точкой эффективности была доля достигших ответа по ACR 20 на 12-й неделе. Вторичные конечные точки эффективности включали процент достигших активности заболевания по DAS 28 – СРБ менее 3,2 балла (низкая активность), улучшение физических способностей по сравнению с исходным уровнем к 12-й неделе, измеренное с помощью HAQ-DI, ответ по ACR 50 и процент достигших активности заболевания по CDAI 2,8 балла и менее (ремиссия) на 24-й неделе. Безопасность и иммуногенность оценивали на протяжении всего периода исследования.
Всего было рандомизировано 428 пациентов. Критерии включения больных в исследования – наличие шести и более припухших и болезненных суставов, а также уровень СРБ ≥ 6 мг/л. Ответ на терапию по ACR 20 был более частым при введении ОКЗ каждые две и четыре недели, чем при применении плацебо, – 63,6 и 70,4 против 25,9% (p < 0,0001 для обоих сравнений). Вторичная конечная точка – низкая активность заболевания по DAS 28 – СРБ менее 3,2 балла на 12-й неделе была отмечена у 33,6 и 38,7% получавших ОКЗ каждые две и четыре недели соответственно, что достоверно выше, чем в группе плацебо – 3,5% (р < 0,0001 в обоих случаях). Частота развития серьезных нежелательных реакций была выше в группах ОКЗ по сравнению с группой плацебо – 5,6, 5,6 и 2,8% соответственно. Ни у одного больного не вырабатывались нейтрализующие антилекарственные антитела.
CREDO 2 – крупное рандомизированное клиническое исследование, в котором приняли участие 1648 больных РА, недостаточно ответивших на МТ, из медицинских центров в США, странах Европейского союза, Латинской Америки, Великобритании и России [25]. Длительность исследования составила 24 недели. Его особенностью было наличие группы активного сравнения, получавшей АДА. Рандомизация проведена на группу ОКЗ 2, группу ОКЗ 4, группу АДА в дозе 40 мг каждые две недели и группу плацебо. В результате ответа по ACR 20 достигли 70,3, 71,4, 66,9 и 44,4% пациентов соответственно (p < 0,001 по сравнению с плацебо). Частота развития серьезных нежелательных реакций в группах ОКЗ, АДА и плацебо была сопоставимой – 4,8, 4,2, 5,6 и 4,9% соответственно.
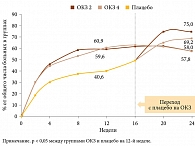
В двойное слепое рандомизированное клиническое исследование CREDO 3 были включены пациенты с РА, имевшие опыт применения ингибиторов ФНО-α и недостаточно ответившие на них – сохранялась умеренная или высокая активность заболевания [26]. Пациенты были рандомизированы в соотношении 2:2:1 для получения подкожных инъекций ОКЗ в дозе 64 мг каждые две недели, ОКЗ в дозе 64 мг каждые четыре недели или плацебо плюс МТ. На 16-й неделе пациенты группы плацебо были рандомизированы в соотношении 1:1 для получения любой из схем ОКЗ. После 24-й недели больные могли продолжить участие в открытом исследовании продленной фазы или войти в группу наблюдения безопасности терапии еще на 20 недель.
Всего были рандомизированы 368 пациентов, из которых 320 (87%) завершили 24-недельный период лечения.
Обе схемы терапии ОКЗ статистически значимо были лучше, чем плацебо, в достижении первичной конечной точки – ответа по ACR 20 к 12-й неделе. После перевода с плацебо на ОКЗ наблюдалась быстрая положительная динамика. Больные достигали таких же результатов, что и получавшие ОКЗ с начала исследования (рис. 2).
Общая частота нежелательных явлений, возникших на фоне лечения (TEAE), в группах ОКЗ 2 и 4 и группе плацебо составила 65,5, 65,0 и 50,7% соответственно. Последующая рандомизация пациентов группы плацебо в группу ОКЗ на 16-й неделе существенно не изменила частоту возникновения TEAE – 64,3% в любой группе ОКЗ каждые две недели и 59,7% в любой группе ОКЗ каждые четыре недели. Большинство TEAE во всех группах были легкой или средней степени тяжести.
Частота возникновения серьезных нежелательных явлений во время лечения составила 12 (7,0%) у получавших ОКЗ каждые две недели, 6 (3,2%) у получавших ОКЗ каждые четыре недели. Частота серьезных инфекций составила 1,1% в группе ОКЗ 4, 1,2% в группе ОКЗ 2. Серьезных оппортунистических инфекций, включая активный туберкулез, серьезных неблагоприятных сердечно-сосудистых событий, перфораций желудочно-кишечного тракта или летальных исходов не зарегистрировано.
В других исследованиях ОКЗ были получены аналогичные результаты, хотя могли использоваться разные дозы препарата.
В рандомизированном клиническом исследовании фазы IIb, проведенном M.C. Genovese и соавт. [22], у больных РА с неудачей лечения ингибиторами ФНО-α сравнивали несколько режимов дозирования ОКЗ, плацебо и внутривенное введение тоцилизумаба в дозе 8 мг/кг. В результате у 221 рандомизированного пациента лечение ОКЗ привело к значительно большему снижению активности заболевания по DAS 28 – СРБ на 12-й неделе по сравнению с исходным уровнем и по сравнению с плацебо (p < 0,001). Эффективность ОКЗ в разных дозах не отличалась от эффективности тоцилизумаба по множеству конечных точек. Большинство нежелательных явлений были легкими или умеренными и сопоставимыми между группами.
Применение ОКЗ было изучено T. Takeuchi и соавт. у большой группы азиатских пациентов с РА [23]. В исследование также включали больных, недостаточно ответивших или плохо переносивших ингибиторы ФНО-α. Участники исследования получали ОКЗ в разных дозах или плацебо в дополнение к ранее назначенному МТ. Всего было рандомизировано 119 человек. У получавших разные дозы ОКЗ к 12-й неделе наблюдалось значительно большее снижение активности процесса по DAS 28 – СРБ по сравнению с группой плацебо – на 2,18–2,68 и 0,64 балла соответственно (p < 0,001). Серьезные нежелательные реакции в группах ОКЗ наблюдались реже, чем в группе плацебо, – 3,1–3,8 против 6,9%.
Таким образом, в серии рандомизированных клинических исследований фаз II и III ОКЗ продемонстрировал достаточно высокую эффективность у больных РА, не ответивших на терапию МТ и ингибиторами ФНО-α. Было также показано, что ОКЗ не уступает по эффективности таким ГИБП, как адалимумаб и тоцилизумаб. Безопасность терапии ОКЗ находится на достаточно высоком уровне.
В целом ингибирование ИЛ-6 представляет весьма перспективное направление фармакотерапии РА и ряда других заболеваний, поэтому сейчас разрабатываются все новые препараты этой группы, такие как силтуксимаб, разрешенный к применению при болезни Кастлемана [27], сирукумаб, однако этому препарату отказано в регистрации в США при псориатическом артрите из-за проблем с безопасностью [28], клазакизумаб [29], HZ-0408b [14]. Это свидетельствует о том, что ингибиторы ИЛ-6 являются одной из наиболее активно развивающихся групп иммуносупрессивных препаратов [30, 31].
Олокизумаб, первый ингибитор непосредственно ИЛ-6, вошел в клиническую практику лечения РА и занимает все большее место в арсенале ревматологов.
D.E. Karateev, MD, PhD, Prof., E.L. Luchikhina, PhD
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Inhibition of the biological effects of interleukin-6 (IL-6) is one of the most promising ways of depleting immune inflammation in rheumatoid arthritis (RA) and other immunoinflammatory diseases. IL-6 is a pleiotropic cytokine with a wide spectrum of biological activity in relation to immune regulation, inflammation, hematopoiesis and oncogenesis, it regulates such processes as proliferation, differentiation, survival and apoptosis of cells, activates the release of acute phase proteins. IL-6 in RA acts as a part of the “IL-6 → IL-6R → JAK-STAT” signaling pathway, which is fundamentally different from another signaling pathway “TNF-α → NF-κB” activated in RA. The blockade of the biological effects of IL-6 especially advantageous in cases when TNF-α inhibitors do not work. Suppression of the biological effects of IL-6 can be carried out by a direct binding of the cytokine itself or binding of its receptor (IL-6R). Inhibition of IL-6R is more frequent (tocilizumab and other drugs). However, the complicated structure of receptor, including both IL-6R itself and gp130 glycoprotein, which forms a hexameric complex, and various variants of signal transmission from IL-6 (classical, trans-signaling, trans-presentation) makes the consequences of blockade not of IL-6R, but of the cytokine itself, potentially more predictable. In clinical practice IL-6 inhibitors represented only by the humanized monoclonal antibody to IL-6 olokizumab (OCZ). In a series of phase III CREDO studies, OCZ demonstrated high efficacy and sufficient safety in RA patients with inadequate response to methotrexate and TNF-α inhibitors. It has been shown that OCZ is at least as effective as such biologics as adalimumab and tocilizumab.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.