Пациент с гипотиреозом: возможности заместительной терапии
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются факторы, влияющие на всасываемость, безопасность препаратов, метаболизм тиреоидных гормонов и возможности улучшения эффективности заместительной гормональной терапии. Обсуждается тактика выбора начальной дозы левотироксина при первичном гипотиреозе.
В статье рассматриваются факторы, влияющие на всасываемость, безопасность препаратов, метаболизм тиреоидных гормонов и возможности улучшения эффективности заместительной гормональной терапии. Обсуждается тактика выбора начальной дозы левотироксина при первичном гипотиреозе.

Введение
Гипотиреоз – клинический синдром, обусловленный стойким снижением уровня тиреоидных гормонов.
По данным различных исследований, это одно из часто встречающихся эндокринных заболеваний: распространенность первичного гипотиреоза в популяции составляет от 4,6 до 9,5% [1]. Так, в ходе Колорадского исследования было установлено, что частота гипотиреоза увеличивается с возрастом и варьируется в пределах 4–12% среди женщин и 3–16% среди мужчин. Максимальная частота гипотиреоза была выявлена в возрастной группе старше 70 лет [2].
При всех формах манифестного гипотиреоза показано назначение заместительной терапии препаратами тиреоидных гормонов. Согласно современным подходам, для этого следует использовать левотироксин (L-T4). При субклиническом гипотиреозе решение о начале заместительной терапии принимается в каждом случае индивидуально.
Целями заместительной терапии являются купирование симптомов и клинических проявлений гипотиреоза, нормализация уровня тиреотропного гормона (ТТГ), предупреждение передозировки (ятрогенного тиреотоксикоза), особенно у пациентов пожилого возраста [3].
Несмотря на простоту заместительной терапии L-Тироксином, во многих случаях терапевтический ответ остается неудовлетворительным. Согласно данным исследований, от 32,5 до 62,0% пациентов, получающих заместительную терапию, находятся в состоянии декомпенсации [2, 4–6].
Это объясняется не только низкой комплаентностью пациентов, но и проблемой сочетания препаратов для заместительной терапии с другими лекарственными препаратами. Поэтому предъявляются все новые требования к безопасности, прогнозируемости эффектов и стандартизации L-Тироксина [2, 7].
История заместительной терапии гипотиреоза
История заместительной терапии насчитывает не один десяток лет. Первым препаратом был экстракт щитовидной железы овцы, который G. Murray в 1891 г. применил в виде внутримышечных инъекций, а уже через год – перорально. Последующие усилия ученых были направлены на выделение тиреоидных гормонов. В 1915 г. E. Kendall удалось получить чистый гормон щитовидной железы в кристаллическом виде, в 1926 г. C.R. Harrington осуществил его синтез – синтезировал тироксин [8].
В 1952 г. был открыт второй гормон щитовидной железы – трийодтиронин. Принимая во внимание, что щитовидная железа продуцирует два гормона – тироксин (Т4) и трийодтиронин (Т3), долгое время считали, что для лечения гипотиреоза предпочтительнее использовать комбинацию Т4 и Т3 [9]. Однако в 1970 г. L.E. Braverman, K. Sterling и соавт. открыли периферическое превращение тироксина в трийодтиронин. Впоследствии это послужило основой для использования в клинической практике преимущественно синтетического L-Тироксина [10].
Начиная с 1970-х гг. терапия синтетическим левотироксином постепенно замещала применение экстрактов щитовидной железы животных. Они состояли преимущественно из тиреоглобулина, а также йодтиронинов и йода в различных пропорциях. В России аналогом таких препаратов был тиреоидин. К его недостаткам следует отнести ненадежную стандартизацию, слишком высокое содержание йода, усиленный переход Т4 в Т3 при длительном хранении, возможность образования антител к животному белку. Препарат применялся до 1998 г., до того момента, как Фармакологический комитет РФ рекомендовал исключить его из номенклатуры лекарственных средств.
В настоящее время для терапии гипотиреоза применяют синтетические аналоги тиреоидных гормонов, которые лишены этих недостатков.
Фармакокинетика L-Тироксина
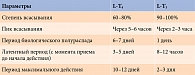
Для успешного лечения гипотиреоза необходимо знание некоторых фармакологических характеристик препарата тиреоидных гормонов (табл. 1).
Препаратом выбора для заместительной терапии гипотиреоза является L-Тироксин, в частности L-Тироксин производства компании «Берлин-Хеми/А. Менарини». Данный препарат представляет собой синтетический тироксин (натриевая соль тироксина), полностью идентичный тироксину, продуцируемому щитовидной железой.
Назначение монотерапии левотироксином позволяет успешно моделировать нормальный обмен тиреоидных гормонов, так как большая часть Т3 образуется на периферии за счет дейодирования Т4. При этом на фоне заместительной терапии левотироксином концентрация Т3 сохраняется постоянной.
Тиреоидные гормоны хорошо всасываются в желудочно-кишечном тракте (более 80%) [10–12]. Однако следует учитывать, что абсорбция может повышаться при голодании и, наоборот, значительно снижаться при смешивании с пищей. Многие продукты питания, особенно пищевые волокна, препятствуют полноценному всасыванию Т4 и Т3. В связи с этим дозу лекарственных средств, содержащих эти гормоны, рекомендуют принимать однократно в одно и то же время (обычно утром) за 30–40 минут до еды и как минимум с интервалом четыре часа до или после приема некоторых лекарственных средств и витаминов. С возрастом абсорбция Т4 и Т3 снижается.
При поступлении в организм основная масса тиреоидных гормонов связывается с белками-переносчиками, образуя гормональное депо. Существуют три основных белка-переносчика тиреоидных гормонов: тироксинсвязывающий глобулин, тироксинсвязывающий преальбумин и альбумин. Около 75% количества Т4 связывается с тироксинсвязывающим глобулином, 15–20% – с тироксинсвязывающим преальбумином и 5% – с альбумином. Т3 главным образом связывается с тироксинсвязывающим глобулином. Поскольку Т3 по сравнению с Т4 обладает меньшим сродством с белками-переносчиками, процент его свободной формы значительно выше – 0,04 и 0,40% соответственно. Поэтому Т3 в отличие от Т4 раньше начинает действовать и меньшее время сохраняется в организме. Несмотря на то что лишь такая малая доля тиреоидных гормонов является свободной, именно она играет физиологическую роль. Необходимо отметить, что только не связанные с белками Т3 и Т4 способны проникать внутрь клетки и взаимодействовать со специфическими рецепторами [13, 14].
Свободные и связанные гормоны находятся в состоянии динамического равновесия. Степень сродства транспортных белков изменяется в зависимости от концентрации свободных Т3 и Т4 в крови.
Как было сказано ранее, в периферических тканях происходит конверсия Т4 в Т3, который активнее в три – пять раз. В связи с этим монотерапия левотироксином (препаратом Т4) способна полностью обеспечить организм необходимым количеством тиреоидных гормонов, на ее фоне концентрация Т3 в плазме крови увеличивается постепенно в течение нескольких недель.
Длительный период полураспада препарата (около семи дней) позволяет принимать его один раз в день, что обеспечивает поддержание стабильного уровня как тироксина, так и трийодтиронина в крови.
При назначении лиотиронина (препарата Т3) в виде монотерапии или в составе комбинированных средств (левотироксин натрия/лиотиронин) происходит резкий подъем уровня Т3 в крови, который нормализуется лишь через два – четыре часа. При таком лечении организм несколько часов в день находится в состоянии медикаментозного тиреотоксикоза, что может привести к развитию осложнений, например со стороны сердечно-сосудистой системы.
После приема тироксина наибольшая его концентрация (10–15% от исходного уровня) определяется через три-четыре часа и сохраняется более шести часов. На фоне заместительной терапии L-Тироксином концентрация Т3 сохраняется постоянной в течение суток. Это представляется важным, поскольку прием препарата L-Т3 сопровождается достижением пикового нефизиологического уровня с последующим довольно быстрым его снижением. Представленные данные послужили причиной преимущественного использования L-Тироксина. Препарат выпускается в дозах 50 и 100 мкг, что облегчает их подбор.
Установлено, что свои биологические эффекты тироксин реализует в организме только тогда, когда он находится в не связанной с транспортными белками форме. Этим свойством во многом определяется возможность введения необходимых терапевтических доз препарата L-Тироксин в организм. При различной скорости всасывания L-Тироксина в желудочно-кишечном тракте формирование оптимальной дозы свободного тироксина будет зависеть от возможностей печени синтезировать транспортные белки-переносчики – тироксинсвязывающий глобулин, тироксинсвязывающий преальбумин и альбумин. Доказано существенное влияние на резорбцию L-Тироксина в желудочно-кишечном тракте вспомогательных веществ, которые могут изменять его фармакодинамику [15–17].
Важно напомнить, что использование вспомогательных веществ в лекарственных препаратах регламентирует Всемирная организация здравоохранения: вспомогательные вещества должны быть биологически безвредными, а также не вызывать аллергических реакций и не оказывать токсического воздействия [18].
Как известно, при производстве лекарственных препаратов используются вспомогательные вещества: многочисленная группа веществ органической и неорганической природы, которые необходимы для придания препарату соответствующей формы и объема. Биологическая роль вспомогательных веществ заключается в том, что они могут оказывать существенное влияние на биодоступность и стабильность действующих веществ и, следовательно, на качественные характеристики препаратов и их эффективность [16, 17]. Например, одним из часто используемых компонентов вспомогательных веществ в лекарственных препаратах, предназначенных для применения у детей и взрослых, является лактоза – олигосахарид, входящий в состав молока практически всех млекопитающих, в том числе человека. Установлено, что у 75% популяции наблюдается гиполактазия разной степени тяжести, причем снижение активности фермента генетически обусловлено и в большой степени определяется этнической принадлежностью. Так, в странах Европы ее частота варьируется от 3 до 40%. Дефицит фермента лактазы, принимающего участие в расщеплении лактозы в тонкой кишке, может быть первичным (наследственным) и вторичным (обусловленным заболеванием тонкой кишки).
Основным клиническим проявлением недостаточности лактазы является бродильная диспепсия: через некоторое время после употребления молочных продуктов отмечается вздутие и урчание в животе, понос и другие малоприятные симптомы. Выраженность клинической симптоматики широко варьируется, так как она обусловлена различным уровнем снижения фермента, различиями биоценоза кишечника, а также объемом поступающей в организм лактозы [19].
Поступление лактозы в организм с таблетированными лекарственными препаратами может быть существенным и способствовать развитию клинических симптомов лактазной недостаточности, особенно у лиц пожилого возраста, страдающих несколькими заболеваниями и получающих многокомпонентную терапию [20]. Тактика лечения и профилактики дефицита лактазы – исключение из питания пациентов молочного сахара. Аналогичные ситуации могут встречаться при использовании других вспомогательных веществ. Поэтому врачи и сами пациенты должны быть осведомлены об их наличии во всех принимаемых лекарственных средствах.
Трудности с выбором лекарственных средств пациентам с гиполактазией обусловлены тем фактом, что содержание вспомогательных веществ, как правило, не указывается в медицинских справочниках и далеко не всегда приводится в инструкциях по медицинскому применению препаратов. В США было проведено исследование, в котором изучалось содержание лактозы в лекарственных препаратах, принимаемых пожилыми пациентами. Показано, что из 122 препаратов 51 (42%) содержал в качестве вспомогательного вещества лактозу, что может повлечь за собой клинически значимые последствия [21].
C целью улучшения переносимости и повышения безопасности своих препаратов многие производители левотироксина стали исключать ряд опасных компонентов из вспомогательных веществ.
Компания «Берлин-Хеми/А. Менарини», производящая наиболее распространенный в Российской Федерации L-Тироксин, c целью совершенствования фармацевтических свойств изменила состав и лекарственную форму линейки препаратов L-Тироксин в дозах 50, 75, 100, 125 и 150 мкг, исключив из состава вспомогательных веществ лактозу. Благодаря этому они стали единственными безлактозными препаратами левотироксина натрия. Это позволило минимизировать риск непереносимости терапии, а также повысить комплаентность пациентов.
Другим очень важным преимуществом безлактозной формы L-Тироксина является более длительное по сравнению с другими формами, содержащими лактозу, сохранение активности действующего вещества. Известно, что стабильность левотироксина натрия легко нарушается в присутствии лактозы. H. Pаtel и соавт. провели исследование с целью сравнить влияние двух наполнителей (двухосновной фосфат кальция и лактоза) на стабильность L-Тироксина в условиях искусственного старения. По результатам исследования были сделаны следующие выводы: у препарата L-Тироксин, в состав которого входит лактоза, активность снижается быстрее (на 30% за шесть месяцев), чем у препаратов, изготовленных с использованием двухосновного фосфата кальция (15% за тот же период), таблетированные формы, изготовленные с использованием лактозы, перестали удовлетворять требованиям USP (United States Pharmacopeia) уже через три месяца хранения при температуре 40 °С и относительной влажности 75% [22, 23].
Таким образом, исключение лактозы из состава препаратов гормонов щитовидной железы представляется крайне важным с учетом того, что заместительную терапию пожизненно получают миллионы пациентов с гипотиреозом.
Современная тактика лечения
Как было отмечено ранее, гипотиреоз является одним из самых распространенных эндокринных заболеваний, а L-T4 – одним из наиболее часто выписываемых препаратов. Так, в Великобритании в 2010 г. было выписано более 23 млн рецептов на L-T4 [24].
При манифестном гипотиреозе показана заместительная терапия левотироксином в средней дозе 1,6–1,8 мкг/кг.
При инициации заместительной терапии L-T4 необходимо учитывать такие факторы, как вес пациента, тощая масса тела, наличие беременности, степень повышения уровня ТТГ, возраст, общее состояние здоровья, включая наличие сердечной патологии. Кроме того, исходя из этих факторов, необходимо выбрать целевой уровень ТТГ.
Так, при гипотиреозе, развившемся вследствие аутоиммунного тиреоидита, заместительная доза будет составлять в среднем 1,6 мкг/кг, в то время как пациентам после тиреоидэктомии или с вторичным гипотиреозом потребуются более высокие дозы L-T4 для достижения компенсации. Пожилым пациентам обычно требуется меньшая доза левотироксина, иногда менее 1 мкг/кг/сут. Следует помнить, что нормальный уровень ТТГ у пожилых пациентов несколько выше, чем у лиц моложе 65 лет, поэтому в качестве целевого могут быть выбраны более высокие значения. У пациентов с избыточной массой тела доза препарата рассчитывается на 1 кг идеальной массы тела [25].
Пациентам моложе 50 лет, не имеющим в анамнезе сердечно-сосудистых заболеваний, сразу можно назначать полную дозу L-Тироксина. Начинать терапию у пациентов старше 50 лет или моложе, но с сердечно-сосудистыми заболеваниями в анамнезе, следует с дозы 25 мкг (0,025 мг) в день, с контролем состояния и уровня ТТГ через шесть – восемь недель. Далее дозу следует осторожно титровать до достижения клинического и биохимического эутиреоидного состояния. После достижения клинического и лабораторного эутиреоза уровень ТТГ можно проверять один раз в 6–12 месяцев [3].
Иногда у пациентов с аритмией не удается достичь эутиреоидного состояния, не ухудшая течение сердечно-сосудистой патологии. В таких случаях бывает достаточным достичь клинически эутиреоидного состояния при сохранении чуть повышенного уровня ТТГ.
Принципы лечения вторичного гипотиреоза аналогичны таковым при первичном, но оценка адекватности заместительной терапии основывается на определении уровня не ТТГ, а Т4.
До настоящего времени нет единого мнения о целесообразности назначения заместительной терапии при субклиническом гипотиреозе (повышение уровня ТТГ до 5–10 мЕд/л при нормальном уровне Т4). Чаще заместительную терапию начинают при ТТГ 10 мЕд/л и выше, L-Тироксин назначают в дозе 1 мкг на 1 кг веса.
У пациентов со стойко сохраняющимся субклиническим гипотиреозом, в отношении которых принято решение не назначать L-T4, функцию щитовидной железы целесообразно оценивать раз в полгода на протяжении первых двух лет, в дальнейшем – ежегодно. Если у пациентов с субклиническим гипотиреозом, которым не назначена терапия L-T4, произошла спонтанная нормализация уровня ТТГ, в отсутствие носительства антител к щитовидной железе или зоба необходимости в дальнейшем обследовании и определении уровня ТТГ нет [26].
При впервые выявленном во время беременности субклиническом или манифестном гипотиреозе следует сразу назначить полную заместительную дозу левотироксина. Беременным с гипотиреозом левотироксин показан в дозе 2,3 мкг/кг. Если гипотиреоз у пациентки был диагностирован до беременности и она уже получает левотироксин, дозу следует увеличить на 30–50% (обычно на 50 мкг/сут). При планировании беременности и субклиническом гипотиреозе исходная необходимая доза L-Тироксина обычно составляет 1 мкг на 1 кг массы тела. Строгое выполнение этих рекомендаций особенно важно в первой половине беременности, когда собственная щитовидная железа плода еще не функционирует. Такое лечение позволяет избежать тяжелых психоневрологических нарушений у ребенка [27].
Проведение адекватной заместительной терапии гипотиреоза L-Тироксином будет способствовать не только улучшению соматического состояния пациентов, но и служить профилактикой многочисленных органных нарушений, возникающих на фоне пониженной функции щитовидной железы.
Целесообразность использования комбинированных препаратов тиреоидных гормонов (левотироксин натрия/лиотиронин) продолжает обсуждаться. Строгих доказательств, что комбинированная терапия имеет преимущества перед монотерапией L-T4, пока не получено. В связи с этим не рекомендуется рутинное назначение комбинированной терапии L-T4 и L-T3 пациентам с первичным гипотиреозом [28].
Достаточных доказательств, чтобы рекомендовать рутинное назначение комбинированной терапии L-T4 и L-T3 пациентам с сохраняющимися симптомами, несмотря на компенсацию гипотиреоза на фоне монотерапии L-T4, также нет. Это связано с тем, что отдаленное соотношение преимуществ и недостатков такого подхода не изучено.
Комбинированная терапия L-T4 и L-T3 может быть рекомендована в качестве экспериментального подхода у комплаентных пациентов, получающих L-T4, при наличии сохраняющихся жалоб, несмотря на нормализацию ТТГ, при исключении других хронических и сопутствующих аутоиммунных заболеваний, которые могут быть их причиной. Такая терапия не может быть рекомендована во время беременности и при сердечной аритмии.
В отсутствие улучшения состояния в течение трех месяцев терапию L-T4 и L-T3 следует отменить.
Комбинированную терапию L-T4 и L-T3 следует начинать исходя из соотношения 13:1 и 20:1. Если L-Т4 назначается один раз в день, то суточную дозу L-Т3 лучше разделить (если возможно) на два приема (один – перед завтраком, второй и больший – на ночь). Оценка адекватности терапии L-T4 и L-T3 должна осуществляться на основании определения уровня ТТГ, св. Т4, св. Т3 и соотношения св. Т4/св. Т3 в крови, взятой до приема препаратов, целью лечения является поддержание этих параметров в норме.
Если необходима коррекция комбинированной терапии L-T4 и L-T3, следует изменить дозу только одного из компонентов, предпочтительно L-Т3.
Влияние лекарственных препаратов на функцию щитовидной железы и заместительную терапию
Многие лекарственные препараты взаимодействуют с тиреоидными гормонами и влияют на функцию щитовидной железы [19, 20]. Однако в клинической практике значимы лишь некоторые взаимодействия, обусловливающие изменение дозы тиреоидных гормонов либо влияющие на интерпретацию результатов диагностических исследований (табл. 2).
При назначении пациенту с гипотиреозом заместительной терапии препаратами гормонов щитовидной железы обязательно нужно выяснить, какие еще медикаменты он получает. Целый ряд препаратов может увеличивать потребность в левотироксине. Если не учитывать этот эффект, достижение адекватной компенсации гипотиреоза может быть затруднено.
Нарушение всасывания левотироксина в желудочно-кишечном тракте имеет место на фоне приема лекарственных средств, содержащих сульфат железа, холестирамина, антацидных препаратов, содержащих гидроксид алюминия [29].
Как правило, взаимодействие лекарственных средств при всасывании развивается при их одновременном приеме или интервале между приемами два часа. При интервале между приемами лекарственных препаратов более четырех часов их взаимодействие на уровне всасывания практически исключается.
Если пациенту, получающему левотироксин, необходимо лечение одним из вышеуказанных средств, препятствующих кишечной абсорбции, желательно увеличить промежуток времени между приемами препаратов по максимуму [19].
При совместном приеме с пищей всасывание одних лекарственных средств может замедлиться и снизиться, других, наоборот, ускориться.
Снижение всасывания левотироксина происходит при смешивании с пищей и может зависеть от ее качественного состава: содержания жиров, пищевых волокон, флавоноидов и т.д. Именно поэтому пациентам, получающим заместительную терапию, очень важно соблюдать правила приема левотироксина – утром за 30 минут до первого приема пищи.
Ускорение метаболизма Т4 в печени наблюдается при совместном приеме барбитуратов, рифампицина, фенитоина, карбамазепина [29].
В этой ситуации также необходимо увеличение дозы тиреоидных гормонов. При приеме эстрогенсодержащих препаратов в печени увеличивается синтез тироксинсвязывающего глобулина, что приводит к увеличению связанной фракции тиреоидных гормонов. При этом концентрация свободных тиреоидных гормонов может уменьшиться, что в ряде случаев может потребовать коррекции принимаемой дозы левотироксина.
Необходимость в увеличении дозы возникает при применении лекарственных средств, повышающих его клиренс (фенобарбитал, карбамазепин, фенитоин, сертралин, хлорохин), препаратов, мешающих всасыванию L-Т4 в кишечнике (холестирамин, сукральфат, гидроксид алюминия, сульфат железа, волокнистые пищевые добавки), при повышении концентрации тироксинсвязывающего глобулина, обусловленном беременностью или приемом эстрогенов, при мальабсорбции или целиакии. Так, в одной из работ 20 пациентам с компенсированным гипотиреозом назначили 1200 мг кальция (в виде карбоната кальция) одновременно с L-T4. Уровень ТТГ определяли исходно, через два месяца приема кальция и еще спустя два месяца после отмены кальция. Уровень ТТГ в среднем повысился с 1,6 до 2,7 мЕд/л и в дальнейшем после отмены кальция снизился до 1,4 мЕд/л [30].
Важно отметить, что кальция карбонат, цитрат и ацетат оказывают аналогичное влияние, снижая абсорбцию L-T4 примерно на 20% у здоровых взрослых [31].
Иногда для достижения целевого уровня ТТГ пациенты получают дозу L-T4, значительно превышающую расчетную. Согласно рекомендациям экспертов Американской тиреоидной ассоциации, целесообразно обследовать таких пациентов на наличие гастрита, ассоциированного с Helicobacter pylori, атрофического гастрита или целиакии [3]. В дальнейшем в случае выявления и эффективного лечения данных заболеваний необходимо повторно оценить уровень ТТГ с последующей коррекцией дозы L-T4 при необходимости. В проспективном нерандомизированном исследовании у пациентов, получавших большие дозы L-T4 и не достигших компенсации гипотиреоза, эрадикация Helicobacter pylori привела к снижению уровня ТТГ с 30,5 до 4,2 мЕд/л. Более высокие дозы L-T4 требовались пациентам с антителами к париетальным клеткам, при этом доза препарата коррелировала с титром антител и тяжестью гастрита [30].
Заключение
Назначение заместительной терапии требует тщательного подбора дозы L-Тироксина, а после компенсации гипотиреоза – ежегодного мониторинга уровня ТТГ. Врач должен мотивировать пациента на постоянный прием препарата, то есть пожизненно. Желательно, чтобы пациент получал препарат одного и того же производителя, поскольку из-за различия в ряде компонентов (наполнителей) препарата даже на фоне приема L-Тироксина в одной и той же дозе замена одного препарата другим может повлиять на степень компенсации гипотиреоза. При переводе пациента с одного препарата L-Тироксина на другой необходим контроль ТТГ через шесть – восемь недель и, возможно, коррекция терапии. Применение новой лекарственной формы препаратов L-Тироксин компании «Берлин-Хеми/А. Менарини» позволит минимизировать риск их непереносимости, особенно у лиц с лактазной недостаточностью, а также повысить комплаентность пациентов.
N.M. Platonova, MD, PhD, E.V. Birucova, MD, PhD, Prof.
National Medical Research Center for Endocrinology
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Nadezhda M. Platonova, doc-platonova@inbox.ru
Levothyroxin preparations are regarded as a golden standard of therapy for hypothyroidism. Selection of optimal hormone replacement therapy setting may be complicated and should be based on knowledge of physiology and clinical pharmacology. This review examines the factors affecting absorption, drug safety, thyroid hormone metabolism, and opportunities to improve the therapeutic efficacy of hormone replacement therapy. Selection of starting dose of levothyroxine in primary hypothyroidism in discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.