Сравнительное исследование влияния комплекса оксигидроксида железа и севеламера карбоната на основные показатели минерально-костных нарушений у больных, получающих гемодиализ: результаты проспективного рандомизированного активно контролируемого исследован
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. После четырехнедельного периода отмывания от предыдущих фосфатсвязывающих препаратов 50 стабильных пациентов с гиперфосфатемией (P > 5,5 мг/дл) были рандомизированы в соотношении 1:1 для лечения комплексом оксигидроксида железа (n = 25) или севеламера карбонатом (n = 25) в течение 16 недель. У всех пациентов ежемесячно оценивались уровни P, Ca, иПТГ, протеина Клото, FGF23 и C-реактивного белка (СРБ). Доза обоих препаратов корректировалась в соответствии с сывороточным фосфатом.
Результаты. Терапия комплексом оксигидроксида железа привела к значительному снижению уровня фосфата в сыворотке с 6,8 ± 1,5 до 5,27 ± 0,99 мг/дл (р < 0,01) к концу исследования, тогда как снижения уровня фосфата при лечении севеламера карбонатом не отмечалось: 6,32 ± 1,5 против 6,35 ± 1,9 мг/дл. Количество таблеток, принимаемых пациентами в сутки, было ниже в группе, получавших лечение комплексом оксигидроксида железа (среднее ± SD; 2,0 ± 1,5 таблетки в день) по сравнению с группой севеламера карбоната (среднее ± SD; 6,1 ± 3,2 таблетки в день). Отмечено значительное повышение уровня белка Клото − с 6,9 ± 0,028 до 14,8 ± 1,3 пг/мл в группе пациентов, получавших комплекс оксигидроксида железа, в группе севеламера карбоната существенных изменений не произошло. Средние значения FGF23, иПТГ и Са существенно не изменились в обеих исследуемых группах. В группе получавших комплекс оксигидроксида железа наблюдалось снижение уровня СРБ в два раза (p < 0,01). В ходе исследования шесть пациентов из группы, получавших комплекс оксигидроксида железа, и пять из группы севеламера карбоната выбыли из-за диспепсических симптомов.
Заключение. Комплекс оксигидроксида железа является новым эффективным фосфатсвязывающим препаратом, превосходящим севеламера карбонат по гипофосфатемическому эффекту в коррекции гиперфосфатемии, профиль безопасности которого сравним с севеламера карбонатом. Лечение комплексом оксигидроксида железа ассоциировано с достоверным увеличением уровня белка Клото, а также со снижением уровня СРБ, что может благоприятно влиять на улучшение клинических исходов. Низкая лекарственная нагрузка при применении комплекса оксигидроксида железа способствует лучшей приверженности пациентов к лечению.
Материал и методы. После четырехнедельного периода отмывания от предыдущих фосфатсвязывающих препаратов 50 стабильных пациентов с гиперфосфатемией (P > 5,5 мг/дл) были рандомизированы в соотношении 1:1 для лечения комплексом оксигидроксида железа (n = 25) или севеламера карбонатом (n = 25) в течение 16 недель. У всех пациентов ежемесячно оценивались уровни P, Ca, иПТГ, протеина Клото, FGF23 и C-реактивного белка (СРБ). Доза обоих препаратов корректировалась в соответствии с сывороточным фосфатом.
Результаты. Терапия комплексом оксигидроксида железа привела к значительному снижению уровня фосфата в сыворотке с 6,8 ± 1,5 до 5,27 ± 0,99 мг/дл (р < 0,01) к концу исследования, тогда как снижения уровня фосфата при лечении севеламера карбонатом не отмечалось: 6,32 ± 1,5 против 6,35 ± 1,9 мг/дл. Количество таблеток, принимаемых пациентами в сутки, было ниже в группе, получавших лечение комплексом оксигидроксида железа (среднее ± SD; 2,0 ± 1,5 таблетки в день) по сравнению с группой севеламера карбоната (среднее ± SD; 6,1 ± 3,2 таблетки в день). Отмечено значительное повышение уровня белка Клото − с 6,9 ± 0,028 до 14,8 ± 1,3 пг/мл в группе пациентов, получавших комплекс оксигидроксида железа, в группе севеламера карбоната существенных изменений не произошло. Средние значения FGF23, иПТГ и Са существенно не изменились в обеих исследуемых группах. В группе получавших комплекс оксигидроксида железа наблюдалось снижение уровня СРБ в два раза (p < 0,01). В ходе исследования шесть пациентов из группы, получавших комплекс оксигидроксида железа, и пять из группы севеламера карбоната выбыли из-за диспепсических симптомов.
Заключение. Комплекс оксигидроксида железа является новым эффективным фосфатсвязывающим препаратом, превосходящим севеламера карбонат по гипофосфатемическому эффекту в коррекции гиперфосфатемии, профиль безопасности которого сравним с севеламера карбонатом. Лечение комплексом оксигидроксида железа ассоциировано с достоверным увеличением уровня белка Клото, а также со снижением уровня СРБ, что может благоприятно влиять на улучшение клинических исходов. Низкая лекарственная нагрузка при применении комплекса оксигидроксида железа способствует лучшей приверженности пациентов к лечению.
Введение
Гиперфосфатемия является триггером минерально-костных нарушений при хронической болезни почек (МКН-ХБП) с последующим дисбалансом Са и P в крови и костной ткани, развитием остеодистрофии и сосудистой кальцификации. В последнее десятилетие прогрессирование МКН-ХБП также связывают с повышенным уровнем фактора роста фибробластов 23 (FGF23) и дефицитом протеина αКлото [1]. Действительно, мыши с нокаутом генов белка αКлото и FGF23 имеют общие ключевые фенотипы, связанные с МКН-ХБП, запускающие неконтролируемое повышение уровня фосфата в сыворотке, а также эктопическую и сосудистую кальцификацию [2–4]. Эти животные сыграли важную роль в понимании механизмов взаимодействия αКлото и FGF23 при почечной недостаточности, а также появлении концепции, согласно которой постепенное увеличение уровня FGF23 в крови приводит к подавлению синтеза 1,25-дигидроксивитамина D и развитию гиперпаратиреоза.
Гиперфосфатемия у пациентов с уремией коррелирует с риском смерти [5, 6], и именно поэтому основной целью лечения МКН-ХБП при ухудшении функции почек и при лечении заместительной почечной терапией является контроль фосфора в крови. Однако современные подходы к сокращению потребления фосфатов с пищей в сочетании с приемом кишечных фосфатсвязывающих препаратов (ФСП) часто неэффективны [7, 8]. Выбор оптимального лекарственного средства для коррекции гиперфосфатемии у больных на диализе сегодня становится одной из наиболее важных клинических задач. По разным оценкам, до 74% пациентов с терминальной почечной недостаточностью не соблюдают рекомендации врача (некомплаентны) по приему ФСП [9, 10]. Несоблюдение предписаний врача в первую очередь связано с отказом от приема большого количества таблеток и их неблагоприятными побочными эффектами. С учетом низкой эффективности большинства известных ФСП, применение нового препарата – комплекса оксигидроксида железа, не содержащего кальций и с высокой эффективностью снижающего уровень сывороточного фосфора, представляется перспективным.
Целью настоящего проспективного рандомизированного активно контролируемого исследования было провести сравнительную оценку эффективности нового железосодержащего фосфатсвязывающего препарата − комплекса оксигидроксида железа в сравнении с севеламера карбонатом на показатели МКН-ХБП у пациентов с гиперфосфатемией, находящихся на программном гемодиализе.
Материал и методы
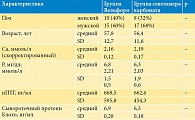
Исследование было проспективным рандомизированным активно контролируемым, проводилось в 2019 г. на базе 12-го отделения гемодиализа ГКБ им. С.П. Боткина г. Москвы. В исследование были включены стабильные пациенты (n = 50) с ХБП 5-й стадии, получавшие лечение программным гемодиализом в течение не менее 12 недель до начала исследования и соответствовавшие критериям включения и исключения.
Критерии отбора в исследование
Критерии включения: возраст 18 лет и старше, независимо от пола, стандартный режим гемодиализа (ГД) три раза в неделю, диализный Kt/V более 1,2 за процедуру, отсутствие изменения дозы ФСП и других препаратов для коррекции МКН (активаторов рецептора витамина D, кальцимиметиков) в течение не менее четырех недель до начала периода отмывания; при скрининговом визите уровень P до процедуры ГД должен был быть ≥ 3,5 мг/дл (1,3 ммоль/л) и < 8,0 мг/дл (2,6 ммоль/л), а в течение периода отмывания ≥ 5,5 мг/дл (1,8 ммоль/л).
Критерии исключения: скорректированный уровень сывороточного Ca менее 1,88 ммоль/л или более 2,75 ммоль/л; уровень интактного паратгормона (иПТГ) более 800 пмоль/л; паратиреоидэктомия в анамнезе не менее чем за шесть месяцев до начала исследования; активное/состоявшееся желудочно-кишечное кровотечение или воспалительные заболевания кишечника; стабильно высокие ежемесячные уровни сывороточного P > 10,0 мг/дл (3,2 ммоль/л) на протяжении трех месяцев до скрининга; поливалентная лекарственная аллергия или непереносимость компонентов лекарств; злокачественные новообразования в анамнезе в течение предшествующих пяти лет.
Дизайн исследования
Исследование включало скрининг, периоды отмывания (четыре недели), титрации доз (восемь недель) и лечения (восемь недель). Перед началом исследования проводилась рандомизация пациентов с помощью интерактивной системы случайных чисел. Пациенты были распределены для лечения оксигидроксидом железа или севеламера карбонатом в соотношении 1:1. Оба исследуемых препарата назначали перорально три раза в день непосредственно во время приема пищи. Каждая таблетка комплекса оксигидроксида железа содержала 500 мг железа. Начальные дозы комплекса оксигидроксида железа были 500 мг (одна таблетка один раз в сутки), севеламера карбоната − 800 мг (одна таблетка три раза в сутки). В дальнейшем дозы препаратов титровали каждые четыре недели, исходя из показателей Р, для достижения целевых значений P (1,13−1,8 ммоль/л). Использовали следующие критерии для коррекции дозы: если концентрация P в сыворотке была более 1,94 ммоль/л, то дозу комплекса оксигидроксида железа увеличивали на 500 мг/день (одна таблетка), а дозу севеламера − на 2400 мг/день (три таблетки); если она находилась в целевом диапазоне 1,13–1,8 ммоль/л, то дозы обоих препаратов не менялись; если уровни Р были менее 1,13 ммоль/л, то дозу комплекса оксигидроксида железа уменьшали на 500 мг в день (одна таблетка), а севеламера карбоната − на 2400 мг в день (три таблетки). Максимальная доза комплекса оксигидроксида железа в нашем исследовании составила 1500 мг (три таблетки в сутки), а доза севеламера карбоната − 7200 мг (девять таблеток в сутки). С восьмой по 16-ю неделю дозы препаратов не изменяли. В течение всего периода исследования был запрещен прием одновременно с исследуемыми препаратами других ФСП, а также прием препаратов, влияющих на концентрацию фосфатов и кальция в сыворотке крови.
Критерии прекращения исследования
Критериями прекращения исследования были: развитие любого нежелательного явления (НЯ), которое затруднило бы продолжение лечения; определение уровней P сыворотки крови менее 0,97 ммоль/л или более 3,23 ммоль/л в течение нескольких заборов крови подряд; определение анализов скорректированного уровня Ca в сыворотке крови менее 1,88 ммоль/л и концентрации ферритина более 1000 мкг/л. Прием активных метаболитов витамина D и кальцимиметиков был разрешен, если пациенты получали их до начала исследования в течение четырех недель или более, а дозы этих препаратов оставались неизменными на протяжении всего периода исследования. Ни одному пациенту эти препараты (активные метаболиты витамина D или кальцимиметики) в течение всего периода исследования не были назначены de novo. Между группами различий в использовании этих препаратов не было. Диета, согласно опросу пациентов, на протяжении всего исследования изменялась ими незначительно.
Анализ крови всем больным проводили после двухдневного перерыва до процедуры ГД во время каждого из этапов исследования (период отмывания, титрации доз и лечения). У всех пациентов ежемесячно оценивали уровни P, Ca, иПТГ, белка Клото, FGF23, С-реактивного белка (СРБ). Исследование проводили в соответствии с этическими стандартами, изложенными в Хельсинкской декларации, пересмотренной в 2013 г. , Национальным стандартом Российской Федерации Надлежащая клиническая практика. Все пациенты дали письменное информированное согласие на их включение в исследование.
Оценка эффективности
Первичным результатом эффективности применения фосфатбиндеров была концентрация фосфора в сыворотке крови в конце лечения. Дополнительные оценки включали концентрацию фосфора в сыворотке крови в каждый момент времени, изменение концентрации фосфора в сыворотке от исходного уровня до конца лечения и показатели достижения целевых концентраций фосфора в сыворотке 1,13–1,78 ммоль/л. Целевые концентрации фосфора в сыворотке ≥ 1,13 ммоль/л
и ≤ 1,78 ммоль/л были основаны на целевом диапазоне рекомендаций Ассоциации нефрологов России.
Вторичными результатами эффективности лечения фосфабиндерами были показатели концентрации кальция в сыворотке крови, иПТГ, FGF23, протеина Клото, СРБ.
Безопасность и переносимость
Безопасность и переносимость оценивались по числу НЯ, серьезных НЯ и отказов больных от продолжения лечения препаратами. Что касается безопасности, к НЯ не относили потемнение фекалий и окрашивание языка, вызванные железом, содержащимся в оксигидроксиде железа. Количество пациентов с событиями и частота событий были рассчитаны в каждой группе.
Статистический анализ
Сравнения между группами проводились с использованием критерия Фишера. Уровень значимости был установлен на уровне 5%. Для оценки разницы в полученных данных исследований использовались непараметрические методы, компьютерное ПО SPSS 18.0.
Результаты
Эффективность
В исследование были включены 50 пациентов. После рандомизации в обе группы лечения – оксигидроксида железа (Вельфоро) и севеламера карбоната – были включены по 25 пациентов. Из-за развития нежелательных явлений из группы оксигидроксида железа выбыло шесть пациентов (24%) и из группы севеламера карбоната − пять пациентов (20%). В общей сложности завершили исследование 19 (75%) и 20 (80%) пациентов из групп оксигидроксида железа и севеламера соответственно. Базовые характеристики пациентов приведены в табл. 1. Статистически значимых различий между двумя группами отмечено не было.
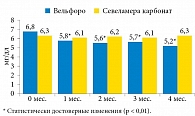
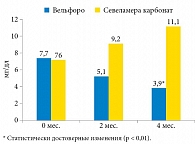
Влияние терапии препаратами оксигидроксида железа (Вельфоро) и севеламера карбоната на сывороточные уровни Р представлено на рис. 1.
Применение оксигидроксида железа сопровождалось достоверным снижением уровней фосфора с 6,8 ± 1,5 до 5,27 ± 0,99 мг/дл (р < 0,01), в то время как использование севеламера карбоната не оказало существенного влияния на этот показатель.
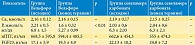
Изменения лабораторных параметров, отражающих минерально-костные нарушения у пациентов исследуемых групп, представлены в табл. 2.
Как видно из табл. 2, применение оксигидроксида железа привело к достоверному изменению уровня P, в то время как использование севеламера карбоната не оказало существенного влияния на этот показатель. Достоверных изменений сывороточных уровней Са, иПТГ и FGF23 не отмечено.
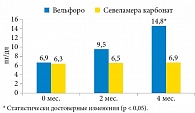
Зафиксировано значительное повышение уровня белка Клото к концу исследования с 6,9 ± 0,028 до 14,8 ± 1,3 пг/мл в группе оксигидроксида железа, в группе севеламера карбоната существенных изменений не отмечено (рис. 2).
К концу исследования отмечалось достоверное снижение уровня СРБ в группе пациентов, получавших оксигидроксид железа, в то время как уровень СРБ в группе севеламера карбоната не изменился (рис. 3).
Анализ полученных данных, приведенных на рис. 3, свидетельствует о значимом снижении уровня СРБ (в два раза) в группе больных, получавших оксигидроксид железа. Применение севеламера карбоната не оказало существенного влияния на этот показатель.
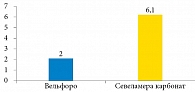
Среднее суточное количество таблеток, которые больные принимали ежедневно в период лечения, составило 2,0 ± 1,5 и 6,1 ± 3,2 в группах оксигидроксида железа и севеламера карбоната соответственно (рис. 4).
Безопасность и переносимость
Существенного различия в частоте возникновения нежелательных явлений, связанных с приемом исследуемых препаратов, не наблюдалось. Наиболее частыми нежелательными явлениями во время приема оксигидроксида железа и севеламера карбоната были тошнота (12 и 4%), диарея (20 и 4%). Запоры (20%), дискомфорт в животе (4%) и боли в животе (4%) встречались только при приеме севеламера карбоната. Большинство случаев диареи были легкими, преходящими и развивались в начале лечения. Всего из исследования по разным причинам выбыло 11 пациентов: из группы оксигидроксида железа шесть больных и пять − из группы севеламера карбоната.
Обсуждение
В ходе нашего исследования было показано, что концентрация фосфора в сыворотке крови при применении оксигидроксида железа достоверно снизилась и в конце лечения находилась в диапазоне контрольных целевых значений (от 1,13 до 1,78 ммоль/л). В то же время прием севеламера карбоната не привел к значимому изменению уровня фосфора в крови. В более ранних работах со схожим дизайном также была показана высокая эффективность оксигидроксида железа [11–13]. В исследовании J. Floege и соавт. [12] применялись более высокие дозы севеламера карбоната, что, возможно, и привело к снижению уровня Р к концу исследования, в отличие от наших данных. Объяснением слабого влияния севеламера карбоната на уровень Р в крови является, вероятно, его низкая фосфатсвязывающая способность (P мг/г ФСП), особенно в сравнении с оксигидроксидом железа (21 против 260 мг/г соответственно) [14]. Подтверждением этого факта служат и данные недавнего систематического обзора исследований Кохрановской базы [15], где отмечена гетерогенность результатов в снижении уровня фосфора в крови на фоне приема севеламера карбоната и очень слабая его эффективность в отобранных для анализа исследованиях.
По нашим данным, среднесуточное потребление таблеток было заметно меньше в группе оксигидроксида железа – 2,0 ± 1,5 против 6,1 ± 3,2 таблетки в сутки в группе севеламера карбоната. В исследовании Y.W. Chiu и соавт. было показано, что прием большого количества таблеток по различным причинам (в среднем 19 таблеток в сутки) негативно влияет на качество жизни пациентов на гемодиализе, а также ухудшает их приверженность к лечению [16], в то время как уменьшение их количества приводит к лучшему контролю Р в крови [17].
Ряд изучаемых лабораторных параметров (ПТГ, Са, FGF23) достоверно не изменялся при применении исследуемых препаратов, что подтверждается и другими авторами [18, 19]. В то же время в нескольких работах показано снижение FGF23 и иПТГ на фоне применения ФСП [20–23]. Объяснить разницу в полученных результатах может степень влияния фосфатбиндеров на уровень Р. Если уровень фосфора не менялся или степень его снижения была выражена незначительно, не отмечалось снижения уровней иПТГ и FGF23.
Особо следует отметить повышение уровня белка Клото более чем в два раза в группе больных, получавших оксигидроксид железа. Белку Клото сейчас отводится ключевая роль в развитии МКН-ХБП. Первоначально Клото был идентифицирован как белок, препятствующий старению [2]. Впоследствии были обнаружены два паралога, и эти три члена с различными функциями были названы α, β и γ. Первый член семейства αKлото имеет множество функций. Так, трансмембранный белок Клото функционирует как ко-рецептор для фактора роста FGF23, регулируя внешний фосфатный баланс [24]. Внеклеточный домен Клото − растворимый Клото (протеин Клото, который определяли в данном исследовании) препятствует сосудистой кальцификации и процессам старения [25, 26]. ХБП, как было показано в ряде работ, представляет собой состояние тяжелого дефицита Клото [3, 27, 28], а повышение уровня белка Клото может способствовать уменьшению кальцификации сосудов при ХБП [29]. Кроме того, было показано, что гипертрофия и фиброз сердца связаны с первичным генетическим дефицитом Клото и вторичным дефицитом Клото в результате фосфатной нагрузки, старения и ХБП. Гипертрофия миокарда предшествует фиброзу сердца и связана с дисфункцией левого желудочка. Более высокий уровень фосфата и более низкий уровень белка Клото коррелируют с большей гипертрофией сердца и фиброзом во всех изученных моделях.
Растворимый Клото (рКлото) непосредственно подавляет поглощение P и минерализацию, вызванную высоким P, in vivo, что в свою очередь способствует снижению хронической гиперфосфатемии и сосудистой кальцификации [30].
Помимо увеличения рКлото в группе оксигидроксида железа мы наблюдали почти двукратное достоверное снижение уровня СРБ, что свидетельствует о меньшем уровне воспаления у этих больных. Объяснением этого может быть связь воспаления с гиперфосфатемией при МКН-ХБП. Так, хорошо известно, что гиперфосфатемия ассоциирована с дисфункцией эндотелия [31], индуцирует экспрессию ядерного фактора каппа-би (NF-κB) и через него – воспаление [32]. Экспрессия белка Клото в свою очередь подавляется провоспалительными цитокинами опять же через механизм, зависимый от NF-κB [33, 34]. Таким образом, снижение уровня воспаления при более низких уровнях фосфора могло быть одной из причин повышения уровня белка Клото у больных в группе оксигидроксида железа.
Из НЯ немного чаще в группе Вельфоро наблюдалась диарея, большинство случаев были легкими и преходящими. Только четверо пациентов прекратили участие в исследовании из-за диареи, другие пациенты продолжили прием препарата. После прекращения приема лекарства диарея прекратилась у всех больных. Многие пациенты с ХБП, получающие процедуры гемодиализа, страдают от запоров. Прием севеламера карбоната сопровождался усугублением этого симптома у четырех больных, которые были вынуждены также прекратить лечение.
К ограничениям исследования можно отнести открытый дизайн, стандартизацию лабораторных анализов (пациенты посещали диализный центр в разное время суток), присутствие фосфатов в рационе пациентов.
Заключение
Применение оксигидроксида железа в группе больных с ХБП, получающих лечение программным гемодиализом, для коррекции гиперфосфатемии было эффективным и безопасным. При этом отмечено снижение лекарственной нагрузки (среднесуточное потребление таблеток было значительно ниже в группе Вельфоро, чем в группе севеламера карбоната). Напротив, лечение севеламера карбонатом не продемонстрировало существенного влияния на уровень Р в крови, что, возможно, связано с недостаточной дозой препарата и требует дальнейших исследований. Кроме того, применение оксигидроксида железа было ассоциировано с достоверным увеличением уровня белка Клото, а также со снижением уровня СРБ, что может благоприятно повлиять на улучшение клинических исходов в дополнение к эффективной коррекции гиперфосфатемии.
E.V. Shutov, PhD, G.V. Kotlyarova, K.M. Lysenko, G.V. Ryabinskaya, PhD, S.V. Lashutin, PhD
S.P. Botkin City Clinical Hospital
Russian Medical Academy of Continuous Professional Education
Contact person: Evgeny V. Shutov, shutov_e@mail.ru
The purpose of the study. Correction of hyperphosphatemia, levels of Ca, intact parathyroid hormone (iPTG), fibroblast growth factor 23 (FGF23), and Klotho protein – key players involved in the occurrence of mineral and bone disorders (MBD) in patients with chronic kidney disease (CKD) − is the main goal to improve the prognosis. However, the results of treatment with MBD-CKD are still unsatisfactory. This is due to the lack of effective and safe medicines. In our prospective randomized controlled trial, we evaluated the effect of 16-week treatment with a new phosphate-binding drug, Sucroferric oxyhydroxide (Velphoro) on MBD-CKD in patients with hyperphosphatemia undergoing programmatic hemodialysis.
Material and methods. After a four-week wash-off period from previous phosphate-binding drugs, 50 stable patients with hyperphosphatemia (P 5.5 mg/dl) were randomized in a 1:1 ratio to be treated with Sucroferric oxyhydroxide (Velphoro) (n = 25) or sevelamer carbonate (n = 25) for 16 weeks. P, Ca, iPTG, Klotho protein, FGF23, and C-reactive protein (CRP) levels were evaluated monthly in all patients. The dose of both drugs was adjusted according to the serum phosphate.
Results. Sucroferric oxyhydroxide (Velphoro) therapy resulted in a significant decrease in serum phosphate levels from 6.8 ± 1.5 to 5.27 ± 0.99 mg/dl (p < 0.01) by the end of the study, while there was no decrease in phosphate levels with sevelamer carbonate: 6.32 ± 1.5 vs. 6.35 ± 1.9 mg/dl. The number of tablets taken by patients per day was lower in the Sucroferric oxyhydroxide (Velphoro) group (mean ± SD; 2.0 ± 1.5 tablets per day) compared to the sevelamer carbonate group (mean ± SD; 6.1 ± 3.2 tablets per day). There was a significant increase in the level of Klotho protein-from 6.9 ± 0.028 to 14.8 ± 1.3 mg/ml in the Sucroferric oxyhydroxide (Velphoro) group, and no significant changes occurred in the sevelamer carbonate group. The mean values of FGF23, iPTG, and Ca did not change significantly in both study groups. In the Sucroferric oxyhydroxide (Velphoro) group, a two-fold decrease in the level of CRP was observed (p < 0.01). In the study, six patients from the Sucroferric oxyhydroxide (Velphoro) group and five from the sevelamer carbonate group dropped out due to dyspeptic symptoms.
Conclusion. Sucroferric oxyhydroxide (Velphoro) is a new effective phosphate-binding drug that surpasses sevelamer carbonate in hypophosphatemia in the correction of hyperphosphatemia, the safety profile of which is comparable to sevelamer carbonate. Treatment with Sucroferric oxyhydroxide (Velphoro) is associated with a significant increase in the level of Klotho protein, as well as with a decrease in the level of CRP, which may favorably affect the improvement of clinical outcomes. Low drug load in the use of iron oxide contributes to better patient adherence to treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.