количество статей
7131
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Поддерживающее лечение больных с метастатическим раком толстой кишки после завершения первой линии химиотерапии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, Гематология и Радиология" №3
- Аннотация
- Статья
- Ссылки
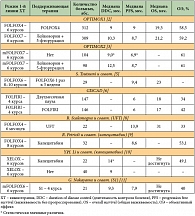
Таблица 1. Сравнение параметров эффективности поддерживающих режимов химиотерапии при метастатическом раке толстой кишки

Таблица 2. Сравнение частоты токсичности 3–4-й степени в зависимости от поддерживающих режимов химиотерапии при метастатическом раке толстой кишки
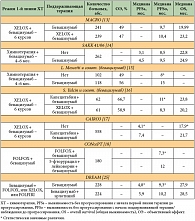
Таблица 3. Сравнение параметров эффективности поддерживающих режимов химиотерапии в сочетании с бевацизумабом при метастатическом раке толстой кишки

Таблица 4. Сравнение параметров эффективности поддерживающих режимов химиотерапии в сочетании с цетуксимабом при метастатическом раке толстой кишки
<p class="x-text">Наиболее широко распространенной стандартной терапией первой линии больных диссеминированным раком толстой кишки является комбинация фторпиримидинов с оксалиплатином или иринотеканом, с возможным добавлением моноклональных антител к рецепторам ростовых факторов – VEGF (vascular endothelial growth factor – фактор роста сосудистого эндотелия) или EGFR (epidermal growth factor receptor – рецептор эпидермального фактора роста), при условии отсутствия мутации гена KRAS в последнем случае. В рутинной практике при достижении эффекта или стабилизации лечение ограничивается проведением 9–12 курсов 1 раз в 2 недели (схемы FOLFOX, FOLFIRI) или 6–8 курсов 1 раз в 3 недели (схемы XELOX, XELIRI). В дальнейшем пациент оставляется под динамическим наблюдением. В клинических исследованиях, как правило, пациенту проводится химиотерапия до прогрессирования или непереносимой токсичности. В случае химиотерапии до прогрессирования развивающиеся осложнения приводят к отказу от дальнейшего лечения у 50% больных. Концепция поддерживающей терапии у больных метастатическим раком толстой кишки после завершения основного химиотерапевтического лечения основана на существовании клинических моделей, показавших, что при постоянном менее токсичном лечении увеличивается время до прогрессирования. Так, при хроническом миелолейкозе рекомендуется продолжать прием иматиниба после достижения эффекта на лечении, при раке яичников – продолжение монотерапии бевацизумабом после окончания первой линии терапии режимом «паклитаксел, карбоплатин, бевацизумаб», при немелкоклеточном раке легкого стандартным является назначение поддерживающей терапии пеметрекседом. Другим вариантом ведения таких больных служит назначение интермиттирующей химиотерапии – несколько месяцев терапии чередуются с так называемыми химиотерапевтическими каникулами, когда пациент находится под наблюдением. В настоящей статье будут рассмотрены преимущества и недостатки различных вариантов тактики ведения пациентов с метастатическим раком толстой кишки после завершения стандартной терапии первой линии.</p>
<p class="x-podzag-"><b>Химиопрепараты: фторпиримидины, оксалиплатин, иринотекан</b></p>
<p class="x-text">Одним из первых исследований, посвященных изучению тактики лечения больных раком толстой кишки с чувствительными к химиотерапии опухолями, было проведено в Великобритании в начале 2000-х гг. [1]. Пациенты (n = 354) с отсутствием прогрессирования заболевания на фоне терапии первой линии 5-фторурацилом или ралтитрексидом были рандомизированы в 2 группы: продолжающих химиотерапию до прогрессирования или остающихся под динамическим наблюдением без лечения. В группе больных без лечения реже развивались серьезные осложнения, при этом не отмечено различий в эффективности лечения. Одним из основных недостатков исследования являлось отсутствие в схемах оксалиплатина или иринотекана. Несмотря на это, полученные результаты создали предпосылки к изучению возможности уменьшения числа курсов терапии первой линии.</p>
<p class="x-text">В исследовании OPTIMOX1 уже проводилось определение необходимости продолжения химиотерапии первой линии по схеме FOLFOX4 до прогрессирования (n = 311) в сравнении с интермиттирующим подходом: 6 курсов химиотерапии по схеме FOLFOX7, затем поддерживающая терапия 6 курсами 5-фторурацилом и лейковорином с последующей реинтродукцией FOLFOX7 (n = 309). При анализе результатов лечения выявлено, что группы не различались ни по времени контроля болезни, ни по времени до прогрессирования, ни по продолжительности жизни (табл. 1). Однако частота побочных явлений 3–4-й степени (нейтропений, нейротоксичности) была ниже в группе с поддерживающей терапией лейковорином и 5-фторурацилом (табл. 2), а такие осложнения, как тромбоцитопения, тошнота, рвота, мукозиты, ладонно-подошвенный синдром, чаще наблюдались в группе с поддерживающей терапией лейковорином и 5-фторурацилом [2]. Повышение частоты встречаемости последних осложнений в группе с интермиттирующей химиотерапией, предположительно, связано с более высокими дозами химиопрепаратов в режиме FOLFOX7. При подгрупповом анализе не удалось выделить в отдельную группу тех, кто бы выигрывал от непрерывной химиотерапии. Положительным моментом в постоянной терапии до прогрессирования считается улучшение достигнутого эффекта на фоне продолжения терапии у больных с чувствительными к химиотерапии опухолями. Однако в исследовании OPTIMOX1 в группе непрерывной химиотерапии только у 8% больных отмечалось улучшение объективного эффекта на фоне продолжения лечения. В то же время у 47% больных удалось достигнуть объективного ответа или стабилизации заболевания на фоне реиндукции оксалиплатина в группе с интермиттирующим лечением. Недостатком исследования явилось отсутствие группы сравнения без поддерживающей терапии после окончания 6 курсов химиотерапии первой линии, а также более высокая интенсивность дозового режима в схеме FOLFOX7 в группе с интермиттирующим лечением.</p>
<p class="x-text">Следующим этапом в изучении эффективности интермиттирующей химиотерапии при метастатическом раке толстой кишки явилось проведение исследования OPTIMOX2. Исследователи учли опыт протокола OPTIMOX1. В данной работе провели сравнение двух лечебных опций: в случае достижения контроля болезни после 6 курсов химиотерапии первой линии по схеме mFOLFOX7 либо прекращалась химиотерапия, либо оставалась поддерживающая терапия лейковорином с инфузиями 5-фторурацила. При развитии прогрессирования проводилась реинтродукция mFOLFOX7. По обновленным данным, получены различия между группами по показателю и времени до прогрессирования и длительности контроля болезни в пользу пациентов с поддерживающей терапией (табл. 1). При поданализе было выявлено, что в группе без химиотерапии достижение объективного эффекта не коррелировало с длительностью интервала без химиотерапии. Наиболее длительное время без химиотерапии было отмечено в группе пациентов с хорошим соматическим статусом (по шкале ECOG (Eastern Cooperative Oncology Group) – 0/1), низким уровнем лактатдегидрогеназы (ЛДГ) и щелочной фосфатазы (ЩФ) (менее чем в 3 раза ниже верхней границы нормы (ВГН)), небольшой распространенностью опухолевого процесса (≤ 1 органа, пораженного метастазами) [3]. Авторы сделали вывод о том, что пациентам с неблагоприятными прогностическими факторами следует возобновлять химиотерапию как можно раньше, а возможно, они являются кандидатами для назначения поддерживающей терапии после достижения эффекта в первой линии химиотерапии. Так как режимы первой линии в обеих группах были одинаковы, то и частота побочных явлений между группами не различалась. Проведение поддерживающей терапии незначительно увеличило частоту побочных эффектов 3–4-й степени (табл. 2). При реинтродукции оксалиплатина частота побочных явлений 3–4-й степени также незначимо увеличилась в группе с поддерживающей терапией, за исключением нейротоксичности. Более высокие показатели длительности контроля болезни в исследовании OPTIMOX2 в сравнении с OPTIMOX1 в группе с поддерживающей терапией лейковорином и 5-фторурацилом можно объяснить более высокой частотой реинтродукций оксалиплатина (более 60% против 40%). Основным недостатком исследования являлось то, что изначально работа планировалась как исследование III фазы, однако во время проведения исследования стандарт первой линии терапии поменялся (был введен бевацизумаб), и исследование было трансформировано во II рандомизированную фазу. Однако количества больных хватило для достижения статистических различий в 20% в двухлетней длительности контроля болезни между группами. Кроме этого, не представлены результаты общей выживаемости.</p>
<p class="x-text">Тем не менее совместный анализ обоих исследований показывает отсутствие необходимости продолжать терапию первой линии до прогрессирования у больных со стабилизацией или эффектом на химиотерапии, а также позволяет предположить, что в группе с неблагоприятными прогностическими факторами назначение поддерживающей терапии может иметь значение. Отметим, что в качестве факторов неблагоприятного прогноза при совокупном анализе данных трех исследований OPTIMOX1, OPTIMOX2 и C97-3 (сравнение назначения режимов FOLFIRI в первой линии, а FOLFOX6 – во второй против обратной последовательности) были выделены следующие признаки: низкий соматический статус (ECOG – 2), высокий уровень ЛДГ (> 1 ВГН), поражение метастазами > 1 органа [4].</p>
<p class="x-text">Другой подход в поддерживающей терапии был представлен в 2011 г. Авторы предложили в случае достижения стабилизации или объективного эффекта после 8–10 курсов химиотерапии первой линии по схеме FOLFOX6 увеличивать интервал между курсами до 3 недель. В исследование удалось включить 29 больных. Медиана времени до прогрессирования и продолжительности жизни составила 9,4 и 23 месяца соответственно. При этом только у 2 больных (6,9%) развилась нейропатия 3-й степени. Такой подход следует изучить в более крупном исследовании [5].</p>
<p class="x-text">Наряду с оксалиплатинсодержащими схемами сопоставимым по эффективности режимом первой линии терапии метастатического рака толстой кишки является режим с иринотеканом – FOLFIRI. Исследование GISCAD было задумано, чтобы получить ответ на вопрос о необходимости проведения химиотерапии по схеме FOLFIRI до прогрессирования. В исследование был включен 331 пациент (в анализ вошли данные только 293 пациентов), в одной группе после двух месяцев терапии при отсутствии прогрессирования продолжали применять режим FOLFIRI до прогрессирования, в другой – делали двухмесячный интервал с последующей реинтродукцией иринотекана. Ни по времени до прогрессирования, ни по общей выживаемости различий между группами получено не было (табл. 1). При этом приблизительно половина больных в группе с интермиттирующим лечением имели только один интервал без химиотерапии. Группы не различались по частоте осложнений 3–4-й степени (табл. 2). Авторы сделали вывод о том, что интермиттирующий режим характеризуется не меньшей эффективностью по сравнению с постоянной химиотерапией по схеме FOLFIRI, однако этот подход не привел к уменьшению частоты осложнений 3–4-й степени [6]. Отсутствие группы сравнения с поддерживающей терапией без иринотекана и всего 4 курса химиотерапии первой линии можно рассматривать в качестве недостатков данного исследования.</p>
<p class="x-text">Интересными видятся результаты исследования по изучению необходимости назначения иринотекана до прогрессирования в монорежиме у больных, резистентных к фторпиримидинам. Из включенных в исследование 333 больных, резистентных к фторпиримидинам, после 24 недель терапии иринотеканом в монорежиме 350 мг/м2 1 раз в 3 недели только у 17% больных отсутствовало прогрессирование болезни. Из них 30 пациентов были оставлены под наблюдением (иринотекан прекращен), а 25 пациентам иринотекан продолжили до прогрессирования. Медиана времени без неудачи лечения составила 3,2 и 4,9 месяца соответственно (р = 0,37). Медианы продолжительности жизни также не различались: 13,4 и 12,1 месяца (р = 0,109) соответственно. Различий в частоте осложнений 3–4-й степени отмечено также не было [7].</p>
<p class="x-text">Таким образом, получены данные об отсутствии необходимости продолжения иринотекансодержащих схем до прогрессирования у больных метастатическим раком толстой кишки при достижении стабилизации или объективного эффекта после окончания основного этапа лечения.</p>
<p class="x-text">Введение в лечение больных метастатическим раком толстой кишки пероральной формы фторпиримидинов (капецитабин, UFT, S1) расширило возможности проведения поддерживающей терапии. Во многом это связано с тем, что лечение пероральными формами препаратов характеризуется более высокой приверженностью пациентов в сравнении с внутривенными введениями. Было проведено несколько исследований поддерживающей терапии таблетированными препаратами. В исследовании II фазы R. Scalamonga и соавт. назначали UFT после 6 месяцев терапии первой линии по схеме FOLFOX4 при отсутствии признаков прогрессирования. В исследование поддерживающего этапа было включено 22 больных. Во время поддерживающей фазы лечения не наблюдалось ни одного случая осложнений 3–4-й степени. Показатели эффективности также были обнадеживающими (табл. 1) [8].</p>
<p class="x-text">В другом исследовании II фазы после 8 курсов химиотерапии первой линии по схеме FOLFOX4 при отсутствии прогрессирования назначалась поддерживающая терапия капецитабином в монорежиме. Окончательный анализ данных эффективности был проведен на 28 больных. Медиана длительности ответа составила 9,2 месяца, а медиана времени до прогрессирования – 8,6 месяца. Медиана количества курсов капецитабина составила 7, реинтродукцию оксалиплатина при прогрессировании удалось произвести 56,2% больным. У большинства больных после 8 курсов FOLFOX4 отмечалась нейротоксичность 1–2-й степени (87,5%) и только у 1 пациента – нейротоксичность 3-й степени. После реинтродукции оксалиплатина ни у одного из пациентов не наблюдалось нейротоксичности 3-й степени. Степень выраженности побочных эффектов на терапии капецитабином была незначительной [9]. В исследовании Y.H. Li и соавт. у 62 из 124 пациентов после 6 курсов химиотерапии по схеме XELOX удалось достичь объективного эффекта или стабилизации. Из них 40 пациентов были оставлены под динамическим наблюдением, а 26 – была назначена поддерживающая терапия капецитабином в монорежиме. Медиана времени контроля болезни была значимо выше в группе с поддерживающей химиотерапией (табл. 1) [10].</p>
<p class="x-text">Еще одной пероральной формой фторпиримидинов является препарат S1. В исследование II фазы было включено 30 больных, у 21 пациента после окончания 6 курсов химиотерапии по схеме mFOLFOX6 достигнута стабилизация или объективный ответ. Этим пациентам назначалась поддерживающая терапия препаратом S1. После 4 курсов поддерживающего лечения 15 больным выполнили реинтродукцию оксалиплатина. Медиана времени контроля болезни и время до прогрессирования составили 9,3 и 7,9 месяца соответственно. Объективный ответ на фоне mFOLFOX6 составил 40%, на фоне поддерживающей терапии – 23,8%, на фоне реинтродукции оксалиплатина – 20%. Из осложнений у 93,3% была отмечена периферическая нейропатия, при этом 3–4-й степени – только у 1 пациента (3,3%). Медиана продолжительности жизни не была достигнута [11]. Реинтродукцию оксалиплатина удалось провести только 9,6% больных. Проявления токсичности поддерживающей терапии были умеренными, только у 1 пациента после двух курсов капецитабина была отмечена 3-я степень ладонно-подошвенного синдрома [10].</p>
<p class="x-text">Проведенные исследования показали возможность применения пероральных форм фторпиримидинов в поддерживающей терапии после окончания первой линии химиотерапии больных метастатическим раком толстой кишки. Однако данные исследования зачастую были немногочисленны и носили ретроспективный характер. Практически в каждом исследовании авторы отмечают более высокую приверженность пациентов лечению и снижение затрат на госпитализацию при применении таблетированных форм лекарственных препаратов в качестве поддерживающего лечения.</p>
<p class="x-text">В 2013 г. на конференции ASCO (American Society of Clinical Oncology – Американское общество клинической онкологии) были представлены результаты метаанализа 10 исследований (4296 больных), посвященных изучению роли поддерживающей терапии после завершения первой линии лечения у больных метастатическим раком толстой кишки. Поддерживающая терапия либо не назначалась (5 исследований – 2562 больных), была представлена или фторпиримидинами (2 исследования – 759 больных), или таргетными препаратами (1 исследование – 852 больных), или комбинацией фторпиримидинов с таргетным препаратом (1 исследование – 123 больных). Оценивалась общая выживаемость в виде отношения риска смерти в группах интермиттирующего лечения против продолжения химиотерапии до прогрессирования. Качество жизни не изменялось или было выше в группе с интермиттирующей химиотерапией. Кроме того, отказ от химиотерапии или переход на интермиттирующее лечение не привел к уменьшению продолжительности жизни (ОР (отношение рисков) 1,02) [12].</p>
<p class="x-podzag-"><b>Таргетные препараты в качестве поддерживающего лечения</b></p>
<p class="x-podzag-small"><b><i>Бевацизумаб</i></b></p>
<p class="x-text">Ангиогенез является одним из основных условий опухолевого роста и метастазирования. В терапии больных метастатическим раком толстой кишки зарегистрировано 2 антиангиогенных препарата: бевацизумаб и афлиберцепт. В настоящее время доступны результаты нескольких исследований по применению бевацизумаба в поддерживающей или интермиттирующей терапии метастатического рака толстой кишки после окончания первой линии химиотерапии.</p>
<p class="x-text">Одним из первых исследований, посвященных поддерживающей терапии бевацизумабом, является исследование MACRO с участием 480 больных метастатическим раком толстой кишки. Пациенты при отсутствии прогрессирования после 6 курсов терапии по схеме «XELOX + бевацизумаб» были рандомизированы в 2 группы. В первой группе проводилась поддерживающая терапия бевацизумабом в монорежиме, во второй – продолжался режим «XELOX + бевацизумаб» до прогрессирования. Статистическая гипотеза исходила из неменьшей эффективности монотерапии бевацизумабом в сравнении с режимом «XELOX + бевацизумаб» на поддерживающем этапе лечения. Как видно из табл. 3, между сравниваемыми группами не отмечено статистически значимых отличий в выживаемости. Нейротоксичность и ладонно-подошвенный синдром 3–4-й степени значимо чаще встречались в группе, получавшей терапию «XELOX + бевацизумаб»: 26 и 13% против 8 и 7% в группе монотерапии бевацизумабом [13]. Формально авторы не подтвердили заявленную ими статистическую гипотезу, и монотерапия бевацизумабом не является не меньшей по эффективности поддерживающей опцией в сравнении с продолжением полноценной химиотерапии режимом «XELOX + бевацизумаб». Кроме того, недостоверные различия в медианах продолжительности жизни в 5 месяцев заставляют задуматься об эффективности поддерживающей терапии бевацизумабом в монорежиме. Принимая во внимание также отсутствие группы сравнения с монотерапией фторпиримидинами в поддерживающей фазе лечения, монотерапию бевацизумабом невозможно рекомендовать к применению.</p>
<p class="x-text">В исследовании SAKK 41/06, результаты которого были доложены на ASCO 2013, проводилось сравнение поддерживающей монотерапии бевацизумабом с полным прекращением лечения у 262 больных без признаков прогрессирования после 4–6 месяцев химиотерапии в сочетании с бевацизумабом [14]. При медиане наблюдения более 28 месяцев время до прогрессирования в группе с бевацизумабом составило 9,5 месяца против 8,5 месяца в группе наблюдения, а медиана продолжительности жизни – 24,9 против 22,8 месяца (табл. 3). Различия в частоте осложнений между группами приема бевацизумаба и отсутствия лечения были незначимыми. И хотя авторы сделали вывод о том, что в отсутствие поддерживающей терапии эффективность терапии бевацизумабом не была достигнута, отметим: в статистической гипотезе было заложено достижение параметра ОР более 0,727, тогда как в исследовании ОР составило 0,72. Кроме того, выбор в качестве контрольной группы бевацизумаба в монорежиме не является оптимальным, так как в монорежиме при раке толстой кишки препарат проявляет незначительную активность. Отсутствие же группы сравнения со фторпиримидинами в качестве поддерживающей терапии также не давало ответа на важный вопрос: что применять в поддерживающей терапии – бевацизумаб, фторпиримидины или их комбинацию?</p>
<p class="x-text">Аналогичное исследование было проведено итальянскими авторами. Пациентам, которые достигли стабилизации или объективного ответа на химиотерапии первой линии в сочетании с бевацизумабом, в дальнейшем назначалась поддерживающая терапия бевацизумабом или проводилось динамическое наблюдение. При медиане наблюдения 18 месяцев медиана выживаемости без прогрессирования была выше в группе с бевацизумабом (табл. 3). При этом различия были наиболее выражены, если сравнивать группы больных с объективным эффектом на индукционном этапе химиотерапии (15 против 10 месяцев, р < 0,001). Пациенты, у которых отмечалась стабилизация, не имели выигрыша в выживаемости до прогрессирования от назначения бевацизумаба [15]. Небольшое время наблюдения в исследовании не позволяет высказаться о преимуществе поддерживающей терапии бевацизумабом в улучшении общей выживаемости больных.</p>
<p class="x-text">В исследовании турецких авторов сравнивались токсичность и эффективность проведения химиотерапии по схеме «XELOX + бевацизумаб» до прогрессирования или назначения после 6 курсов по схеме «XELOX + бевацизумаб» поддерживающей терапии комбинацией капецитабина и бевацизумаба. Было рандомизировано 123 больных метастатическим раком толстой кишки. И если выживаемость до прогрессирования была выше в группе с непрерывным лечением оксалиплатином, то частота объективных ответов и общая выживаемость между группами статистически не различались (табл. 3). По степени выраженности токсических реакций группы сравнения также статистически не различались: 34,4 и 48,4% в группе с капецитабином и бевацизумабом против режима XELOX с бевацизумабом [16]. Авторы делают вывод о возможном ограничении терапии первой линии 6 курсами по схеме «XELOX + бевацизумаб» с последующей поддерживающей терапией капецитабином с бевацизумабом. Однако отсутствие группы с монотерапией капецитабином в поддерживающей фазе лечения, а также недоказанность не меньшей эффективности схемы «капецитабин + бевацизумаб» против «XELOX + бевацизумаб» в отношении общей выживаемости не позволяют рекомендовать к применению данный вариант поддерживающего лечения.</p>
<p class="x-text">В исследовании CAIRO3 оценили эффективность поддерживающей терапии сочетанием капецитабина и бевацизумаба в сравнении с ее отсутствием у пациентов со стабилизацией или объективным эффектом после окончания 6 курсов химиотерапии первой линии по схеме «XELOX + бевацизумаб». Доза капецитабина в поддерживающем режиме составила 625 мг/м2 2 раза в день внутрь ежедневно без перерыва, бевацизумаба – 7,5 мг/кг внутривенно капельно 1 раз в 3 недели. При прогрессировании пациентам проводилась реиндукция режима XELOX. В исследование было включено 558 больных. Отмечены более высокая выживаемость без прогрессирования и общая выживаемость в группе больных с поддерживающей терапией (табл. 3). Однако реинтродукция режима «XELOX + бевацизумаб» после прогрессирования не привела к увеличению медианы времени до прогрессирования: 10,4 месяца в обеих группах. Авторы объясняют это недостаточным числом больных, которым была выполнена реинтродукция. Данные по токсичности представлены не были [17]. Недостатками проведенного исследования являются: отсутствие данных по длительности контроля болезни, отсутствие группы сравнения с поддерживающей терапией капецитабином в монорежиме. Смущают и низкие показатели продолжительности жизни в группе без поддерживающей терапии – всего 17,9 месяца.</p>
<p class="x-text">Еще в одном исследовании CONcePT пациенты были рандомизированы на продолжение терапии по схеме «mFOLFOX7 + бевацизумаб» до прогрессирования или на интермиттирующее назначение режима «mFOLFOX7 + бевацизумаб» в течение 4 месяцев с последующей четырехмесячной поддерживающей терапией 5-фторурацилом, лейковорином и бевацизумабом. Медиана времени до прогрессирования в группе с интермиттирующим режимом была выше (табл. 3). Одновременно пациенты были рандомизированы в зависимости от наличия премедикации препаратами кальция и магния с целью профилактики нейропатии. Однако после включения 180 больных исследование было досрочно завершено по причине более низких показателей объективного эффекта в группе с премедикацией препаратами кальция и магния. И хотя время до прогрессирования было выше в группе с интермиттирующей терапией, данные по различиям в продолжительности жизни так и не были представлены [18].</p>
<p class="x-text">Роль поддерживающей терапии после индукционного сочетания режима FOLFIRI с бевацизумабом в первой линии была оценена в двух исследованиях II фазы. В исследовании итальянских авторов 71 пациенту проводилась индукционная терапия комбинацией «FOLFIRI + бевацизумаб». После 12 курсов пациентам без прогрессирования болезни (n = 26) назначалась поддерживающая терапия бевацизумабом в монорежиме (7,5 мг/кг 1 раз в 3 недели), максимально до 6 месяцев. Медиана времени до прогрессирования и продолжительности жизни для всех 71 пациента составила 9 и 22,2 месяца соответственно, в группе с поддерживающей терапией – 14 и 31,2 месяца соответственно [19]. Во втором исследовании, проведенном во Франции, в качестве индукционного режима была выбрана комбинация FOLFIRI-3 (иринотекан вводится на 1 и 3-й день) с бевацизумабом. После 6 месяцев терапии пациентов переводили на поддерживающее лечение капецитабином с бевацизумабом. В исследование был включен 61 пациент, 40 больных вошли в фазу поддерживающего лечения. Медиана выживаемости без прогрессирования и продолжительности жизни составила 12 и 33 месяца соответственно [20]. Обнадеживающие данные по применению поддерживающей терапии с бевацизумабом после иринотекансодержащих индукционных режимов требуют подтверждения в рандомизированных исследованиях III фазы.</p>
<p class="x-text">Заманчивой казалась возможность сочетанного блокирования сигнальных путей с рецепторов сосудисто-эндотелиального фактора роста и эпидермального фактора роста при метастатическом раке толстой кишки. Комбинация бевацизумаба с моноклональными антителами к EGFR (цетуксимабом или панитумумабом) в первой линии у больных с метастатическим раком толстой кишки не только не улучшило, но и привело к ухудшению результатов лечения [21, 22]. По этой причине в качестве поддерживающего режима была предложена комбинация бевацизумаба (7,5 мг/кг 1 раз в 3 недели) и тирозинкиназного ингибитора EGFR эрлотиниба (150 мг ежедневно). В исследовании DREAM было рандомизировано 472 пациента с метастатическим раком толстой кишки со стабилизацией или объективным ответом после окончания химиотерапии первой линии комбинацией бевацизумаба с режимом FOLFOX, XELOX или FOLFIRI. Одна группа пациентов получала в качестве поддерживающей терапии бевацизумаб в монорежиме, вторая – комбинацию бевацизумаба и эрлотиниба. И хотя выживаемость без прогрессирования была значимо выше в группе комбинированной поддерживающей терапии, на общую выживаемость добавление эрлотиниба к бевацизумабу не повлияло (табл. 3). При этом статус гена KRAS не влиял на эффективность добавления эрлотиниба [23, 24]. В группе комбинированной поддерживающей терапии у 31% больных отмечалась токсичность 3–4-й степени [25]. Отсутствие различий в продолжительности жизни между группами авторы объясняют возможным назначением больным на последующих линиях химиотерапии моноклональных антител к EGFR. Однако в связи с незначительным увеличением только выживаемости без прогрессирования, а также отсутствием групп сравнения с фторпиримидинами внедрение в клиническую практику данного варианта поддерживающего лечения не представляется возможным.</p>
<p class="x-podzag-small"><i><b>Цетуксимаб</b></i></p>
<p class="x-text">В 60–80% случаев рака толстой кишки отмечена гиперэкспрессия гена рецептора к эпидермальному фактору роста (EGFR), что ассоциировано с неблагоприятным прогнозом. Через рецептор от EGFR сигнал передается через ряд внутриклеточных белковых молекул на геном клетки [26, 27]. Одной из таких молекул-передатчиков является белок KRAS. Антитела, блокирующие EGFR, – цетуксимаб и панитумумаб – показали свою эффективность во всех линиях терапии метастатического рака толстой кишки при отсутствии активирующей мутации в гене KRAS [28–30]. В двух исследованиях II фазы (NORDIC 7.5 и COIN-b) была оценена роль цетуксимаба в поддерживающей терапии после окончания первой линии у больных метастатическим раком толстой кишки. Оба исследования были проведены у пациентов с диким типом гена KRAS в опухоли.</p>
<p class="x-text">В исследовании NORDIC 7.5 в качестве индукционного режима проводилось 8 курсов терапии по схеме «FLOX + цетуксимаб» с дальнейшим назначением цетуксимаба в монорежиме в качестве поддерживающей терапии до прогрессирования болезни. Всего в исследование было включено 152 пациента. Объективный ответ, медианы времени до прогрессирования и продолжительности жизни составили 62%, 8 месяцев и 23,2 месяца соответственно. Медиана времени до неудачи выбранной стратегии составила 11,9 месяца. Реинтродукцию режима «FLOX + цетуксимаб» удалось провести 47 больных, у 20% из них отмечался объективный ответ. Токсический профиль был представлен осложнениями 3–4-й степени: диареей (9%), сыпью (9%), инфекцией без нейтропении (7%) и слабостью (7%) [31].</p>
<p class="x-text">В исследовании COIN-b на первом этапе всем больным проводилась терапия по схеме «mFOLFOX6 + цетуксимаб» в течение 12 недель. После этого одна группа больных оставалась под наблюдением, а второй группе пациентов назначалась поддерживающая терапия цетуксимабом. При прогрессировании болезни в обеих группах проводилась реиндукция режима «mFOLFOX + цетуксимаб» [32]. Поддерживающая терапия цетуксимабом на фоне интермиттирующей химиотерапии привела к незначимому повышению медианы времени до неудачи выбранной стратегии и продолжительности жизни (табл. 4). Отсутствие групп сравнения с фторпиримидинами в качестве поддерживающей терапии, неубедительное повышение общей выживаемости не позволяют рекомендовать монотерапию цетуксимабом в качестве поддерживающего лечения при метастатическом раке толстой кишки. По всей видимости, оксалиплатин и струйные введения 5-фторурацила являются не лучшими компонентами в сочетании с цетуксимабом.</p>
<p class="x-podzag-"><b>Заключение</b></p>
<p class="x-text">В небольших исследованиях медиана продолжительности жизни при назначении фторпиримидинов в поддерживающей терапии колеблется от 21,6 до 31 месяца или вовсе не достигается. Эти данные сопоставимы с показателями продолжительности жизни при назначении комбинации бевацизумаба и фторпиримидинов. Таким образом, очевиден пробел в исследованиях – сравнительные исследования этих двух вариантов поддерживающей терапии отсутствуют. Еще одна проблема, требующая дальнейшей проработки, – выбор правильного критерия эффективности при оценке данной стратегии ведения больных. Очевидно, что лучшим критерием является общая выживаемость. Суррогатным маркером общей выживаемости может служить длительность контроля болезни – параметр, фактически представляющий собой сумму 1-го и 2-го времени до прогрессирования. Этот показатель лучше коррелирует с общей выживаемостью, чем такой критерий, как время до неудачи изучаемой лечебной стратегии (TFS – time to failure of strategy) [3]. Другим направлением в данном разделе лечения больных метастатическим раком толстой кишки следует считать изучение факторов, ассоциированных с эффективностью поддерживающей терапии. Другими словами, необходимо отбирать тех больных, которые имеют наибольший выигрыш от назначения поддерживающего лечения. Так, в исследованиях OPTIMOX1 и COIN-b наибольший выигрыш от продолжения химиотерапии до прогрессирования и от поддерживающей терапии цетуксимабом отмечался у пациентов с исходным уровнем тромбоцитов более 400 000 [33].</p>
<p class="x-text">Таким образом, назначение поддерживающей или интермиттирующей терапии у больных метастатическим раком толстой кишки после окончания первой линии химиотерапии является многообещающей областью клинической онкологии. В настоящее время возможно обсуждение с пациентом продолжения поддерживающей химиотерапии после достижения стабилизации или объективного эффекта после 18 недель первой линии химиотерапии. Если не назначался бевацизумаб в первой линии, то в качестве поддерживающей опции рекомендуются фторпиримидины в монорежиме. В случае если добавлялся антиангиогенный препарат в первой линии терапии, то рекомендуется продолжать комбинацию фторпиримидинов и бевацизумаба в качестве поддерживающего лечения. В случае если на первой линии терапии добавлялся цетуксимаб, следует обсудить возможность продолжения терапии цетуксимабом до прогрессирования в монорежиме с учетом возможной токсичности. </p>
1. Maughan T.S., James R.D., Kerr D.J. et al. Comparison of intermittent and continuous palliative chemotherapy for advanced colorectal cancer: a multicentre randomised trial // Lancet. 2003. Vol. 361. № 9356. P. 457–464.
2. Tournigand C., Cervantes A., Figer A. et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer – a GERCOR study // J. Clin. Oncol. 2006. Vol. 24. № 3. P. 394–400.
3. Chibaudel B., Tournigand C., Perez-Staub N. et al. Duration of disease control (DDC) or time to failure of strategy (TFS) to evaluate a chemotherapy strategy in advanced colorectal cancer (ACC) // J. Clin. Oncol. 2009. Vol. 27. № 15. Suppl. Abstr. 4073.
4. Chibaudel B., Bonnetain F., Tournigand C. et al. Simplified prognostic model in patients with oxaliplatin-based or irinotecan-based first-line chemotherapy for metastatic colorectal cancer: a GERCOR study // Oncologist. 2011. Vol. 16. № 9. P. 1228–1238.
5. Tsutsumi S., Watanabe R., Tabe Y. et al. Scheduled prospective tri-weekly modified FOLFOX6 maintenance chemotherapy in the treatment of metastatic colorectal cancer // Hepatogastroenterology. 2011. Vol. 58. № 112. P. 1930–1932.
6. Labianca R., Sobrero A., Isa L. et al. Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised ‘GISCAD’ trial // Ann. Oncol. 2011. Vol. 22. № 5. P. 1236–1242.
7. Lal R., Dickson J., Cunningham D. et al. A randomized trial comparing defined-duration with continuous irinotecan until disease progression in fluoropyrimidine and thymidylate synthase inhibitor-resistant advanced colorectal cancer // J. Clin. Oncol. 2004. Vol. 22. № 15. P. 3023–3031.
8. Scalamogna R., Brugnatelli S., Tinelli C. et al. UFT as maintenance therapy in patients with advanced colorectal cancer responsive to the FOLFOX4 regimen // Oncology. 2007. Vol. 72. № 5–6. P. 267–273.
9. Petrioli R., Paolelli L., Marsili S. et al. FOLFOX-4 stop and go and capecitabine maintenance chemotherapy in the treatment of metastatic colorectal cancer // Oncology. 2006. Vol. 70. № 5. P. 345–350.
10. Li Y.H., Luo H.Y., Wang F.H. et al. Phase II study of capecitabine plus oxaliplatin (XELOX) as first-line treatment and followed by maintenance of capecitabine in patients with metastatic colorectal cancer // J. Cancer Res. Clin. Oncol. 2010. Vol. 136. № 4. P. 503–510.
11. Nakayama G., Kodera Y., Yokoyama H. et al. Modified FOLFOX6 with oxaliplatin stop-and-go strategy and oral S-1 maintenance therapy in advanced colorectal cancer: CCOG-0704 study // Int. J. Clin. Oncol. 2011. Vol. 16. № 5. P. 506–511.
12. Berry S.R., Cosby R., Asmis T.R. et al. Randomized controlled trials (RCTs) examining continuous (CS) versus intermittent strategies (IS) of delivering systemic treatment (Tx) for untreated metastatic colorectal cancer (mCRC): A meta-analysis from the Cancer Care Ontario program in evidence-based care // J. Clin. Oncol. 2013. Vol. 31. Suppl. Abstr. 3534.
13. Díaz-Rubio E., Gómez-España A., Massutí B. et al. First-line XELOX plus bevacizumab followed by XELOX plus bevacizumab or single-agent bevacizumab as maintenance therapy in patients with metastatic colorectal cancer: the phase III MACRO TTD study // Oncologist. 2012. Vol. 17. № 1. P. 15–25.
14. Koeberle D., Betticher D.C., Von Moos R. et al. Bevacizumab continuation versus no continuation after first-line chemobevacizumab therapy in patients with metastatic colorectal cancer: A randomized phase III noninferiority trial (SAKK 41/06) // J. Clin. Oncol. 2013. Vol. 31. Suppl. Abstr. 3503.
15. Moscetti L., Cortesi E., Gamucci T. et al. Maintenance treatment with bevacizumab after chemotherapy (CT) plus B in metastatic colorectal cancer: An Italian multicenter retrospective analysis // J. Clin. Oncol. 2011. Vol. 29. № 15. Suppl. Abstr. e14043.
16. Yalcin S., Uslu R., Dane F. et al. Bevacizumab (BEV) plus capecitabine as maintenance therapy after initial treatment with BEV plus XELOX in previously untreated patients (pts) with metastatic colorectal cancer (mCRC): Mature data from STOP and GO, a phase III, randomized, multicenter study // J. Clin. Oncol. 2012. Vol. 30. № 15. Suppl. Abstr. 3565.
17. Koopman M., Simkens L.H.J., Tije A.J.T. et al. Maintenance treatment with capecitabine and bevacizumab versus observation after induction treatment with chemotherapy and bevacizumab in metastatic colorectal cancer (mCRC): The phase III CAIRO3 study of the Dutch Colorectal Cancer Group (DCCG) // J. Clin. Oncol. 2013. Vol. 31. Suppl. Abstr. 3502.
18. Grothey A., Hart L., Rowland K. et al. Intermittent oxaliplatin (oxali) administration and time-to-treatment failure (TTF) in metastatic colorectal cancer (mCRC): final results of the phase III CONcePT trial // J. Clin. Oncol. 2008. Vol. 26. № 15. Suppl. Abstr. 4010.
19. Giuliani F., De Vita F., Addeo R. et al. Folfiri plus bevacizumab as first-line treatment in metastatic colorectal cancer: a phase II study by the Gruppo Oncologico dell’Italia Meridionale (prot. 2601). In press.
20. Kim S.C.H. FOLFIRI-3/bevacizumab induction, then capecitabine/bevacizumab maintenance as front-line strategy for metastatic colorectal cancer: A phase II trial // J. Clin. Oncol. 2012. Vol. 30. № 15. Suppl. Abstr. e14007.
21. Saltz L.B., Lenz H.J., Kindler H.L. et al. Randomized phase II trial of cetuximab, bevacizumab, and irinotecan compared with cetuximab and bevacizumab alone in irinotecan-refractory colorectal cancer: the BOND-2 study // J. Clin. Oncol. 2007. Vol. 25. № 29. P. 4557–4561.
22. Hecht J.R., Mitchell E., Chidiac T. et al. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer // J. Clin. Oncol. 2009. Vol. 27. № 5. P. 672–680.
23. Tournigand C., Chibaudel B., Samson B. et al. Maintenance therapy with bevacizumab with or without erlotinib in metastatic colorectal cancer (mCRC) according to KRAS: Results of the GERCOR DREAM phase III trial // J. Clin. Oncol. 2013. Vol. 31. Suppl. Abstr. 3515.
24. Samson B., Tournigand C., Scheithauer W. et al. Bevacizumab (Bev) with or without erlotinib as maintenance therapy, in patients (pts) with metastatic colorectal cancer (mCRC): Exploratory analysis according to KRAS status in the gercor DREAM phase III trial // J. Clin. Oncol. 2012. Vol. 30. Suppl. 34. Abstr. 448.
25. Johnsson A., Frodin J., Berglund A. et al. A randomized phase III trial on maintenance treatment with bevacizumab (bev) alone or in combination with erlotinib (erlo) after chemotherapy and bev in metastatic colorectal cancer (mCRC) // J. Clin. Oncol. 2011. Vol. 29. № 15. Suppl. Abstr. 3526.
26. Mendelsohn J., Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer // J. Clin. Oncol. 2003. Vol. 21. № 14. P. 2787–2799.
27. Mayer A., Takimoto M., Fritz E. et al. The prognostic significance of proliferating cell nuclear antigen, epidermal growth factor receptor, and mdr gene expression in colorectal cancer // Cancer. 1993. Vol. 71. № 8. P. 2454–2460.
28. Custodio A., Feliu J. Prognostic and predictive biomarkers for epidermal growth factor receptor-targeted therapy in colorectal cancer: beyond KRAS mutations // Crit. Rev. Oncol. Hematol. 2013. Vol. 85. № 1. P. 45–81.
29. Di Fiore F., Blanchard F., Charbonnier F. et al. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy // Br. J. Cancer. 2007. Vol. 96. № 8. P. 1166–1169.
30. Lièvre A., Bachet J.B., Boige V. et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab // J. Clin. Oncol. 2008. Vol. 26. № 3. P. 374–379.
31. Pfeiffer P., Sorbye H., Qvortrup C. et al. Maintenance therapy with biweekly cetuximab (C) in the first-line treatment of metastatic colorectal cancer (mCRC): The NORDIC 7.5 study (NCT00660582), by the Nordic Colorectal Cancer Biomodulation Group // J. Clin. Oncol. 2012. Vol. 30. Suppl. Abstr. 3538.
32. Wasan H., Adams R.A., Wilson R.H. et al. Intermittent chemotherapy (CT) plus continuous or intermittent cetuximab (C) in the first-line treatment of advanced colorectal cancer (aCRC): Results of the two-arm phase II randomized MRC COIN-b trial // J. Clin. Oncol. 2012. Vol. 30. Suppl. 4. Abstr. 536.
33. Seymour M. Conceptual approaches to metastatic disease // Ann. Oncol. 2012. Vol. 23. Suppl. 10. P. x77–x80.
Новости на тему
ИНСТРУМЕНТЫ
PDF
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.