Роль таргетных препаратов в терапии рака яичников
- Аннотация
- Статья
- Ссылки

Молекулярные основы патогенеза рака яичников
Рак яичников – чрезвычайно гетерогенное заболевание. Формы рака яичников различаются по клиническому течению, а также по молекулярным нарушениям, лежащим в основе опухолевой прогрессии. Именно этим еще недавно объяснялись неудачи исследований таргетной терапии при раке яичников. Однако в последние годы удалось создать молекулярно-биологическую классификацию рака яичников. На основании данных молекулярно-генетического и клинико-морфологического анализа пограничных и инвазивных опухолей яичников установлены два принципиально разных пути канцерогенеза наиболее часто встречающегося серозного рака яичников. На молекулярном уровне опухоли первого типа характеризуются наличием мутаций генов KRAS, BRAF, PTEN, присутствием дикого типа TP53, относительной генетической стабильностью, низкой степенью злокачественности и возникают на месте хорошо описанных предшественников, в частности из пограничных опухолей [1]. Второй путь (примерно 75% случаев) характерен для агрессивных, высокозлокачественных опухолей, возникающих без каких-либо предшественников. Такие опухоли отличаются наличием мутации TP53, выраженной генетической нестабильностью и отсутствием мутаций генов, характерных для опухолей первого типа (таблица). Эти и еще некоторые особенности канцерогенеза рака яичников дают основу для разработки таргетных препаратов, воздействующих на относительно часто встречающиеся молекулярные нарушения в опухолевых клетках.
Антиангиогенная терапия
По данным крупных исследований III фазы GOG-0218 и ICON7, хорошо известный препарат бевацизумаб, действие которого реализуется за счет связывания с VEGF (vascular endothelial growth factor – фактор роста эндотелия сосудов), статистически значимо увеличивает время до прогрессирования рака яичников в комбинации с паклитакселом и карбоплатином в первой линии химиотерапии по сравнению с терапией карбоплатином и паклитакселом без бевацизумаба [2, 3].
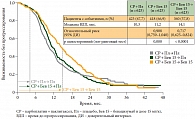
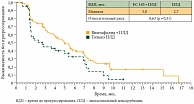
Дизайн этих двух исследований имеет принципиальные различия. В многоцентровом рандомизированном двойном слепом плацебоконтролируемом исследовании GOG-0218 доза бевацизумаба составляла 15 мг/кг. Пациентки с III–IV стадиями рака яичников были рандомизированы в 3 группы: больные в первой группе получали 6 курсов химиотерапии карбоплатином и паклитакселом в сочетании с плацебо, во второй группе – 6 курсов химиотерапии с бевацизумабом (6 курсов) с последующим переводом на поддерживающую терапию плацебо, а в третьей – 6 курсов химиотерапии с бевацизумабом, затем переведены на бевацизумаб, который суммарно принимали в течение 15 месяцев (во время химиотерапии и после ее окончания) [2]. Добавление бевацизумаба только во время химиотерапии не привело к улучшению результатов лечения по сравнению с группой контроля (медианы времени до прогрессирования составили 10,2 и 11,3 месяца соответственно). При этом применение бевацизумаба во время химиотерапии с последующим поддерживающим лечением бевацизумабом в течение 15 месяцев статистически значимо увеличивало медиану времени до прогрессирования на 4 месяца (рис. 1) по сравнению с группой контроля (14,1 и 10,3 месяца соответственно, р < 0,0001). По итогам промежуточного анализа продолжительность жизни больных по группам статистически значимо не различалась, что может быть связано с так называемым перекрестом, поскольку препарат в период проведения исследования уже активно применялся в клинической практике при рецидивах рака яичников и больные контрольной группы могли получать его в дальнейшем. Так, в группе с плацебо последующее лечение бевацизумабом или другим антиангиогенным препаратом проводилось практически в два раза чаще, чем в группе с поддерживающей терапией бевацизумабом.
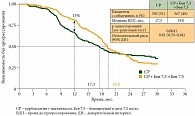
Многоцентровое рандомизированное исследование ICON7 предусматривало включение больных как с распространенным процессом (III–IV стадии), так и с ранним раком (I–II стадии). Доза бевацизумаба в этом исследовании была в 2 раза ниже, чем в исследовании GOG-0218, а длительность применения этого таргетного препарата ограничивалась 12 месяцами [3]. Исследование продемонстрировало пользу длительного лечения бевацизумабом с увеличением медианы времени до прогрессирования на 2 месяца по сравнению с группой контроля, получавшей только химиотерапию (медианы составили 18,3 и 16 месяцев соответственно, р = 0,001) (рис. 2).
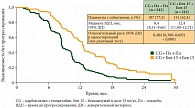
Бевацизумаб увеличивает время до прогрессирования и при платиночувствительных рецидивах рака яичников. Это доказано в крупном рандомизированном двойном слепом плацебоконтролируемом исследовании OCEANS, где бевацизумаб в дозе 15 мг/кг применялся в сочетании с химиотерапией карбоплатином и гемцитабином [4]. Продемонстрировано статистически значимое увеличение медианы времени до прогрессирования с 8,4 месяца в группе контроля до 12,4 месяца в группе химиотерапии с добавлением бевацизумаба (p < 0,0001) (рис. 3). Длительность лечения бевацизумабом ограничивалась прогрессированием заболевания.
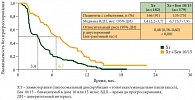
В 2012 г. на конференции ASCO (American Society of Clinical Oncology – Американское общество клинической онкологии) представлены результаты исследования AURELIA, целью которого была оценка эффективности бевацизумаба при платинорезистентном раке яичников [5]. Больные с длительностью бесплатинового интервала менее 6 месяцев получали химиотерапию в сочетании с бевацизумабом или только химиотерапию. Химиотерапия включала липосомальный доксорубицин, еженедельно паклитаксел или топотекан на выбор. Лечение проводилось до прогрессирования с последующим переходом на монотерапию бевацизумабом для группы пациенток, получавших только химиотерапию. Исследование показало статистически значимое увеличение медианы времени до прогрессирования почти в 2 раза: с 3,4 до 6,7 месяца (рис. 4). Частота объективных эффектов также имела статистически значимые отличия в пользу бевацизумаба.
Таким образом, бевацизумаб является наиболее изученным таргетным препаратом при раке яичников, однако не единственным. На этапе клинических исследований находятся немало новых препаратов, воздействующих на ангиогенез опухоли, – ингибиторы тирозинкиназных доменов рецепторов к сосудистому эндотелиальному, тромбоцитарному факторам роста, фактору роста фибробластов, а также ингибиторы ангиопоэтина-1, -2.
Новый подход к антиангиогенной терапии заключается в ингибировании не одного эндотелиального фактора (как в случае бевацизумаба), а двух и более сигнальных путей, задействованных в этом процессе. Если на ранних этапах канцерогенеза VEGF и его рецепторы являются основными драйверами ангиогенеза в опухоли, то в процессе опухолевой прогрессии присоединяются другие пути, ведущие впоследствии к развитию резистентности к бевацизумабу [6]. К ним относятся тромбоцитарный фактор роста (PDGF – platelet-derived growth factor) и фактор роста фибробластов (FGF – fibroblast growth factor). Блокирование всех этих сигнальных молекул или их рецепторов весьма целесообразно, поскольку их действие взаимосвязано. Один из таких препаратов – тирозинкиназный ингибитор цедираниб – блокирует передачу сигнала от всех трех известных рецепторов сосудистого эндотелиального фактора, рецепторов фактора роста тромбоцитов, а также в меньшей степени фибробластов. В монорежиме в исследовании
II фазы у больных рецидивирующим раком яичников в 30% случаев достигался клинический эффект, выраженный в виде объективного эффекта или стабилизации более 16 недель [7]. В настоящее время продолжается крупное рандомизированное исследование ICON6 по оценке эффективности цедираниба в сочетании с химиотерапией второй линии при платиночувствительном раке яичников. Изучаются и другие аналогичные препараты – пазопаниб и BIBF 1120.
Ингибитор других проангиогенных факторов, ангиопоэтинов-1 и -2, препарат AMG386 оценивали в исследовании II фазы с участием 161 пациентки с рецидивирующим раком яичников. Пациентки исследуемой группы принимали препарат в дозах 10 и 3 мг/кг в сочетании с паклитакселом в еженедельном режиме. Контрольную группу составляли больные, получавшие паклитаксел в сочетании с плацебо [8]. Медианы времени до прогрессирования в группах пациенток, получавших AMG386 10 мг/кг, 3 мг/кг и плацебо, составили 7,2, 5,7 и 4,6 месяца соответственно (р = 0,17). Отсутствие статистической значимости при сравнении времени до прогрессирования объясняется небольшой численностью больных в группах, поэтому сейчас проводятся крупные исследования TRINOVA 1 и TRINOVA 3 по оценке эффективности химиотерапии AMG386 как в первой линии, так и при рецидивах.
Суммируя вышеизложенное, можно предположить, что новые препараты, направленные на подавление ангиогенеза опухоли, позволят улучшить результаты, достигнутые с помощью бевацизумаба. Очень важно, что эти препараты смогут работать там, где есть устойчивость опухоли к бевацизумабу.
Ингибиторы фолатных рецепторов альфа
Другим перспективным классом молекул являются антагонисты фолатных рецепторов альфа. В ходе исследований обнаружено, что на мембране клеток рака яичников (за исключением муцинозного) более чем в 70% случаев экспрессирован рецептор фолатов альфа [9]. Соединяясь с фолатами, рецептор индуцирует эндоцитоз, благодаря чему фолаты попадают в цитоплазму опухолевой клетки и служат источником для синтеза ДНК. Ингибирование этих рецепторов способно, во-первых, блокировать транспорт фолатов в опухолевую клетку и процесс опухолевой пролиферации, а во-вторых, вызывать целенаправленный апоптоз опухолевых клеток, если связывающийся с фолатным рецептором препарат обладает цитотоксическим эффектом. Один из подобных препаратов EC 145 (винтафолид) представляет собой фолиевую кислоту, конъюгированную с винкаалкалоидным производным. Препарат оказался эффективен при платинорезистентном раке яичников (рис. 5), приводя к статистически значимому увеличению времени до прогрессирования при его добавлении к липосомальному доксорубицину по сравнению с монотерапией липосомальным доксорубицином (медианы времени до прогрессирования составили 21,7 и 11,7 недели соответственно) [10].
Синтетическая летальность и PARP-ингибиторы
Известно, что 10–15% серозных карцином яичников носят наследственный характер, обусловленный герминальной мутацией генов BRCA 1 или 2. Эти опухоли имеют дефект системы гомологичной рекомбинации ДНК, в работе которой в норме оба белка принимают участие. В этом случае опухолевые клетки становятся гиперзависимыми от одной из пяти других систем репарации. В случае рака яичников речь идет о гиперзависимости от эксцизионной репарации азотистых оснований (англ. base excision repair). В работе этого пути репарации принимает участие фермент PARP (poly ADP ribose polymerase – поли(АДФ-рибоза)-полимераза). Его ингибирование при условии дефицита гомологичной рекомбинации ведет клетку к апоптозу из-за невозможности репарации всех возникших повреждений ДНК. Этот процесс был назван синтетической летальностью. На нем основано действие ингибиторов фермента PARP, когда они используются в монорежиме [11].
В исследовании II фазы оценивалась эффективность монотерапии PARP-ингибитором олапарибом. В исследование были включены
33 больных резистентным к химиотерапии раком яичников с герминальной мутацией BRCA 1/2. Получено 33% объективных эффектов, что является очень высоким показателем для этой неблагоприятной когорты больных [12]. По результатам другого исследования II фазы, в котором сравнивался эффект олапариба в двух разных дозах и липосомального доксорубицина у больных с мутацией BRCA, медианы времени до прогрессирования составили 6,5, 8,8 и 7,1 месяца при применении олапариба в дозе 200 и 400 мг и липосомального доксорубицина соответственно [13].
На основании таких обнадеживающих данных можно было бы заключить, что вскоре мы будем иметь в арсенале еще один класс таргетных препаратов, эффективность которых в некоторой степени можно предсказать с помощью предиктора, а именно статуса BRCA. Однако производители PARP-ингибиторов расширили область применения препаратов, показав их эффективность и в отсутствие герминальной мутации BRCA. В 2010 г. на конференции ASCO были представлены результаты лечения больных высокозлокачественными серозными карциномами яичников с неизвестным статусом BRCA. Отмечено 26,4% объективных эффектов во всей группе (n = 53), при этом частота объективных эффектов схожа с таковой в группе отобранных больных. Оказалось, что у 7 из 53 больных были мутации BRCA, а у 11 (23,9%) из 46 больных без мутации BRCA отмечен объективный эффект [14].
Отметим, что, по некоторым данным, 20% всех высокозлокачественных серозных карцином яичников (опухоли II типа) содержат не только герминальные, но и соматические мутации BRCA. Кроме того, для полного понимания причин эффективности PARP-ингибиторов при спорадическом раке яичников важно взглянуть на суть работы системы гомологичной рекомбинации. В этом процессе задействовано достаточно много молекул белков. Нарушение работы любой из них может привести к дефициту системы гомологичной рекомбинации в целом. Выделяют следующие патологические процессы:
- повышенная экспрессия белков, инактивирующих BRCA, в частности EMSY (8%);
- гиперметилирование промоторов генов BRCA (11%);
- гиперметилирование промотора гена FANCF и дефекты других белков комплекса анемии Фанкони (5%);
- пониженная экспрессия еще ряда белков, задействованных в системе гомологичной рекомбинации, в частности Rad51, ATR, ATM, CHK2 (5%);
- дефицит PTEN (7%) [11].
По данным крупнейшего исследования генетических нарушений при высокозлокачественном серозном раке яичников, частота дефицита гомологичной рекомбинации составляет примерно 50% [15].
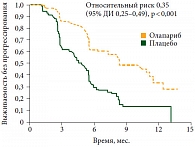
Попытка доказать эффективность ингибитора PARP олапариба у всех больных высокозлокачественным серозным раком яичников без поиска биомаркеров оказалась не вполне удачной. В 2012 г. опубликованы результаты рандомизированного исследования II фазы, в котором больные с платиночувствительными рецидивами высокозлокачественного серозного рака яичников, имеющие объективный эффект после окончания платиносодержащей химиотерапии, рандомизировались в одну из двух групп. Пациентки в первой группе получали поддерживающую терапию олапарибом 400 мг 2 раза в сутки внутрь до прогрессирования заболевания, а второй – плацебо в том же режиме [16]. В итоге получена статистически значимая разница в продолжительности жизни (рис. 6) в пользу олапариба (р < 0,001), однако общая продолжительность жизни была одинаковой в обеих группах (р = 0,75).
Возникает вопрос: если мы хотим использовать PARP-ингибиторы не для всех случаев высокозлокачественного серозного рака яичников, а лишь для тщательно отобранных больных, то какие методы нам следует использовать для идентификации дефицита гомологичной рекомбинации? В настоящее время идет поиск этих маркеров. Пока тест на дефицит гомологичной рекомбинации, основанный на анализе фокусов RAD51 в местах двунитевых разрывов ДНК, разработан только для живой ткани [11]. Задачей текущих исследований является определение биомаркеров на архивном материале, представленном парафиновыми блоками.
Эпигенетическая терапия
В последнее время все больше внимания уделяется эпигенетическим нарушениям как одному из механизмов прогрессии опухоли и развития резистентности к химиотерапии. Ферменты ДНК-метилтрансферазы катализируют прикрепление метиловых групп к динуклеотидам «цитозин – гуанин», расположенным в большом количестве на уровне промоторов генов. В результате нарушения работы этих ферментов возникает гиперметилирование генов-супрессоров и гипометилирование онкогенов. Другой механизм эпигенетической регуляции генов лежит в изменении конфигурации белков-гистонов. Потеря ацетилирования гистонов в результате ненормальной активности гистоновых деацетилаз делает хроматин более компактным и блокирует транскрипционную активность генов данного участка хромосомы. Считается, что процессы гиперметилирования и гипоацетилирования преобладают в опухолевых клетках. Подобный фенотип ассоциирован с худшим прогнозом [17]. Эти данные указывают на возможную эффективность препаратов, блокирующих функцию метилтрансфераз и гистоновых деацетилаз.
В действительности гипометилирующий препарат фазарабин (Ara-AC), а также ингибитор деацетилаз вориностат в монорежиме у больных с рецидивами рака яичников продемонстрировали низкую эффективность [18, 19]. Несколько исследований было посвящено комбинации гипометилирующих препаратов с химиотерапией при рецидивах рака яичников. В 2011 г. исследователи Британской онкологической группы опубликовали данные исследования II фазы режима с включением децитабина и карбоплатина у 17 больных платинорезистентным и рефрактерным раком яичников. Получены многообещающие результаты: 35% объективных эффектов, медиана времени до прогрессирования составила 10,1 месяца [20]. Таким образом, продемонстрирована невысокая собственная эффективность деметилизующих препаратов и ингибиторов деацетилаз, но выраженная способность восстанавливать чувствительность клеток рака яичников к карбоплатину. Действительно, ряд исследований in vitro показал, что резистентность к производным платины сопровождается гиперметилированием ряда генов и сигнальных путей, участвующих в ответе на действие этих препаратов [17]. Вполне возможно, что процессы деацетилирования также задействованы в платинорезистентности. Исследования этих препаратов при раке яичников продолжаются и считаются перспективными.
Ингибиторы HER2/neu
Ингибиторы HER2/neu изучали в нескольких проспективных исследованиях. Одно из самых крупных было посвящено оценке эффективности монотерапии трастузумабом при рецидивах рака яичников [21]. Исследователи провели скрининг больных с рецидивами рака яичников на наличие экспрессии HER2/neu иммуногистохимическим методом. У 837 скринированных больных только в 45 случаях выявлена гиперэкспрессия HER2/neu, что составило 5%. Для участия в исследовании авторы отобрали всех больных с экспрессией 2+ или 3+. Из 95 таких пациенток только 41 соответствовала всем критериям включения, получила лечение трастузумабом, и в дальнейшем их данные были использованы для анализа. Основная часть больных (66%) имели экспрессию 2+. Данные по амплификации не получены. Отмечено лишь 7% объективных эффектов и 39% случаев стабилизации опухолевого процесса в отобранной группе. Эти данные свидетельствуют о том, что для большинства больных трастузумаб не подходит. Факт гиперэкспрессии HER2/neu при использовании иммуногистохимического метода не дает четких показаний к назначению ингибиторов этого рецептора.
Однако в последнее время выяснилось, что некоторые муцинозные карциномы яичников имеют амплификацию гена HER2/neu и гиперэкспрессию его белка. Тайваньские исследователи опубликовали результаты своего исследования по оценке статуса HER2/neu в 27 образцах рака яичников, из которых 4 опухоли были муцинозными, остальные – немуцинозными. Во всех четырех муцинозных карциномах выявлена амплификация HER2/neu. При этом ни в одной из немуцинозных карцином амплификация HER2/neu не выявлена [22].
В наиболее крупном исследовании амплификация HER2/neu отмечена в 6 из 33 (18%) образцов муцинозных карцином яичников [23]. Три пациентки с амплификацией HER2/neu получали трастузумаб. В двух случаях отмечен длительный эффект, в одном случае эффект проследить не удалось.
Недавно опубликованные результаты геномного анализа 50 образцов светлоклеточного рака яичников показали наличие амплификации HER2/neu в 14% случаев [24]. Получается, что при редкой частоте гиперэкспрессии HER2/neu и амплификации его гена в общей группе карцином яичников в подгруппе муцинозных и светлоклеточных карцином этот рецептор встречается значительно чаще. Это делает целесообразным скрининг всех муцинозных и светлоклеточных опухолей яичников на амплификацию гена HER2/neu, тем более что они отличаются устойчивостью к химиотерапии, и результаты их лечения на III–IV стадиях остаются крайне неудовлетворительными. Целесообразность этой тактики уже доказана, а сама тактика освоена при раке желудка, что важно, так как муцинозные опухоли яичников в некоторых аспектах похожи на опухоли желудочно-кишечного тракта.
Сигнальный путь фосфатидилинозитол-3-киназы
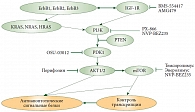
Сигнальный путь фосфатидилинозитол-3-киназы (PI3K) активирован примерно в 45% случаев серозных карцином с высокой степенью злокачественности, 20–45% эндометриоидных карцином и 50% светлоклеточных карцином [15, 24–26]. Активация данного сигнального пути может быть запущена за счет нарушения работы различных звеньев этой сигнальной цепи, но чаще всего за счет амплификации гена каталитической субъединицы PI3K (PIK3CA), и влечет за собой не только усиление пролиферативной способности клетки, но и развитие резистентности к химиотерапии. Ингибирование сигнального пути, как показывают экспериментальные данные, во-первых, ведет клетку к апоптозу; во-вторых, увеличивает активность цитостатиков; в-третьих, повышает токсичность цитостатических препаратов [27]. Ингибиторы этого сигнального пути сейчас проходят ранние стадии клинических исследований. На уровне I–II фазы находятся ингибиторы PI3K, AKT, PDK-1 (рис. 7). Проводятся исследования по применению при раке яичников ингибиторов рецептора инсулиноподобного фактора роста I типа. Ингибиторы mTOR уже продемонстрировали свою эффективность при раке почки, активно изучаются при раке эндометрия. На сегодняшний день слишком мало данных об эффективности m-TOR-ингибиторов при раке яичников как в монотерапии, так и в комбинации с химиотерапией.
Заключение
В настоящем обзоре мы не претендовали на полное отображение ситуации в доклинических и клинических исследованиях противоопухолевых препаратов при раке яичников. Все перечисленные выше препараты объединяет наличие определенной молекулярной мишени в опухолевой клетке. Крайне важным является доказательство высокой эффективности этих препаратов в тех случаях, когда опухолевые клетки активно используют белки, на которые действуют эти лекарственные средства. Именно поэтому во всех исследованиях параллельно ведется поиск адекватных биомаркеров эффективности новых препаратов, что становится основной тенденцией в развитии терапии рака яичников.
Большую значимость приобретает гистологическая и молекулярно-биологическая классификация рака яичников, о которой говорилось в начале статьи. В частности, из перечисленных групп препаратов только ингибиторы ангиогенеза могут использоваться при любом гистотипе рака яичников, однако в настоящее время ведутся попытки индивидуализировать их назначение. Ингибиторы фолатных рецепторов неэффективны при муцинозном раке, а PARP-ингибиторы действуют только при серозных и эндометриоидных карциномах высокой степени злокачественности и, возможно, при светлоклеточном раке. При этих же гистологических типах должны исследоваться ингибиторы PI3K/Akt-сигнального пути. В свою очередь ингибиторы HER2/neu должны изучаться при муцинозных и светлоклеточных карциномах. Таким образом, на наш взгляд, эта классификация уже сейчас должна лежать в основе индивидуализации лечебных подходов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.