количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Подходы к терапии герпетиформного дерматита Дюринга
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 2
- Аннотация
- Статья
- Ссылки
Применение препарата дапсон в сочетании с системными глюкокортикостероидами позволяет быстро добиться уменьшения клинических проявлений герпетиформного дерматита и значительно увеличить время ремиссии.
Герпетиформный дерматит – хроническое рецидивирующее заболевание кожи, внешние проявления которого схожи с клинической картиной простого герпеса. Герпетиформный дерматит характеризуется полиморфной сгруппированной сыпью и жжением. Впервые был описан в 1884 г. Дюрингом [2].
Распространенность этого заболевания изучена мало, данные, приводимые разными авторами, не совпадают. Отмечается, что наиболее часто герпетиформный дерматит, или дерматит Дюринга, встречается среди североевропейского населения. Согласно последним результатам сорокалетнего проспективного исследования в Финляндии, начатого в 1980 г., частота встречаемости дерматита Дюринга в этом регионе составляет 75,3 на 100 000 населения, при этом средняя ежегодная заболеваемость составляет 3,5 на 100 000 населения [29]. В Швеции распространенность герпетиформного дерматита – 39 на 100 000 человек [23]. Есть данные о частой встречаемости данного заболевания в Шотландии и Ирландии [10, 6]. По результатам исследования, проведенного в США, отмечается умеренная распространенность дерматита Дюринга в штате Юта (11,2 на 100 000 человек) [33]. Необходимо отметить, что среди чернокожих и азиатов это заболевание практически не встречается. Были сообщения лишь о единичных случаях в Японии и Сингапуре [13, 25, 14]. Причины таких этнических и географических особенностей распространенности могут быть связаны как с иммуногенетическими факторами, так и с факторами внешней среды, такими как разница в потреблении пшеницы и изготовленных из нее продуктов. Дерматит Дюринга чаще встречается среди мужского населения. Средний возраст дебюта заболевания – 30–40 лет, однако дерматит может проявляться и в более позднем возрасте, а также в детстве [27]. К примеру, по данным исследований в Венгрии и Италии, дерматит Дюринга в этих странах часто наблюдается среди детского населения [17, 5].
Несмотря на то что данное заболевание известно уже более 100 лет, этиология его до сих пор не выяснена. На данный момент наиболее широкое признание получила аутоиммунная теория. Начиная с 1966 г. появлялись сообщения о наличии у больных с герпетиформным дерматитом изменений слизистой тонкого кишечника по типу глютеновой энтеропатии (целиакии). В этой связи возникло мнение о сходстве этих заболеваний, в пользу которого говорят данные о том, что около 90% больных дерматитом Дюринга и целиакией имеют в шестой хромосоме HLA DQ2 аллели DQA1*0501 и DQB1*02, частота встречаемости которых в генеральной популяции – 20–30% [34, 35]. В пользу общей генетической природы говорят и семейные исследования, по данным которых 4,5–6,5% больных герпетиформным дерматитом имеют родственников первой степени с этим же заболеванием и гораздо больший процент больных – родственников с целиакией [13, 22, 26]. Однако самым сильным аргументом в пользу данного предположения является существование пар монозиготных близнецов, в которых один страдает дерматитом Дюринга, другой – целиакией [15].
При герпетиформном дерматите в сосочках кожи присутствуют гранулярные депозиты IgA [37]. Они находятся в тесной связи с микрофибриллярными пучками эластичных волокон, и большее их количество присутствует вблизи зоны активного поражения [39]. Уже долгое время существует гипотеза, что циркулирующие иммунные комплексы образуются в кишечнике и состоят из антител IgA, соединенных с антигеном; вероятно, при герпетиформном дерматите глютен может быть депонирован в коже [31]. Циркулирующие иммунные комплексы IgA обнаруживаются в сыворотке крови пациентов с герпетиформным дерматитом, количество иммунных комплексов увеличивается после приема в пищу пшеницы [38]. Однако подобные иммунные комплексы IgA обнаруживают и в сыворотке крови больных целиакией, у которых нет ни проявлений дерматита, ни кожных депозитов IgA.
Исследование, проведенное в 2002 г., показало, что IgA депонируются в сосочках дермы в сочетании с трансглутаминазой 3 (Tg3). Также было установлено, что у пациентов с герпетиформным дерматитом, в отличие от пациентов с целиакией, IgA-трансглутаминазные антитела имеют более высокое сродство к Tg3, чем к Tg2. Это позволило предположить, что у пациентов с дерматитом Дюринга вначале развивается скрытая целиакия и лишь затем в результате длительного воздействия глиадина в коже формируется субпопуляция Tg2-антител класса IgA, перекрестно реагирующих с Tg3. Эта гипотеза объясняет, почему герпетиформный дерматит развивается лишь у части больных с целиакией [30].
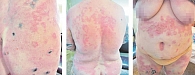
Клинически герпетиформный дерматит проявляется в виде полиморфных высыпаний. В начале болезни могут наблюдаться лишь уртикарные или эритематозно-папулезные элементы. В дальнейшем на эритематозном отечном фоне возникают напряженные пузырьки с прозрачным содержимым, внешне схожие с проявлениями простого герпеса. Появление высыпаний сопровождается интенсивным зудом. Наиболее характерные места высыпаний – локти, колени, ягодицы, кожа головы; расположение высыпаний часто симметричное, прослеживается тенденция к слиянию. Нередко в результате сильных расчесов присоединяется вторичная инфекция [3]. У 50% больных обнаруживается поражение слизистой рта в виде покраснения, изъязвления, очагов атрофий на языке [19]. Кроме того, у 80% детей и 50% взрослых с дерматитом Дюринга обнаруживаются дефекты зубной эмали [1]. Продолжительность обострений варьирует, иногда они могут длиться десятилетиями.
Специфическая энтеропатия обнаруживается у 100% больных герпетиформным дерматитом, однако лишь 10% этих пациентов страдают от таких желудочно-кишечных симптомов, как метеоризм и диарея [7].
Одним из наиболее тяжелых осложнений герпетиформного дерматита и целиакии являются лимфома и другие злокачественные новообразования [11, 12]. По результатам исследований, проведенных в Англии, Швеции и Финляндии, относительный риск развития лимфомы у пациентов с герпетиформным дерматитом возрастает в 100, 5,4 и 10 раз соответственно [4, 20, 32]. Также есть данные об ассоциации дерматита Дюринга и с другими формами рака, такими как рак легких, простаты и толстого кишечника [20, 36, 4]. Некоторые исследователи даже считают, что дерматит Дюринга является одним из вариантов кожных проявлений паранеопластического синдрома [24].
Важную роль в лечении герпетиформного дерматита играет пожизненная безглютеновая диета. Медикаментозная терапия заключается в применении препарата дапсон.
Дапсон – препарат из группы сульфонов, оказывающий бактериостатическое действие в отношении широкого спектра микроорганизмов. Дапсон способен угнетать продукцию цитотоксических радикалов в цепи «миелопероксидаза – пероксид водорода – галогенсодержащие соединения». В ряде исследовательских работ были описаны и другие его эффекты, такие как ингибирование реакции Артюса, системы комплемента при активации по альтернативному пути, ингибирование некоторых лизосомальных ферментных систем, реакции эритроцитов на фитогемагглютинин и угнетение связывания лейкотриена В4 с его специфическими рецепторами. Еще одним немаловажным свойством является способность дапсона оказывать влияние на иммунную систему, а также его анальгезирующее и противовоспалительное действие.
Дапсон практически полностью (70–80%) всасывается при пероральном приеме. Максимальная концентрация препарата в плазме достигается через 2–6 часов. Он хорошо проникает в различные ткани и органы, способен проникать во внутриклеточное пространство фагоцитов. Период полувыведения дапсона относительно долгий, в среднем около 30 часов.
В зарубежной практике рекомендуемая суточная доза препарата составляет 25–100 мг, иногда несколько выше, в зависимости от тяжести клинических проявлений. Чаще всего средняя суточная доза составляет 50–100 мг [8, 28, 9, 21]. Большинство пациентов переносят терапию хорошо, но всегда есть риск развития дозозависимых гематологических побочных эффектов, особенно у пожилых пациентов. Прием дапсона в дозировке 100 мг и выше в сутки вызывает гемолиз и снижает уровень гемоглобина, что может вызвать ухудшение состояния у пациентов с ишемической болезнью сердца и другими сердечно-сосудистыми заболеваниями. У многих больных, принимающих данный препарат в суточной дозе 100 мг, возникает небольшая метгемоглобинемия [21]. После длительного приема более высоких суточных доз дапсона могут появиться сенсорные или двигательные нейропатии [18]. Однако самым тяжелым, хотя и достаточно редким, побочным эффектом такой терапии является агранулоцитоз, который обычно проявляется в течение первых нескольких месяцев лечения [16].
В нашей практике мы применяли дапсон в сочетании с системными глюкокортикостероидами, что было обусловлено остротой процесса (рис. 1). Мы начинали терапию с назначения преднизолона (в дозе 40–80 мг в зависимости от веса пациента) и дапсона (в дозе 50 мг). В отсутствие свежих высыпаний доза преднизолона снижалась по 5 мг в 3–5 дней до полной отмены. Доза дапсона также постепенно уменьшалась до 25 мг. После полного исчезновения высыпаний пациент получал эту же дозу препарата в течение нескольких недель – вначале через день, а затем 2–3 раза в неделю до полной отмены. Такая схема терапии позволяет довольно быстро добиться положительной динамики и значительно увеличить время ремиссии.
Дапсон-Фатол (дапсон)
Противолепрозное средство группы сульфонов. Оказывает бактериостатическое действие. Механизм действия обусловлен ингибированием синтеза фолиевой кислоты возбудителя. Активен в отношении широкого спектра микроорганизмов, но в основном в отношении Mycobacterium leprae, а также Plasmodium, Pneumocystis carinii.
Применяется в составе комбинированной терапии для лечения лепры (болезнь Гансена), герпетиформного дерматита Дюринга, туберкулеза.
Режим дозирования индивидуальный. При герпетиформном дерматите Дюринга – по 50–100 мг 2 раза в сутки циклами по 5–6 дней с перерывом на 1 день, курс – 3–5 циклов и более. Максимальная суточная доза – до 300 мг. После исчезновения клинических проявлений заболевания – в поддерживающей дозе – 50 мг через день или 1–2 раза в неделю. Детям – в начальной дозе 2 мг/кг/сут, при необходимости дозу увеличивают, затем как можно скорее уменьшают до наименьшей эффективной поддерживающей дозы.
Источник: инструкция по применению препарата Дапсон-Фатол
1. Aine L. Coeliac-type permanent-tooth enamel defects // Ann. Med. 1996. Vol. 28. № 1. P. 9–12.
2. Alexander J.O.D. Dermatitis herpetiformis. London: W.B. Saunders Company Ltd, 1975. 346 р.
3. Dermatology / Ed. by O. Braun-Falco, G. Plewig, H.H. Wolff, W.H.C. Burgdorf. Berlin: Springer-Verlag, Heidelberg, 2000.
4. Collin P., Pukkala E., Reunala T. Malignancy and survival in dermatitis herpetiformis: a comparison with coeliac disease // Gut. 1996. Vol. 38. № 4. P. 528–530.
5. Ermacora E., Prampolini L., Tribbia G. et al. Long-term follow-up of dermatitis herpetiformis in children // J. Am. Acad. Dermatol. 1986. Vol. 15. № 1. P. 24–30.
6. Egan C.A., O’Loughlin S., Gormally S. et al. Dermatitis herpetiformis: a review of fifty-four patients // Ir. J. Med. Sci. 1997. Vol. 166. № 4. P. 241–244.
7. Fabbri P. Dermatite erpetiforme // Immunodermatologia. 2nd ed. ISED, Brescia, 2002.
8. Fry L., Seah P.P., Riches D.J. et al. Clearance of skin lesions in dermatitis herpetiformis after gluten withdrawal // Lancet. 1973. Vol. 1. № 7798. P. 288–291.
9. Garioch J.J., Lewis H.M., Sargent S.A. et al. 25 years’ experience of a gluten-free diet in the treatment of dermatitis herpetiformis // Br. J. Dermatol. 1994. Vol. 131. № 4. P. 541–545.
10. Gawkrodger D.J., Blackwell J.N., Gilmour H.M. et al. Dermatitis herpetiformis: diagnosis, diet and demography // Gut. 1984. Vol. 25. № 2. P. 151–157.
11. Gough K.R., Read A.E., Naish J.M. Intestinal reticulosis as a complication of idiopathic steatorrhoea // Gut. 1962. Vol. 3. P. 232–239.
12. Gjone E., Nördoy A. Dermatitis herpetiformis, steatorrhoea, and malignancy // Br. Med. J. 1970. Vol. 1. № 5696. P. 610.
13. Hashimoto K., Miki Y., Nishioka K. et al. HLA antigens in dermatitis herpetiformis among Japanese // J. Dermatol. 1980. Vol. 7. № 4. P. 289–291.
14. Hall R.P., Clark R.E., Ward F.E. Dermatitis herpetiformis in two American blacks: HLA type and clinical characteristics // J. Am. Acad. Dermatol. 1990. Vol. 22. № 3. P. 436–439.
15. Hervonen K., Karell K., Holopainen P. et al. Concordance of dermatitis herpetiformis and celiac disease in monozygous twins // J. Invest. Dermatol. 2000. Vol. 115. № 6. P. 990–993.
16. Hörnsten P., Keisu M., Wiholm B.E. The incidence of agranulocytosis during treatment of dermatitis herpetiformis with dapsone as reported in Sweden, 1972 through 1988 // Arch. Dermatol. 1990. Vol. 126. № 7. P. 919–922.
17. Kárpáti S., Kósnai I., Verkasalo M. et al. HLA antigens, jejunal morphology and associated diseases in children with dermatitis herpetiformis // Acta Paediatr. Scand. 1986. Vol. 75. № 2. P. 297–301.
18. Kastrup W., Mobacken H., Stockbrügger R. et al. Malabsorption of vitamin B12 in dermatitis herpetiformis and its association with pernicious anaemia // Acta Med. Scand. 1986. Vol. 220. № 3. P. 261–268.
19. Lähteenoja H., Irjala K., Viander M. et al. Oral mucosa is frequently affected in patients with dermatitis herpetiformis // Arch. Dermatol. 1998. Vol. 134. № 6. P. 756–758.
20. Leonard J.N., Tucker W.F., Fry J.S. et al. Increased incidence of malignancy in dermatitis herpetiformis // Br. Med. J. (Clin. Res. Ed.). 1983. Vol. 286. № 6358. P. 16–18.
21. Leonard J.N., Fry L. Treatment and management of dermatitis herpetiformis // Clin. Dermatol. 1991. Vol. 9. № 3. P. 403–408.
22. Meyer L.J., Zone J.J. Familial incidence of dermatitis herpetiformis // J. Am. Acad. Dermatol. 1987. Vol. 17. № 4. P. 643–647.
23. Moi H. Incidence and prevalence of dermatitis herpetiformis in a country in central Sweden, with comments on the course of the disease and IgA deposits as diagnostic criterion // Acta Derm. Venerol. 1984. Vol. 64. № 2. P. 144–150.
24. Mori S. Useful cutaneous markers of internal malignancy in the early stage // Gan To Kagaku Ryoho. 1988. Vol. 15. № 4. Pt. 2–3. P. 1564–1568.
25. Ratnam K.V. IgA dermatosis in an adult Chinese population. A 10-year study of linear IgA and dermatitis herpetiformis in Singapore // Int. J. Dermatol. 1988. Vol. 27. № 1. P. 21–24.
26. Reunala T. Incidence of familial dermatitis herpetiformis // Br. J. Dermatol. 1996. Vol. 134. № 3. P. 394–398.
27. Reunala T.L. Dermatitis herpetiformis // Clin. Dermatol. 2001. Vol. 19. № 6. P. 728–736.
28. Reunala T., Blomqvist K., Tarpila S. et al. Gluten-free diet in dermatitis herpetiformis. I. Clinical response of skin lesions in 81 patients // Br. J. Dermatol. 1977. Vol. 97. № 5. P. 473–480.
29. Salmi T.T., Hervonen K., Kautiainen H. et al. Prevalence and incidence of dermatitis herpetiformis: a 40-year prospective study from Finland // Br. J. Dermatol. 2011. Vol. 165. № 2. P. 354–359.
30. Sárdy M., Kárpáti S., Merkl B. et al. Epidermal transglutaminase (TGase 3) is the autoantigen of dermatitis herpetiformis // J. Exp. Med. 2002. Vol. 195. № 6. P. 747–757.
31. Seah P.P., Fry L., Hoffbrand A.V. et al. Tissue antibodies in dermatitis herpetiformis and adult coeliac disease // Lancet. 1971. Vol. 1. № 7704. P. 834–836.
32. Sigurgeirsson B., Agnarsson B.A., Lindelöf B. Risk of lymphoma in patients with dermatitis herpetiformis // BMJ. 1994. Vol. 308. № 6920. P. 13–15.
33. Smith J.B., Tulloch J.E., Meyer L.J. et al. The incidence and prevalence of dermatitis herpetiformis in Utah // Arch. Dermatol. 1992. Vol. 128. № 12. P. 1608–1610.
34. Sollid L.M., Markussen G., Ek J. et al. Evidence for a primary association of celiac disease to a particular HLA-DQ alpha/beta heterodimer // J. Exp. Med. 1989. Vol. 169. № 1. P. 345–350.
35. Spurkland A., Ingvarsson G., Falk E.S. et al. Dermatitis herpetiformis and celiac disease are both primarily associated with the HLA-DQ (alpha 1*0501, beta 1*02) or the HLA-DQ (alpha 1*03, beta 1*0302) heterodimers // Tissue Antigens. 1997. Vol. 49. № 1. P. 29–34.
36. Swerdlow A.J., Whittaker S., Carpenter L.M. et al. Mortality and cancer incidence in patients with dermatitis herpetiformis: a cohort study // Br. J. Dermatol. 1993. Vol. 129. № 2. P. 140–144.
37. Van der Meer J.B. Granular deposits of immunoglobulins in the skin of patients with dermatitis herpetiformis. An immunofluorescent study // Br. J. Dermatol. 1969. Vol. 81. № 7. P. 493–503.
38. Zone J.J., LaSalle B.A., Provost T.T. Induction of IgA circulating immune complexes after wheat feeding in dermatitis herpetiformis patients // J. Invest. Dermatol. 1982. Vol. 78. № 5. P. 375–380.
39. Zone J.J., Meyer L.J., Petersen M.J. Deposition of granular IgA relative to clinical lesions in dermatitis herpetiformis // Arch. Dermatol. 1996. Vol. 132. № 8. P. 912–918.
Новости на тему
29.01.2021
29.07.2015
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.